甘肃省宁县2018-2019学年高二上学期化学期末考试试卷
试卷更新日期:2019-02-14 类型:期末考试
一、单选题
-
1. 下列属于化石燃料的是( )A、氢气 B、木柴 C、煤 D、酒精2. 下列属于放热反应的是( )A、生石灰和水 B、碳酸钙高温分解 C、灼热的碳和二氧化碳 D、Ba(OH)2·8H2O晶体和NH4Cl3. 原电池是( )装置A、化学能转化为电能 B、电能转化为化学能 C、热能转化为化学能 D、化学能转化为热能4. 下图为水果电池的示意图,下列说法正确的是( )
 A、锌片作负极,质量逐渐减少 B、电子由铜片沿导线流向锌片 C、铜电极逐渐溶解 D、该装置能将电能转化为化学能5. 工业上常用电解法冶炼的金属是( )A、钠 B、铁 C、铜 D、银6. —定条件下,在密闭容器中进行反应:N2(g)+3H2(g) 2NH3 (g),当N2、H2、NH3的浓度不再改变时,下列说法正确的是( )A、N2、H2完全转化为NH3 B、N2、H2、NH3的浓度一定相等 C、正、逆反应速率相等且等于零 D、反应已达到化学平衡状态7. 下列物质溶于水后溶液显酸性的是( )A、Na2O2 B、CaCl2 C、FeCl3 D、CH3COONa8. 下列属于非电解质的是( )A、氢气 B、蔗糖溶液 C、己烷 D、硫化钠9. 下列说法正确的是 ( )A、需要加热才能发生的反应一定是吸热反应 B、放热反应在常温下一定很容易发生 C、放热反应还是吸热反应主要由反应物、生成物所具有的总能量的相对大小决定 D、吸热反应发生过程中要不断从外界获得能量,放热反应不需要外界能量10. 应对能源危机的有效途径之一就是寻找新能源.下列属于新能源的是( )A、煤 B、石油 C、太阳能 D、天然气11. 下列事实不能用勒夏特列原理来解释的是( )A、增大压强,有利于SO2和O2反应生成SO3 B、热的纯碱溶液去油污能力较强 C、加催化剂使N2和H2在一定条件下转化为NH3 D、常温下pH=3的H2SO4溶液中水的电离程度小于pH=3的NH4Cl溶液中水的电离程度12. 电化学装置工作时,下列电极上发生的反应一定是氧化反应的是( )A、阴极 B、负极 C、铜电极 D、石墨电极13. pH=a的某电解质溶液中,插入两支惰性电极,通直流电一段时间后,溶液的pH>a,则该电解质可能是( )A、Na2SO4 B、H2SO4 C、AgNO3 D、NaCl14. 设C+CO2 2CO ΔH>0,反应速率为v1 , N2+3H2 2NH3 ΔH<0,反应速率为v2 , 对于上述反应,当温度升高时,v1和v2的变化情况为( )A、同时增大 B、同时减小 C、增大,减小 D、减小,增大15. 下列方程式中,能够正确表示水解反应的是( )
A、锌片作负极,质量逐渐减少 B、电子由铜片沿导线流向锌片 C、铜电极逐渐溶解 D、该装置能将电能转化为化学能5. 工业上常用电解法冶炼的金属是( )A、钠 B、铁 C、铜 D、银6. —定条件下,在密闭容器中进行反应:N2(g)+3H2(g) 2NH3 (g),当N2、H2、NH3的浓度不再改变时,下列说法正确的是( )A、N2、H2完全转化为NH3 B、N2、H2、NH3的浓度一定相等 C、正、逆反应速率相等且等于零 D、反应已达到化学平衡状态7. 下列物质溶于水后溶液显酸性的是( )A、Na2O2 B、CaCl2 C、FeCl3 D、CH3COONa8. 下列属于非电解质的是( )A、氢气 B、蔗糖溶液 C、己烷 D、硫化钠9. 下列说法正确的是 ( )A、需要加热才能发生的反应一定是吸热反应 B、放热反应在常温下一定很容易发生 C、放热反应还是吸热反应主要由反应物、生成物所具有的总能量的相对大小决定 D、吸热反应发生过程中要不断从外界获得能量,放热反应不需要外界能量10. 应对能源危机的有效途径之一就是寻找新能源.下列属于新能源的是( )A、煤 B、石油 C、太阳能 D、天然气11. 下列事实不能用勒夏特列原理来解释的是( )A、增大压强,有利于SO2和O2反应生成SO3 B、热的纯碱溶液去油污能力较强 C、加催化剂使N2和H2在一定条件下转化为NH3 D、常温下pH=3的H2SO4溶液中水的电离程度小于pH=3的NH4Cl溶液中水的电离程度12. 电化学装置工作时,下列电极上发生的反应一定是氧化反应的是( )A、阴极 B、负极 C、铜电极 D、石墨电极13. pH=a的某电解质溶液中,插入两支惰性电极,通直流电一段时间后,溶液的pH>a,则该电解质可能是( )A、Na2SO4 B、H2SO4 C、AgNO3 D、NaCl14. 设C+CO2 2CO ΔH>0,反应速率为v1 , N2+3H2 2NH3 ΔH<0,反应速率为v2 , 对于上述反应,当温度升高时,v1和v2的变化情况为( )A、同时增大 B、同时减小 C、增大,减小 D、减小,增大15. 下列方程式中,能够正确表示水解反应的是( )
A、HCO3-+H2O CO32-+H3O+
B、S2-+2H2O
CO32-+H3O+
B、S2-+2H2O  H2S+2OH-
C、CO2+H2O
H2S+2OH-
C、CO2+H2O  HCO3-+H+
D、CO32-+ H2O
HCO3-+H+
D、CO32-+ H2O  HCO3-+OH-
16. 一定温度下,在恒容密闭容器中发生可逆反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,当反应达到平衡时,各物质的浓度可能是( )A、c(X2)=0.2mol/L B、c(Y2)=0.4mol/L C、c(Z)=0.3mol/L D、c(X2)+c(Y2)+c(Z)=0.5mol/L17. 下列物质在水溶液中促进了水的电离的是( )A、NaHSO4 B、HClO C、Na2SO4 D、CuSO418. 在反应2A(g) + B(g) 3C(s) + 4D(g) 中,下列关系正确的是( )A、2ν(A)=ν(B) B、3ν(B)=ν(C) C、4ν(C)=3ν(D) D、2ν(A)=ν(D)
HCO3-+OH-
16. 一定温度下,在恒容密闭容器中发生可逆反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,当反应达到平衡时,各物质的浓度可能是( )A、c(X2)=0.2mol/L B、c(Y2)=0.4mol/L C、c(Z)=0.3mol/L D、c(X2)+c(Y2)+c(Z)=0.5mol/L17. 下列物质在水溶液中促进了水的电离的是( )A、NaHSO4 B、HClO C、Na2SO4 D、CuSO418. 在反应2A(g) + B(g) 3C(s) + 4D(g) 中,下列关系正确的是( )A、2ν(A)=ν(B) B、3ν(B)=ν(C) C、4ν(C)=3ν(D) D、2ν(A)=ν(D)二、填空题
-
19. 氯化铝水溶液呈性,原因是(用离子方程式表示): . 把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 .20. 对于反应3X(g)+Y(g)⇌Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):(1)、升高温度:;(2)、增大压强:;(3)、增大容器容积: .21. 比较下列各组热化学方程式中ΔH的大小关系。(1)、S(s)+O2(g)=SO2(g) ΔH1
S(g)+O2(g)=SO2(g) ΔH2
ΔH1ΔH2
(2)、CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH2
ΔH1ΔH2
(3)、4Al(s)+3O2(g)=2Al2O3(s) ΔH14Fe(s)+3O2(g)=2Fe2O3(s) ΔH2
ΔH1ΔH2
22. 指出下列能量的变化(1)、学校燃烧煤煮饭 ,(2)、用畜电池点亮灯泡 。23. 原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置: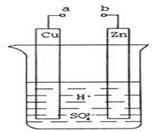
①a和b不连接时,烧杯中现象是。
②a和b用导线连接,Cu极为原电池极(填“正”或“负”),电极反应式为:;溶液中H+移向(填“Cu”或“Zn”)极。电池总反应式为:。
③若电解质溶液改为AgNO3溶液,当转移0.2mol电子时,则理论上Cu片质量变化为g。
24. 恒温恒容下,将2mol气体A和2mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g) xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。(1)、从开始反应至达到平衡状态,生成C的平均反应速率为。(2)、x=。(3)、下列各项可作为该反应达到平衡状态的标志是_________(填字母)。A、压强不再变化 B、气体密度不再变化 C、气体平均相对分子质量不再变化 D、A的消耗速率与B的消耗速率之比为2:1