2017年山西省重点中学协作体高考化学模拟试卷(一)
试卷更新日期:2017-04-17 类型:高考模拟
一、选择题
-
1. 化学与生产、生活密切相关.下列叙述正确的是( )A、煤的干馏和煤的液化均是物理变化 B、天然纤维和合成纤维的主要成分都是纤维素 C、海水淡化的方法有蒸馏法、电渗析法等 D、用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同2. 《新修本草》是我国古代中药学著作之一,记载药物844种,其中有关于“青矾”的描述为:“本来绿色,新出窟未见风者,正如瑠璃…烧之赤色…”据此推测,“青矾”的主要成分为( )
A、CuSO4•5H2O B、FeSO4•7H2O C、KAl(SO4)2•12H2O D、Fe2(SO4)3•9H2O3. 下列图示与对应的叙述相符的是( )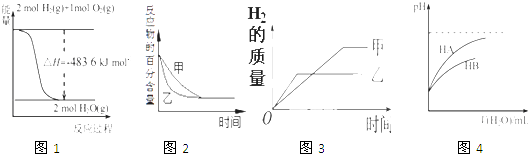 A、图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ•mol﹣1 B、图2表示压强对可逆反应2A(g)+2 B(g)⇌3C(g)+D(s)的影响,乙的压强比甲的压强大 C、图3表示等质量的钾、钠分别与足量水反应,则甲为钠 D、图4表示常温下,稀释HA,HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH4. 如图所示,甲池的总反应式为:N2H4+O2═N2+2H2O下列关于该电池工作时说法正确的是( )
A、图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ•mol﹣1 B、图2表示压强对可逆反应2A(g)+2 B(g)⇌3C(g)+D(s)的影响,乙的压强比甲的压强大 C、图3表示等质量的钾、钠分别与足量水反应,则甲为钠 D、图4表示常温下,稀释HA,HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH4. 如图所示,甲池的总反应式为:N2H4+O2═N2+2H2O下列关于该电池工作时说法正确的是( )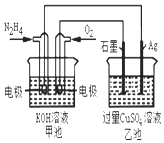 A、甲池中负极反应为:N2H4﹣4e﹣═N2+4H+ B、甲池溶液pH不变,乙池溶液pH减小 C、反应一段时间后,向乙池中加一定量CuO固体,能使CuSO4溶液恢复到原浓度 D、甲池中消耗2.24L O2 , 此时乙池中理论上最多产生12.8g固体5. 药物阿司匹林可由水杨酸制得,它们的结构如图所示.有关说法正确的是( )
A、甲池中负极反应为:N2H4﹣4e﹣═N2+4H+ B、甲池溶液pH不变,乙池溶液pH减小 C、反应一段时间后,向乙池中加一定量CuO固体,能使CuSO4溶液恢复到原浓度 D、甲池中消耗2.24L O2 , 此时乙池中理论上最多产生12.8g固体5. 药物阿司匹林可由水杨酸制得,它们的结构如图所示.有关说法正确的是( )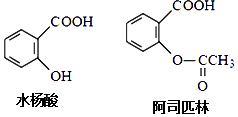 A、服用阿司匹林,身体出现水杨酸不良反应时,可静脉注射NaHCO3溶液 B、阿司匹林的分子式为C9H10O4 C、水杨酸可以发生取代、加成、氧化、加聚反应 D、1 mol阿司匹林最多可消耗2 mol NaOH6. 下列说法不正确的是( )A、常温下,在0.1mol•L﹣1的HNO3溶液中,由水电离出的c(H+)< B、浓度为0.1mol•L﹣1的NaHCO3溶液:c(H2CO3)>c(CO32﹣) C、25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同 D、冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小7. 在100mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.3mol•L﹣1、0.15mol•L﹣1 , 向该混合液中加入2.56g铜粉,加热,待充分反应后,所得溶液中铜离子的物质的量浓度是( )A、0.15 mol•L﹣1 B、0.225 mol•L﹣1 C、0.30 mol•L﹣1 D、0.45 mol•L﹣1
A、服用阿司匹林,身体出现水杨酸不良反应时,可静脉注射NaHCO3溶液 B、阿司匹林的分子式为C9H10O4 C、水杨酸可以发生取代、加成、氧化、加聚反应 D、1 mol阿司匹林最多可消耗2 mol NaOH6. 下列说法不正确的是( )A、常温下,在0.1mol•L﹣1的HNO3溶液中,由水电离出的c(H+)< B、浓度为0.1mol•L﹣1的NaHCO3溶液:c(H2CO3)>c(CO32﹣) C、25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同 D、冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小7. 在100mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.3mol•L﹣1、0.15mol•L﹣1 , 向该混合液中加入2.56g铜粉,加热,待充分反应后,所得溶液中铜离子的物质的量浓度是( )A、0.15 mol•L﹣1 B、0.225 mol•L﹣1 C、0.30 mol•L﹣1 D、0.45 mol•L﹣1二、解答题
-
8. 废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4•5H2O)及副产物ZnO.制备流程图如下:
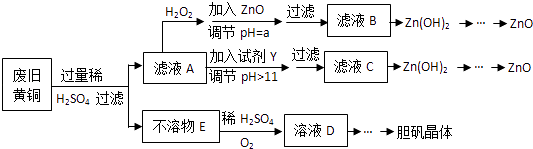
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2﹣下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L﹣1计算).
Fe3+
Fe2+
Zn2+
开始沉淀的pH
1.1
5.8
5.9
沉淀完全的pH
3.0
8.8
8.9
请回答下列问题:
(1)、加入ZnO调节pH=a的目的是 , a的范围是 .(2)、由不溶物E生成溶液D的化学方程式为 .(3)、滤液A中加入H2O2反应的离子方程式为 .(4)、由溶液D制胆矾晶体包含的主要操作步骤是 .(5)、下列试剂可作为Y试剂的是 .A.ZnO B.NaOH C.Na2CO3D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是 .
9. CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3 , 还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如图1: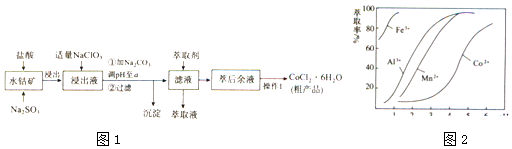
已知:
①浸出液含有的阳离子主要有H+、CO2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表(金属离子浓度为0.01mol/L):
淀物
Fe(OH)3
Fe(OH)2
Co(OH)2
Al(OH)3
Mn(OH)2
开始沉淀
2.7
7.6
7.6
4.0
7.7
完全沉淀
3.7
9.6
9.2
5.2
9.8
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)、写出浸出过程中Co2O3发生反应的离子方程式: .(2)、写出NaClO3发生反应的主要离子方程式:;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式: .(3)、惰性电极电解CoCl2溶液的阳极电极反应式为 . (注:横坐标依次为1﹣6;单位PH)(4)、“操作1”中包含3个基本实验操作,它们依次是、和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是 .(5)、萃取剂对金属离子的萃取率与pH的关系如图向“滤液”中加入萃取剂的目的是 , 其使用的最佳pH范围是A. 2.0~2.5B. 3.0~3.5C. 4.0~4.5D. 5.0~5.5
(6)、力测定粗产品中CoCl2•H2O的含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是 . (答一条即可)10. 某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究.(1)、提出假设 ①该反应的气体产物是CO2 .②该反应的气体产物是CO.
③该反应的气体产物是 .
(2)、设计方案如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比.
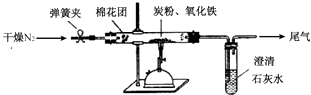
查阅资料:
氮气不与碳、氧化铁发生反应.实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)
饱和溶液混合加热反应制得氮气.
请写出该反应的离子方程式: .
(3)、实验步骤①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气.冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g.
步骤②、④中都分别通入N2 , 其作用分别为 .
(4)、数据处理试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式: .
(5)、实验优化 学习小组有同学认为应对实验装置进一步完善.①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是 .
②从环境保护的角度,请你再提出一个优化方案将此实验装置进一步完善:
11. 3﹣对甲苯丙烯酸甲酯(E)是一种用于合成抗血栓药的中间体,其合成路线如下: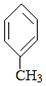 +CO
+CO 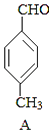 B
B 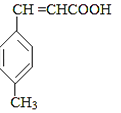 E
E已知:HCHO+CH3CHO CH2═CHCHO+H2O
(1)、A中官能团的名称为 , A分子中核磁共振氢谱各峰值比为(2)、物质B的结构简式为 , 生成E的反应类型为(3)、试剂C可选用下列中的 .a.溴水 b.银氨溶液 c.酸性KMnO4溶液 d.新制Cu(OH)2悬浊液
(4)、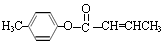 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为 . (5)、遇FeCl3溶液呈紫色,且苯环上有两个取代基的A的同分异构体有种,E在一定条件下可以生成高聚物F,F的结构简式为 .
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为 . (5)、遇FeCl3溶液呈紫色,且苯环上有两个取代基的A的同分异构体有种,E在一定条件下可以生成高聚物F,F的结构简式为 .