2017年湖北省武汉市武昌区高考化学模拟试卷
试卷更新日期:2017-04-17 类型:高考模拟
一、选择题
-
1. 化学与生活、社会发展息息相关.下列说法不正确的是( )A、用SO2漂白过的草帽日久会变色 B、用天然气代替煤作燃料可减少大气污 C、“84消毒液”杀死病菌是因为蛋白质变性 D、乙醇用作医用消毒剂时,无水乙醇消毒效果最好2. 设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )A、107 g Fe(OH)3胶体中胶体粒子的数目为NA B、2molSO2与1molO2反应生成的SO3分子数为2NA C、14g分子式为CnH2n的链烃中含有的碳碳双键的数目为
 D、7.8 g Na2O2与足量水反应转移的电子散为0.2NA
3. 已知甲苯的结构简式为
D、7.8 g Na2O2与足量水反应转移的电子散为0.2NA
3. 已知甲苯的结构简式为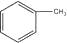 ,其二氯代物的同分异构体有( ) A、7种 B、8种 C、9种 D、10种4. 下列选用的仪器和药品能达到实验目的是( )
,其二氯代物的同分异构体有( ) A、7种 B、8种 C、9种 D、10种4. 下列选用的仪器和药品能达到实验目的是( )A
B
C
D
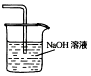


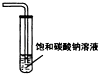
尾气吸收Cl2
吸收CO2中的HCl杂质
蒸馏时的接收装置
乙酸乙酯的收集装置
A、A B、B C、C D、D5. 碱性硼化钒﹣﹣空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5 , 室温下用该电池为电源,用惰性电极电解饱和氛化钠溶液,装置如图.当外电路中通过0.04mol电子时,乙装置中溶液的体积为400mL.则下列说法正确的是( )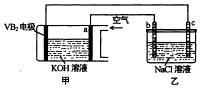 A、外电路中电子由a电极流向b电极 B、电极上生成气体的体积为4.48L C、乙装置中溶液的pH为13 D、VB2电极发生的电极反应为:VB2+11H2O﹣22e﹣=VB2+2B2O3+22H+6. 常温下,0.1mol/L的H2C2O4溶液中H2C2O4、HC2O4﹣、C2O42﹣三者中所占物质的量分数〔分布系数)随pH变化的关系如图所示.下列表述不正确的是( )
A、外电路中电子由a电极流向b电极 B、电极上生成气体的体积为4.48L C、乙装置中溶液的pH为13 D、VB2电极发生的电极反应为:VB2+11H2O﹣22e﹣=VB2+2B2O3+22H+6. 常温下,0.1mol/L的H2C2O4溶液中H2C2O4、HC2O4﹣、C2O42﹣三者中所占物质的量分数〔分布系数)随pH变化的关系如图所示.下列表述不正确的是( )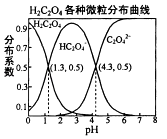 A、HC2O4﹣⇌H++C2O42﹣ , K=1×10﹣4.3 B、将等物质的量的NaHC2O4、NAa2C2O4溶于水中,所得溶液PH恰好为4.3 C、常温下HF的KB=1×10﹣﹣3.45 , 将少量H2C2O4溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F﹣=HF+HC2O4﹣ D、在0.1mol/LNaHC2O4溶液中,各离子浓度大小关系为:c(Na+)>c(HC2O4﹣)>c(C2O42﹣)>c(OH﹣)7. 短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为5:2.Z原子比X原子的核外电子数多5.下列说法正确的是( )A、W、Y的最高价氧化物都是气体 B、Y、Z形成的化合物一定为共价化合物 C、四种元素中W元素的非金属性最强 D、W、X、Y、Z的原子半径大小顺序一定是:Z>Y>X>W
A、HC2O4﹣⇌H++C2O42﹣ , K=1×10﹣4.3 B、将等物质的量的NaHC2O4、NAa2C2O4溶于水中,所得溶液PH恰好为4.3 C、常温下HF的KB=1×10﹣﹣3.45 , 将少量H2C2O4溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F﹣=HF+HC2O4﹣ D、在0.1mol/LNaHC2O4溶液中,各离子浓度大小关系为:c(Na+)>c(HC2O4﹣)>c(C2O42﹣)>c(OH﹣)7. 短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为5:2.Z原子比X原子的核外电子数多5.下列说法正确的是( )A、W、Y的最高价氧化物都是气体 B、Y、Z形成的化合物一定为共价化合物 C、四种元素中W元素的非金属性最强 D、W、X、Y、Z的原子半径大小顺序一定是:Z>Y>X>W二、解答题
-
8. 碳酸锂(相对分子质量74)广泛应用于化工、冶金等行业.工业上利用锂辉石(Li2Al2Si4Ox)制备碳酸锂的流程如图:
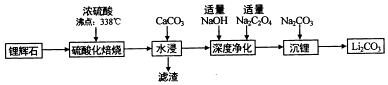
已知:碳酸锂的溶解度为((g/L)
温度
0
10
20
30
40
50
60
80
100
Li2CO3
1.54
1.43
1.33
1.25
1.17
1.08
1.01
0.85
0.72
请回答下列问题:
(1)、锂辉(Li2Al2Si4Ox)可以用氧化物的形式表示其组成,形式为(2)、硫酸化焙烧温度控制在250℃﹣300℃之间,主要原因是 . 焙烧中硫酸用量控制在理论用最的l15%左右,硫酸加入过多的副作用是 .(3)、水浸时,加入CaCO3粉末充分反应后过滤,滤渣的主要成分除CaCO3外还有 .(4)、“沉锂”的化学反应方程式为 .(5)、“沉锂”需要在95℃以上进行,主耍原因是 . 过滤碳酸锂所得母液中主要含有硫酸钠,还可能含有和 .9. 三氯化硼是一种重要的化工原料,某同学设计的三氯化硼制备装置如图.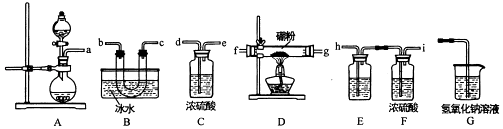
【查阅资料】
①BCl3:的熔点为﹣107.3℃,沸点为12.5℃
②2B+6HCl 2BCl3+3h2
③硼与侣的性质相似,也能与氢氧化钠溶液反应
请回答下列题:
(1)、A装置可用高高锰酸钾固体与浓盐酸反应制氯气,反应的化学方程式为 .(2)、为了完成三氯化硼的制备,装置从左到右的接口连接顺序为 .(3)、装里E中的试剂为 . 如果拆去E装置,可能的后果是 .(4)、D装置中发生反应前先通入一段时间的氯气,其目的是 . 该装置中发生反应的化学方程式为 .(5)、三氯化硼与水能剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式 .(6)、请设计一个简易实验,验证制得的产品中是否含有硼粉 .10. “雾霾”成为人们越来越关心的环境问题.雾霾中含有二氧化硫、氮氧化物和可吸入颗粒物等污染性物质.请回答下列问题:(1)、汽车尾气是雾霾形成的原因之一.尾气治理可用汽油中挥发出来的烃类物质(CxHy)催化还原尾气中的NO气体,该过程的化学方程式为 .
(2)、冬季燃煤供暖产生的废气也是雾霾的主要来源之一.经研究发现将煤炭在 的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为: .2NO(g)+2CO(g)⇌N2(g)+2CO2 (g)△H
已知:
①N2(g)+O2(g)⇌2NO(g)△H1=+180.5kJ•mol﹣1
②2CO(g)⇌2C(s)+O2(g)△H2=+221kJ•mol﹣1
③C(s)+O2(g)⇌CO2(g)△H3=﹣393.5kJ•mol﹣1
则△H=
(3)、某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图一所示,电极材料为石墨.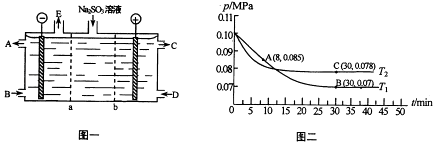
①a表示离子交换膜(填“阴”或“阳”).A﹣E分别代表生产中的原料或产品.其中C为硫酸,则A表示 . E表示 .
②阳极的电极反应式为 .
(4)、SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)⇌2SO3(g).若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2):n(O2)=2:1],测得容器内总压强与反应时间如图二所示.
①图中A点时,SO2的转化率为 .
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,刻C点的正反应
速率vc(正)与A点的逆反应速率vc (逆)的大小关系为vc(正) vc (逆) (填“>”、“<”或“=”)
③图中B点的压强平衡常数kp=(用平衡分压代替平衡浓度计算.分压=总压×物质的量分数).
11.1,6一己二酸(G)是合成尼龙的主要原料之一,可用烃A氧化制备.制备G的合成路线如图1:
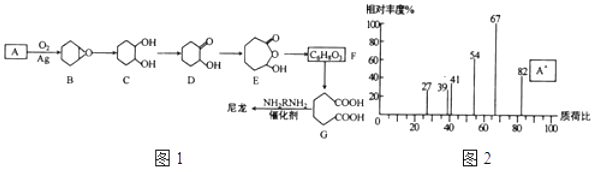
回答下列问题:
(1)、化合物A的质谱图如图2,则A的化学名称为 .(2)、C→D的反应类型为 .(3)、F的结构简式为 .(4)、由G合成尼龙的化学方程式为 .(5)、由A通过两步反应制备1,3﹣环己二烯的合成路线为