浙江省台州市温岭市团队六校2018-2019学年九年级上学期科学期中调研考试试卷
试卷更新日期:2019-02-12 类型:期中考试
一、选择题
-
1. 下列变化中属于化学变化的是( )A、榨取果汁
 B、粉碎废纸
B、粉碎废纸  C、切割玻璃
C、切割玻璃  D、燃放烟花
D、燃放烟花  2. 下列化学实验基本操作中,正确的是( )A、把固体氢氧化钠放在天平左盘的纸上称量 B、测定溶液的pH时,将pH试纸浸入待测液中,立即取出与比色卡对照 C、为了不浪费药品,用剩的药品应放回原试剂瓶中 D、给试管中的固体药品加热时,试管口应稍向下倾斜3. 下列各组物质中,主要成分的名称和化学式表示的不是同一种物质的是( )A、苛性钠、氢氧化钠、NaOH B、盐酸、氯化氢水溶液、HCl C、烧碱、碳酸钠、Na2CO3 D、食盐、氯化钠、NaCl4. 金属Ni、Zn分别放入其他三种金属盐X、Y、Z的溶液中,置换反应的结果,有无金属析出的情况如下:
2. 下列化学实验基本操作中,正确的是( )A、把固体氢氧化钠放在天平左盘的纸上称量 B、测定溶液的pH时,将pH试纸浸入待测液中,立即取出与比色卡对照 C、为了不浪费药品,用剩的药品应放回原试剂瓶中 D、给试管中的固体药品加热时,试管口应稍向下倾斜3. 下列各组物质中,主要成分的名称和化学式表示的不是同一种物质的是( )A、苛性钠、氢氧化钠、NaOH B、盐酸、氯化氢水溶液、HCl C、烧碱、碳酸钠、Na2CO3 D、食盐、氯化钠、NaCl4. 金属Ni、Zn分别放入其他三种金属盐X、Y、Z的溶液中,置换反应的结果,有无金属析出的情况如下:X盐
Y盐
Z盐
Ni
无
无
有
Zn
无
有
有
它们的金属活动性递减的顺序是( )
A、X、Zn、Ni、Y、Z B、X、Y、Ni、Zn、Z C、Z、Zn、Y、Ni、X D、X、Zn、Y、Ni、Z5. 下列实验操作规范的是( )
A、 B、
B、 C、
C、 D、
D、 6. 下列关于氢氧化钠的性质叙述不正确的是 ( )A、氢氧化钠溶液能使紫色石蕊试液变红 B、可作某些气体的干燥剂 C、广泛用于肥皂、石油、造纸等工业 D、对皮肤、衣服有强烈腐蚀作用7. 下列物质不属于有机合成材料的是( )A、塑料 B、合金 C、合成橡胶 D、合成纤维8. 已知水的沸点随压强的减少而降低。现有如图所示实验装置,夹子开始处于关闭状态。将液体A滴入试管②与气体B充分反应后,打开夹子,发现试管①内的水立刻沸腾。则液体A和气体B的组合可能是( )
6. 下列关于氢氧化钠的性质叙述不正确的是 ( )A、氢氧化钠溶液能使紫色石蕊试液变红 B、可作某些气体的干燥剂 C、广泛用于肥皂、石油、造纸等工业 D、对皮肤、衣服有强烈腐蚀作用7. 下列物质不属于有机合成材料的是( )A、塑料 B、合金 C、合成橡胶 D、合成纤维8. 已知水的沸点随压强的减少而降低。现有如图所示实验装置,夹子开始处于关闭状态。将液体A滴入试管②与气体B充分反应后,打开夹子,发现试管①内的水立刻沸腾。则液体A和气体B的组合可能是( ) A、A为氯化钙溶液,B为二氧化碳气体 B、A为氢氧化钠溶液,B为氯化氢气体 C、A为氢氧化钙溶液.B为一氧化碳气体 D、A为稀硫酸溶液,B为氢气气体9. 下列家庭小实验不能成功的是( )A、用食盐水除去菜刀表面的铁锈 B、用玻璃杯、口罩、筷子做粗盐提纯实验 C、用食醋鉴别食盐和纯碱 D、用涂油漆方法防止铁生锈10. 将下列各组中的物质混合,若每组中最后一种物质过量,充分反应后过滤,则滤纸上仅留下一种不溶性物质(纯净物)的是( )
A、A为氯化钙溶液,B为二氧化碳气体 B、A为氢氧化钠溶液,B为氯化氢气体 C、A为氢氧化钙溶液.B为一氧化碳气体 D、A为稀硫酸溶液,B为氢气气体9. 下列家庭小实验不能成功的是( )A、用食盐水除去菜刀表面的铁锈 B、用玻璃杯、口罩、筷子做粗盐提纯实验 C、用食醋鉴别食盐和纯碱 D、用涂油漆方法防止铁生锈10. 将下列各组中的物质混合,若每组中最后一种物质过量,充分反应后过滤,则滤纸上仅留下一种不溶性物质(纯净物)的是( )①氢氧化钠溶液、氯化镁溶液、硝酸;②氯化钡溶液、硝酸钠溶液、稀硫酸;③氯化铜溶液、氯化亚铁溶液、锌粒;④氯化钠溶液、硝酸银溶液、盐酸;⑤硫酸铁溶液、硝酸钠溶液、氢氧化钡溶液;
A、②④ B、②③ C、③⑤ D、①④11. 除去下列物质中混有的杂质,所选用的试剂及操作方法均正确的是( )物质
杂质
除杂质应选用的试剂和操作方法
A
CO2
CO
通入O2点燃
B
NaOH固体
Na2CO3固体
加入过量盐酸,蒸发
C
KNO3溶液
KOH溶液
加入适量的CuSO4溶液,过滤
D
Cu(NO3)2溶液
AgNO3溶液
加入过量的铜粉,过滤
A、A B、B C、C D、D12. 某化学小组利用混有少量CO2的CO气体还原CuO,并验证反应后的气体的产物。实验装置如图所示(可重复使用)。按气体从左到右的方向,装置连接顺序正确的是( ) A、丙→甲→乙→丁 B、甲→丙→乙→丁 C、丙→乙→甲→乙→丁 D、乙→甲→丙→乙→丁13. 把一定量的锌和镁分别投入足量的稀盐酸中,充分反应后,生成氢气的质量关系如图所示(图中m表示氢气的质量,t表示反应时间),则投入的锌与镁的质量比是( )
A、丙→甲→乙→丁 B、甲→丙→乙→丁 C、丙→乙→甲→乙→丁 D、乙→甲→丙→乙→丁13. 把一定量的锌和镁分别投入足量的稀盐酸中,充分反应后,生成氢气的质量关系如图所示(图中m表示氢气的质量,t表示反应时间),则投入的锌与镁的质量比是( ) A、1:1 B、24:65 C、65:24 D、条件不足,无法判断14. Fe、稀 H2SO4、CuCl2 溶液、NaOH 溶液、Fe2O3 五种物质,在常温下两两相混合时,可能发生的反应共有( )
A、1:1 B、24:65 C、65:24 D、条件不足,无法判断14. Fe、稀 H2SO4、CuCl2 溶液、NaOH 溶液、Fe2O3 五种物质,在常温下两两相混合时,可能发生的反应共有( )
A、4 个 B、5 个 C、6 个 D、7 个15. 某碳酸钠固体样品中,可能含有硫酸钠、碳酸钙、硫酸铜、氯化钠、氯化钙中的一种或几种杂质,为了确定杂质的成分,进行以下实验:第一步:取50g该样品溶于水得到无色溶液;
第二步:再向第一步得到的无色溶液中,先后逐滴加入过量氯化钡溶液和过量的稀硝酸。产生沉淀的物质的质量与时间的关系如图所示,下列说法正确的是( )
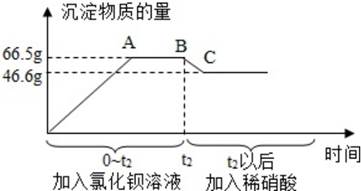 A、由第一步实验可知,原样品中一定没有硫酸铜、碳酸钙、氯化钙 B、BC段减少的沉淀是碳酸钙和碳酸钡 C、杂质一定含有硫酸钠、氯化钠 D、第二步实验结束后,最终所得溶液中的溶质共有三种
A、由第一步实验可知,原样品中一定没有硫酸铜、碳酸钙、氯化钙 B、BC段减少的沉淀是碳酸钙和碳酸钡 C、杂质一定含有硫酸钠、氯化钠 D、第二步实验结束后,最终所得溶液中的溶质共有三种二、简答题
-
16. 从Na、O、S、H、C五种元素中,选择适当的元素,按要求写出一个有关物质的化学式。(1)、相对分子质量最小的氧化物(2)、常用于除锈的酸(3)、可用作干燥剂的碱(4)、有四种元素组成的盐(5)、会造成温室效应的气体17. 2008年全球出现“无声海啸”——粮食危机,而我国粮食储备充足,市场价格稳定。化肥为保持粮食丰产起到了重要作用。常用化肥有:①尿素[CO(NH2)2]、②氯化钾KCl、③硝酸铵NH4NO3、④磷矿粉[Ca3(PO4)2](1)、以上化肥中属于钾肥的是(填序号)(2)、尿素因含有元素,所以是一种有机物。18. 水煤气厂生产煤气,将水加热成蒸气,通过炽热的炭,得到氢气和一氧化碳。沈老师为了说明其化学原理,画出了卡通图片,其中B表示;A作剂。
 19. 下表列出空气、NH3(氨气)、CH4、HCl四种气体在标准状况下的密度和溶解性
19. 下表列出空气、NH3(氨气)、CH4、HCl四种气体在标准状况下的密度和溶解性空气
NH3
CH4
HCl
密度(g/L)
1.293
0.771
0.717
1.629
溶解性

极易溶
极难溶
极易溶
(1)、其中既可用排水法收集,又可用向下排空气法收集的气体是。(2)、若用右图装置收集NH3(氨气),则气体应从端通入(填A或B),(3)、若用排水法收集氧气,瓶内装满水气体应从端进入。(4)、若用此图装置除去氢气中混有的HCl气体,则装置内应装的试剂为。 20. 据测试,室内空气污染是很严重的,特别是人数密集的室内和新装修的房间。为了减轻室内污染的危害,研究人员提出可以在室内放置空气过滤器。过滤器中的主要物质是活性炭,活性炭可以吸附多种有害气体。活性炭对不同气体的吸附效果是不同的,下表是某种规格的活性炭对不同气体的吸附率。请根据表内数据回答下列问题:
20. 据测试,室内空气污染是很严重的,特别是人数密集的室内和新装修的房间。为了减轻室内污染的危害,研究人员提出可以在室内放置空气过滤器。过滤器中的主要物质是活性炭,活性炭可以吸附多种有害气体。活性炭对不同气体的吸附效果是不同的,下表是某种规格的活性炭对不同气体的吸附率。请根据表内数据回答下列问题:气体
压强
1.01×105帕
1.5×105帕
温度
10℃
20℃
10℃
20℃
H2S
72.3%
85.6%
78.8%
91.4%
HCHO(甲醛)
70.8%
82.5%
75.9%
88.4%
SO2
80.6%
91.3%
85.7%
95.6%
(1)、在相同条件下,活性炭对哪种气体有较好的吸收效果。(2)、若要通过实验来比较同种规格同种质量的活性炭分别吸附NO2和SO2的效果,则该实验要在控制相同的条件下进行。21. 某化学兴趣小组利用下列装置进行O2、CO2的实验室制法和有关性质的研究。 (1)、写出下列编号仪器的名称:① ② 。(2)、乙同学用浓盐酸和大理石在B装置中反应,制取CO2并检验其有关性质,观察到烧杯中紫色石蕊试液变红。对这一变化的合理解释是______(填序号)A、产生的CO2直接使石蕊试液变红 B、产生的CO2与水反应生成H2CO3使石蕊试液变红 C、挥发出的氯化氢溶于水使石蕊试液变红(3)、丙同学用C装置制取了一瓶无色无味的气体(纯净物),你推测该气体可能是 , 则瓶中的固体为。
(1)、写出下列编号仪器的名称:① ② 。(2)、乙同学用浓盐酸和大理石在B装置中反应,制取CO2并检验其有关性质,观察到烧杯中紫色石蕊试液变红。对这一变化的合理解释是______(填序号)A、产生的CO2直接使石蕊试液变红 B、产生的CO2与水反应生成H2CO3使石蕊试液变红 C、挥发出的氯化氢溶于水使石蕊试液变红(3)、丙同学用C装置制取了一瓶无色无味的气体(纯净物),你推测该气体可能是 , 则瓶中的固体为。三、实验探究题
-
22. 实验室制取氢气,并进行氢气在氯气(Cl2)中燃烧的实验。纯净的H2可以在黄绿色的Cl2中安静燃烧,发出苍白色火焰,生成氯化氢(HCl)气体。请回答下列问题。(1)、在点燃氢气之前,要先检验。(2)、写出氢气点燃后在氯气中燃烧的化学方程式:。(3)、比较氢气在空气中和在氯气中的燃烧,可以得出结论:燃烧要有氧气参加。(选填“一定”或“不一定”)23. 小军同学在探究铁生锈的条件时,将一块生铁浸没在试管里的食盐水中,一段时间后发现试管底部出现了黑色粉末。据此他对黑色粉末的组成做了如下几种猜测:①Fe;②Fe2O3;③Fe3O4;④FeCl3;⑤几种含铁物质的混合物。
(1)、你认为小军同学的上述猜测中,不做实验就可排除的是(填序号),理由是。你认为黑色粉末还可能是(填化学式),理由是。(2)、小军同学将黑色粉末干燥后,用磁铁靠近,发现粉末能被磁铁吸引,于是得出结论。黑色粉末一定是铁粉。你认为小军的结论对吗?理由是。24. 小科同学在化学实验室发现一瓶盛有无色溶液的试剂瓶,其标签严重破损(如图所示)。老师告诉他,这瓶试剂可能是硫酸、硫酸钠、硫酸镁溶液中的一种。小兵同学通过查阅资料得知,常温下这三种物质的溶解度如下表:

物质
H2SO4
Na2SO4
MgSO4
溶解度/g
与水任意比互溶
19.0
39.0
小兵同学根据上述信息.分析认为此溶液一定不是溶液。为确定其成分,该同学对此溶液进行如下实验探究:
【提出假设】该溶液可能是。
【实验验证】取少量该溶液,向溶液中加入 ,
【实验现象】【实验结论】如果出现 ,则该溶液是 。
25. 硫酸铵是常用的一种氮肥,现有一种硫酸铵化肥,为测定其中硫酸铵的质量分数,采用如图所示的装置进行实验。已知在A、B中所发生反应的化学方程式如下:(NH4)2SO4+2NaOH=====2NH3↑+2H2O+ Na2SO4 2NH3+H2SO4====(NH4)2SO4
(注:反应生成的NH3能被烧杯中的稀硫酸溶液完全吸收)
 (1)、实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是 。(2)、方案评价:根据右图实验设计测得的数据,计算出硫酸铵的质量分数可能偏高,因为实验装置的设计存在一个明显缺陷 。
(1)、实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是 。(2)、方案评价:根据右图实验设计测得的数据,计算出硫酸铵的质量分数可能偏高,因为实验装置的设计存在一个明显缺陷 。四、解答题
-
26. 如图是两种化肥标签的一部分,请回答:
 (1)、从标签上看,两种化肥具有共同的物理性质之一是;碳酸氢铵不同于尿素的化学性质是。(2)、从含氮量角度,50kg这种碳酸氢铵相当于kg(精确到0.1)这种尿素。(写出计算过程)27. 在科学拓展性课程学习中,小柯做了如下实验:先在水槽里的架子上放两个小烧杯,一个盛有较多正在萌发的种子,另一个装有适量NaOH溶液,再往水槽内注入一定量的水,最后用一个大烧杯罩住两个小烧杯(如图)。持续一段时间后,观察到大烧杯内的水面上升,大烧杯外的水面下降。为什么杯外的水会进入杯内呢?请分析实验过程,并结合所学知识解释产生这种现象的具体原因。
(1)、从标签上看,两种化肥具有共同的物理性质之一是;碳酸氢铵不同于尿素的化学性质是。(2)、从含氮量角度,50kg这种碳酸氢铵相当于kg(精确到0.1)这种尿素。(写出计算过程)27. 在科学拓展性课程学习中,小柯做了如下实验:先在水槽里的架子上放两个小烧杯,一个盛有较多正在萌发的种子,另一个装有适量NaOH溶液,再往水槽内注入一定量的水,最后用一个大烧杯罩住两个小烧杯(如图)。持续一段时间后,观察到大烧杯内的水面上升,大烧杯外的水面下降。为什么杯外的水会进入杯内呢?请分析实验过程,并结合所学知识解释产生这种现象的具体原因。 28. 乙醇俗称酒精,可用作医用消毒,也常作燃料。其完全燃烧的化学方程式可表示为:C2H6O+3O2 2 CO2+ 3 H2O 。(1)、乙醇属于(填有机物或无机物)(2)、乙醇不完全燃烧会产生一氧化碳,某实验测得反应前后各物质的质量如下表:
28. 乙醇俗称酒精,可用作医用消毒,也常作燃料。其完全燃烧的化学方程式可表示为:C2H6O+3O2 2 CO2+ 3 H2O 。(1)、乙醇属于(填有机物或无机物)(2)、乙醇不完全燃烧会产生一氧化碳,某实验测得反应前后各物质的质量如下表:物质
乙醇
氧气
二氧化碳
水
一氧化碳
反应前质量(g)
4.6
8.8
0
0
0
反应后质量(g)
0
0
6.6
5.4
a
①表中a的值为。
②该实验发生反应的化学方程式为:4C2H6O+11O2
 CO2+ H2O + CO 。29. 为了探究石灰石与稀盐酸反应制备二氧化碳后的废液中的溶质成分,将废液过滤,取滤液20克于烧杯中,在不断振荡的条件下,向其中滴加质量分数为10.6%的碳酸钠溶液直至过量,有关的变化如右图所示:根据题中有关信息和图象分析回答下列问题:
CO2+ H2O + CO 。29. 为了探究石灰石与稀盐酸反应制备二氧化碳后的废液中的溶质成分,将废液过滤,取滤液20克于烧杯中,在不断振荡的条件下,向其中滴加质量分数为10.6%的碳酸钠溶液直至过量,有关的变化如右图所示:根据题中有关信息和图象分析回答下列问题: (1)、0-5表示碳酸钠先与反应(2)、原溶液中的溶质成分有(用化学式回答).
(1)、0-5表示碳酸钠先与反应(2)、原溶液中的溶质成分有(用化学式回答).小明同学欲测定此次使用的石灰石中碳酸钙的质量分数,采用的方式如下:取该石灰石样品20g,把80g稀盐酸分四次加入,实验过程所得数据如表格(已知石灰石样品中含有的二氧化硅等杂质不溶于水,不与稀盐酸反应),根据实验数据计算:
(3)、表中n的数值为。(4)、样品中碳酸钙的质量分数是多少? (通过计算回答)(5)、求盐酸中溶质的质量分数是多少?(通过计算回答)(6)、求A点处溶液中溶质的质量是多少克?(通过计算回答)实验次数
加入稀盐酸的质量/g
剩余固体的质量/g
1
20
15
2
20
10
3
20
6.8
4
20
n
30. 善于提出问题、解决问题是学好科学的重要方法。某研究性学习小组的同学在学习铁及其化合物知识时进行了系列研究。I.提出问题
问题1:铁为何称为黑色金属?
问题2:铁有多种氧化物,它们的性质有哪些差异?
问题3:钢铁厂在选矿时,如何测定铁矿石中的含铁量?
II.解决问题
(1)、【问题1】上网查寻,有两种说法。a.在铁表面有黑色的铁的氧化物,早先以为这就是铁的颜色,所以叫黑色金属。
b.铁的粉末为黑色,铁的氧化物也均为黑色,所以叫黑色金属。
你认为正确的说法是(填“a”或“b”)。
(2)、【问题2】查阅资料a.铁常见的氧化物有氧化铁(Fe2O3)、四氧化三铁(Fe3O4)和氧化亚铁(FeO)。
b.四氧化三铁是具有磁性的黑色晶体,可以近似地看作是氧化亚铁和氧化铁的化合物,它不溶于水,能与酸反应生成两种盐。
c.氧化亚铁是不溶于水的黑色粉末,能与酸反应,无磁性,也不能被磁铁吸引。
①请写出四氧化三铁与盐酸反应的化学方程式。
②有一包黑色粉末;可能是铁粉、Fe3O4粉末、FeO粉末中的一种,请你设计一种实验方案进行鉴别。
(3)、【问题3】同学们参观了某钢铁厂,了解到钢铁厂在选矿时测定铁矿石中含铁量的方法较多。同学们结合所学知识,设计了如图的实验装置测定某赤铁矿样品中Fe2O3的质量分数。图中酒精灯的作用是。 31. 广西有大量的石灰石,为了测定某地石灰石中碳酸钙的质量分数(假设杂质不参加反应,且不溶于水),某兴趣小组的同学设计了实验方案并进行了如下探究:
31. 广西有大量的石灰石,为了测定某地石灰石中碳酸钙的质量分数(假设杂质不参加反应,且不溶于水),某兴趣小组的同学设计了实验方案并进行了如下探究:方案I:①称取石灰石样品10g ②高温煅烧至质量不再改变,然后把剩余固体放在密闭干燥的容器中冷却至室温,称得剩余固体质量为6.04 g。
方案Ⅱ:①称取石灰石样品l0g ②加入足量的稀盐酸,使碳酸钙全部溶解
③用导管将生成的气体通入澄清石灰水(过量) ④将步骤③中生成的沉淀过滤、洗涤、干燥,称得沉淀质量为8.8 g。
根据上述回答问题:
某同学根据方案I计算碳酸钙的质量分数过程如下:设石灰石中碳酸钙的质量
为X,则
CaCO3
CaO
+
CO2↑
100
56
x
6.04 g
x=10.78 g CaCO3%= ×100%=107.8%
(1)、在方案I中冷却剩余固体为什么要在密闭干燥的容器中进行?(2)、以上解法得出碳酸钙的质量分数超过100%,造成计算结果错误的原因是 ,正确的计算结果是。(写出计算过程)
(3)、通过对两个方案中的碳酸钙质量分数的计算可知,方案Ⅱ计算得出的碳酸钙质量分数要比方案I低,你认为其中可能的原因是A、生成的二氧化碳有部分溶于水 B、导管中仍有部分二氧化碳未排出 C、生成的沉淀没有充分干燥 D、稀盐酸不足(4)、请你另外设计一个实验方案,测定石灰石中碳酸钙的质量分数.(提示:可以从求杂质的角度来分析)