内蒙古自治区巴彦淖尔市临河区2018-2019学年九年级上学期化学期末考试试卷
试卷更新日期:2019-01-26 类型:期末考试
一、单选题
-
1. 下列叙述中,前者是物理变化,后者是利用其化学性质的是()A、钢铁腐烂 ,干冰用于人工降雨 B、酒精挥发,用熟石灰改良酸性土壤 C、煤气燃烧,稀有气体用作焊接保护气 D、活性炭去除冰箱异味,氢气用于填充探空气球2. 下列实验操作或数据中,正确的是()
A.称量10.05g固体
B.检查装置气密性
C.加热液体
D.量取9.5mL液体
 A、A B、B C、C D、D3. 为了鉴别二氧化碳、氧气、空气三种气体,可以选用的最佳方法是()A、将气体分别通入水中 B、将气体分别通入澄清石灰水中 C、分别将带火星的木条伸入气体中 D、将燃着的木条分别伸入气体中4. 下列有关物质燃烧现象的叙述中,正确的是()A、铁丝在空气中燃烧:火星四射,生成红色固体 B、木条在氧气中燃烧:发出白光,生成二氧化碳 C、硫粉在空气中燃烧:产生淡蓝色火焰,生成一种刺激性气味的气体 D、红磷在空气中燃烧:生成大量的白色烟雾5. 用分子的观点解释下列现象,不合理的是()A、汽油挥发—分子大小发生变化 B、花香四溢—分子在不断地运动 C、热胀冷缩—分子间隔发生改变 D、食物变质—分子本身发生变化6. “化学为生命密码解锁”,DNA承载着生命遗传密码。胞嘧啶(C4H5ON3)是DNA水解物之一。关于它的说法正确的是()A、C4H5ON3是由碳、氢、氧、氮四种原子构成 B、C4H5ON3的相对分子质量是111 C、C4H5ON3是由三个元素组成 D、C4H5ON3属于氧化物7. 某纯净物3 g在氧气中完全燃烧,生成8.8g二氧化碳和5.4g水。下列说法错误的是()A、该反应中O2和CO2的质量比为14∶11 B、该纯净物中含有C,H元素,不含O元素 C、该纯净物中C,H原子的个数比为1∶4 D、该反应中O2和H2O的分子数之比为7∶68. 在一密闭容器中,盛放A,B,C三种物质各30g,加热充分反应后,各物质质量变化如下:
A、A B、B C、C D、D3. 为了鉴别二氧化碳、氧气、空气三种气体,可以选用的最佳方法是()A、将气体分别通入水中 B、将气体分别通入澄清石灰水中 C、分别将带火星的木条伸入气体中 D、将燃着的木条分别伸入气体中4. 下列有关物质燃烧现象的叙述中,正确的是()A、铁丝在空气中燃烧:火星四射,生成红色固体 B、木条在氧气中燃烧:发出白光,生成二氧化碳 C、硫粉在空气中燃烧:产生淡蓝色火焰,生成一种刺激性气味的气体 D、红磷在空气中燃烧:生成大量的白色烟雾5. 用分子的观点解释下列现象,不合理的是()A、汽油挥发—分子大小发生变化 B、花香四溢—分子在不断地运动 C、热胀冷缩—分子间隔发生改变 D、食物变质—分子本身发生变化6. “化学为生命密码解锁”,DNA承载着生命遗传密码。胞嘧啶(C4H5ON3)是DNA水解物之一。关于它的说法正确的是()A、C4H5ON3是由碳、氢、氧、氮四种原子构成 B、C4H5ON3的相对分子质量是111 C、C4H5ON3是由三个元素组成 D、C4H5ON3属于氧化物7. 某纯净物3 g在氧气中完全燃烧,生成8.8g二氧化碳和5.4g水。下列说法错误的是()A、该反应中O2和CO2的质量比为14∶11 B、该纯净物中含有C,H元素,不含O元素 C、该纯净物中C,H原子的个数比为1∶4 D、该反应中O2和H2O的分子数之比为7∶68. 在一密闭容器中,盛放A,B,C三种物质各30g,加热充分反应后,各物质质量变化如下:
关于此反应,下列认识错误的是()
A、该变化的基本反应类型是分解反应 B、变化后待测物A的质量为5g C、C物质中所含有的元素种类是A,B,D三种物质中所有元素种类之和 D、A物质有可能是单质9. 氯气可用作自来水的消毒剂,实验室制取氯气的化学方程式为: ,那么X的化学式为()A、MnClO B、Mn(ClO)2 C、MnCl4 D、MnCl210. 下列物质混合能形成溶液的是()A、碘放入水中 B、高锰酸钾放入汽油中 C、植物油滴入汽油中 D、植物油滴入洗洁精中11. 下列归纳完全正确的一组是()A、化学与工农业
①用二氧化碳与铁矿石反应炼铁
②石油炼制可得汽油、煤油、柴油等
③稀有气体通电后能发光制霓虹灯
B、化学与生活
①衣服上的油污:可用汽油除去
②冰箱的异味:可用活性炭吸附
③住房失火,消防队员用水扑灭,是为了降低可燃物的着火点
C、物质性质与用途
①氧气有助燃性——作燃料
②氮气常温下稳定——作保护气
③铜具有导电性——作导线
D、化学之最
①密度最小的气体是氢气
②地壳中含量最高的金属是铝
③天然存在的最硬的物质是金刚石
A、A B、B C、C D、D12. 下列图像能正确反映对应关系的是()A. 加热一定量氯酸钾和二氧化锰的混合固体产生氧气

B. 加热一定量氯酸钾和二氧化锰的混合固体
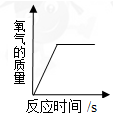
C. 一定质量的镁条在空气中燃烧
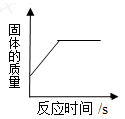
D.电解水
 A、A B、B C、C D、D
A、A B、B C、C D、D二、填空题
-
13.(1)、用化学用语表示:
①氖气:;②五个铵根离子:;③两个二氧化碳分子:;
(2)、下列物质中①食盐水②液氧③加热高锰酸钾完全分解后的剩余固体④冰水混合物⑤铜⑥四氧化三铁⑦氯酸钾⑧澄清石灰水⑨过滤、吸附过后澄清的河水。(用序号回答)A、属于混合物的是;
B、属于氧化物的是。
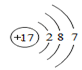
(3)、根据下列粒子结构示意图,回答问题.A.
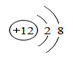
B.
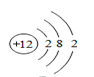
C.

D.
E.

①上图A、B、C、D四种粒子共表示种元素.
②E粒子带3个单位正电荷,则该粒子符号表示为
14. 高铁酸钾(K2FeO4)是具有紫色光泽的粉末,它是一种集氧化、吸附、凝聚、杀菌、灭藻为一体的新型、高效的多功能水处理剂。干燥的高铁酸钾在198 ℃以下是稳定的,受热易分解、变质。根据上述信息,请回答下列问题:(1)、高铁酸钾的化学性质是。(2)、高铁酸钾(K2FeO4)中Fe元素化合价为。(3)、为防止高铁酸钾变质,保存时应注意。三、解答题
-
15. 水与溶液在生产生活中有着广泛的用途。请你结合所学知识回答下列问题:(1)、镜湖是临河区的一个重要的旅游景点,“五•一”期间小明一家去镜湖旅游。
①小明带去“自热米饭”的加热原理是饭盒夹层中的水与生石灰反应生成氢氧化钙,放出大量的热,该反应的化学方程式为。
②小明从镜湖中取回一瓶水,为检验这瓶水的硬度,可向水中加入。生活中,常采用的方法来降低水的硬度。
③回家后,小明用洗洁精清洗餐县上的油污,是因为洗洁精具有作用。
(2)、如图一所示:不含结晶水的甲、乙、丙三种固体物质的溶解度曲线,看图并回答下列问题。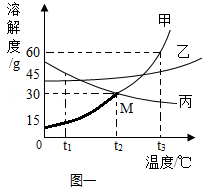
①M点表示的含义是(合理即可)。
②t3℃时,将35g甲物质加入到50g水中,充分溶解后所得溶液的质量是g
③t3℃时,将等质量的甲、乙、丙三种物质的饱和溶液分别降温至t1℃,所得溶液中溶质质量分数由大到小的顺序是。
(3)、如图二所示,20℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入一小块生石灰,再加入适量的水,烧杯中的溶液逐渐变浑浊,则X可能为(填“甲”或“乙”或“丙”)固体物质。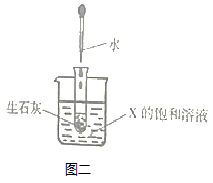
四、推断题
-
16. A→I是初中化学常见的物质,它们的相互转化关系如图所示,其中A、B组成元素相同且常温下为液体,C、D、E为无色气体,E为温室气体之一,H是石灰石的主要成分。回答下列问题:
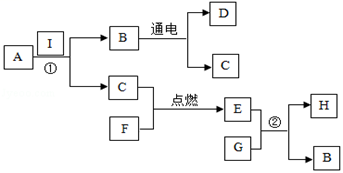 (1)、写出下列物质的化学式:D;F。(2)、写出反应①的化学方程式 , 基本反应类型为。(3)、写出反应②的化学方程式。
(1)、写出下列物质的化学式:D;F。(2)、写出反应①的化学方程式 , 基本反应类型为。(3)、写出反应②的化学方程式。五、实验题
-
17. 下面是实验室常用仪器组成的装置,请回答下列问题:
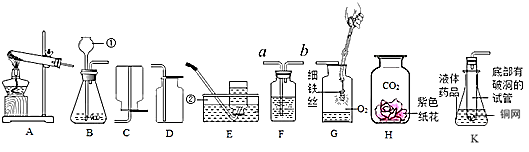 (1)、指出标号仪器的名称:①②;(2)、用氯酸钾制取氧气的化学方程式为;实验室制取二氧化碳的反应方程式是;若用F装置进行排空气法收集CO2 , CO2从F装置的(填“a”或“b”)导管口通入;(3)、已知氨气是一种极易溶于水的气体,密度比空气小,实验室可用氧化钙固体与浓氨水在常温下混合制成氨气(NH3),则应选用的气体发生装置是(填装置序号),收集装置是(填装置序号)。用收集到的氧气完成如G图所示实验,G中发生反应的化学方程式是 , G中瓶底要放少量水的目的是。(4)、K图是某同学利用底部有破洞的试管设计的制二氧化碳的发生装置,该设计除了废物利用的优点外,请另写一个优点:。若将铜网改成铁网,产生的后果之一是收集到的气体不纯,原因是(用化学方程式表示)。18. 某化学兴趣小组的学生,发现金属R不在初中学到的金属活动性顺序表中,该小组为了了解R与常见金属铝、铜的金属活动性顺序,进行如下探究活动:(1)、(作出猜想)他们考虑到铝的活动性比铜强,对三种金属的活动性顺序作出如下猜想:
(1)、指出标号仪器的名称:①②;(2)、用氯酸钾制取氧气的化学方程式为;实验室制取二氧化碳的反应方程式是;若用F装置进行排空气法收集CO2 , CO2从F装置的(填“a”或“b”)导管口通入;(3)、已知氨气是一种极易溶于水的气体,密度比空气小,实验室可用氧化钙固体与浓氨水在常温下混合制成氨气(NH3),则应选用的气体发生装置是(填装置序号),收集装置是(填装置序号)。用收集到的氧气完成如G图所示实验,G中发生反应的化学方程式是 , G中瓶底要放少量水的目的是。(4)、K图是某同学利用底部有破洞的试管设计的制二氧化碳的发生装置,该设计除了废物利用的优点外,请另写一个优点:。若将铜网改成铁网,产生的后果之一是收集到的气体不纯,原因是(用化学方程式表示)。18. 某化学兴趣小组的学生,发现金属R不在初中学到的金属活动性顺序表中,该小组为了了解R与常见金属铝、铜的金属活动性顺序,进行如下探究活动:(1)、(作出猜想)他们考虑到铝的活动性比铜强,对三种金属的活动性顺序作出如下猜想:猜想一:Al>Cu>R,猜想二:R>Al>Cu,猜想三:。
(2)、(查阅资料)R是一种银白色的金属,RSO4溶液呈蓝色;常温下铝的表面会形成一层致密的氧化膜;硫酸铝、氯化铝、硝酸铝的溶液均为无色。(实验探究)为了探究哪一种猜想成立,甲、乙、丙三位同学分别针对猜想一、猜想二、猜想三设计实验方案并展开实验探究。
猜想
主要操作
主要现象
实验结论
一
打磨R丝,并将其插入到硫酸铜溶液中
R丝表面覆盖了一层红色的物质
猜想一(“成立”或“不成立”)
二
把铝丝插入RSO4溶液中
猜想二成立
三
打磨粗细相同的R丝、铝丝、铜丝,分别将它们插入到体积相同、溶质质量分数也相同的稀硫酸中
①R丝表面产生气泡缓慢,溶液由无色逐渐变成蓝色
②铝丝表面产生气泡较快
③铜丝表面没有气泡产生
猜想三成立
(交流反思)究竟哪种猜想成立?三位同学经讨论交流,发现乙同学在实验前没有打磨铝丝,这可能会导致实验结论错误。于是他们先打磨铝丝,再将其插入到RSO4溶液中,一段时间后,溶液的颜色由色变为色;进而确认猜想二不成立,猜想三成立。写出Al与稀硫酸反应的化学方程式:。
(归纳总结)探究结束后,他们总结得出:通过金属与酸反应或金属与盐溶液反应可以比较金属活动性强弱。
六、计算题
-
19. 欲测定Cu-Zn合金及Cu-Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀盐酸和必要的仪器。
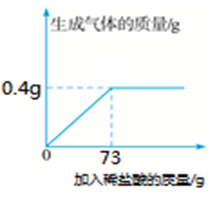 (1)、你认为能测出铜的质量分数的是合金。(2)、取该合金的粉末50 g加入该稀盐酸充分反应,所加稀盐酸与生成气体的质量关系如图所示。
(1)、你认为能测出铜的质量分数的是合金。(2)、取该合金的粉末50 g加入该稀盐酸充分反应,所加稀盐酸与生成气体的质量关系如图所示。①生成气体的质量为g。
②请计算该合金中铜的质量分数。.
-
-