2018-2019学年人教版(五·四学制)化学九年级全一册第三单元测试卷
试卷更新日期:2019-01-24 类型:单元试卷
一、单选题
-
1. 下列物质的用途正确的是 ( )A、
 石灰石做华表
B、
石灰石做华表
B、 氢氧化钠改良土壤
C、
氢氧化钠改良土壤
C、 熟石灰做干燥剂
D、
熟石灰做干燥剂
D、 碳酸钠制洗涤剂
2. 人体中一些体液或排泄物的pH范围如下,其中酸性最强的是( )A、胃液0.9~1.5 B、唾液6.6~7.1 C、尿液4.7~8.4 D、胰液7.5~8.03. 化石燃料在燃烧过程中会产生各种废气,其中形成酸雨的主要气体( )A、SO2、NO2 B、CO2、CO C、SO2、CO2 D、NO2、CO4. 下列实验操作正确的是 ( )A、
碳酸钠制洗涤剂
2. 人体中一些体液或排泄物的pH范围如下,其中酸性最强的是( )A、胃液0.9~1.5 B、唾液6.6~7.1 C、尿液4.7~8.4 D、胰液7.5~8.03. 化石燃料在燃烧过程中会产生各种废气,其中形成酸雨的主要气体( )A、SO2、NO2 B、CO2、CO C、SO2、CO2 D、NO2、CO4. 下列实验操作正确的是 ( )A、 蒸发
B、
蒸发
B、 稀释浓硫酸
C、
稀释浓硫酸
C、 称量NaOH
D、
称量NaOH
D、 用pH试纸测酸碱度
5. 珍珠是一种名贵的中药材,其主要成分是一种含钙的化合物。把盐酸滴在珍珠粉上,产生大量气泡。若将生成的气体通入澄清的石灰水,澄清的石灰水变浑浊。据此推断,珍珠的主要成分可能是( )A、K2CO3 B、Ca(OH)2 C、CaCO3 D、Ca(NO3)26. 下列说法错误的是( )A、用熟石灰可以改良酸性土壤 B、pH<7的雨水为酸雨 C、用含有氢氧化铝的药物治疗胃酸过多 D、浓硫酸可用来干燥氢气7. 下列实验现象描述正确的是( )A、向氧化铜中滴入足量的稀盐酸:黑色固体减少至消失,溶液由无色变为蓝色 B、—氧化碳还原氧化铁:红棕色固体逐渐变为银白色 C、铝丝插入硫酸铜溶液中:银白色固体表面覆盖一层紫红色的铜,溶液由蓝色变无色 D、氢氧化镁加入到紫色的石蕊溶液中:紫色的石蕊溶液变红8. 取一滤纸条,等间距滴入10滴紫色石蕊溶液,装入玻璃管中,然后从玻璃管的两端同时放入分别蘸有浓氨水和浓盐酸的棉球,并迅速封闭两端管口,很快可观察到管内有白烟产生,待白烟消失后还可观察到如图所示的现象。下列说法错误的是( )
用pH试纸测酸碱度
5. 珍珠是一种名贵的中药材,其主要成分是一种含钙的化合物。把盐酸滴在珍珠粉上,产生大量气泡。若将生成的气体通入澄清的石灰水,澄清的石灰水变浑浊。据此推断,珍珠的主要成分可能是( )A、K2CO3 B、Ca(OH)2 C、CaCO3 D、Ca(NO3)26. 下列说法错误的是( )A、用熟石灰可以改良酸性土壤 B、pH<7的雨水为酸雨 C、用含有氢氧化铝的药物治疗胃酸过多 D、浓硫酸可用来干燥氢气7. 下列实验现象描述正确的是( )A、向氧化铜中滴入足量的稀盐酸:黑色固体减少至消失,溶液由无色变为蓝色 B、—氧化碳还原氧化铁:红棕色固体逐渐变为银白色 C、铝丝插入硫酸铜溶液中:银白色固体表面覆盖一层紫红色的铜,溶液由蓝色变无色 D、氢氧化镁加入到紫色的石蕊溶液中:紫色的石蕊溶液变红8. 取一滤纸条,等间距滴入10滴紫色石蕊溶液,装入玻璃管中,然后从玻璃管的两端同时放入分别蘸有浓氨水和浓盐酸的棉球,并迅速封闭两端管口,很快可观察到管内有白烟产生,待白烟消失后还可观察到如图所示的现象。下列说法错误的是( ) A、该反应有固体生成 B、浓氨水和浓盐酸都易挥发 C、氨分子和氯化氢分子的运动快慢相同 D、该反应说明化学变化前后分子种类改变9. 对下列事实的微观解释错误的是( )
A、该反应有固体生成 B、浓氨水和浓盐酸都易挥发 C、氨分子和氯化氢分子的运动快慢相同 D、该反应说明化学变化前后分子种类改变9. 对下列事实的微观解释错误的是( )选项
亊实
解释
A
溶液导电的原因
溶液中有自由移动的粒子
B
酸有相似的化学性质
酸溶液中有相同的氢离子
C
硫酸亚铁溶液和硫酸铁溶液颜色不同
溶液中的阳离子不同
D
碱溶液能使紫色石蕊溶液变蓝
碱溶液中含有氢氧根离子
A、A B、B C、C D、D10. 向一定质量的CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10.6%的Na2CO3溶液,实验过程中加入Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示。下列说法错误的是( )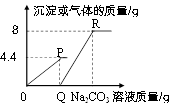 A、P点时的溶液只含一种溶质 B、R点对应横坐标的数值为180 C、0至P过程中溶液的pH变大 D、Q至R段表示生成沉淀的过程11. 误差分析是定量实验的一个重要内容,下列分析正确的是( )A、用量筒量取10mL水,仰视读数,会导致水的实际体积偏小 B、测定溶液的pH,先用水将pH试纸润湿,会导致测出的pH偏大 C、测定空气中氧气的体积分数,铜粉的量不足,会导致测出氧气的体积分数偏小 D、配制6%的氯化钠溶液,氯化钠中含有杂质,会导致氯化钠的质量分数偏大12. 根据下图所示的四个实验,得出的结论正确的是( )
A、P点时的溶液只含一种溶质 B、R点对应横坐标的数值为180 C、0至P过程中溶液的pH变大 D、Q至R段表示生成沉淀的过程11. 误差分析是定量实验的一个重要内容,下列分析正确的是( )A、用量筒量取10mL水,仰视读数,会导致水的实际体积偏小 B、测定溶液的pH,先用水将pH试纸润湿,会导致测出的pH偏大 C、测定空气中氧气的体积分数,铜粉的量不足,会导致测出氧气的体积分数偏小 D、配制6%的氯化钠溶液,氯化钠中含有杂质,会导致氯化钠的质量分数偏大12. 根据下图所示的四个实验,得出的结论正确的是( ) A、乙试管中产生气泡速率大于甲试管中产生气泡速率,说明金属活动性:镁>铁 B、蜡烛由低到高依次熄灭,说明通常状况下CO2不能燃烧,不支持燃烧,密度大于空气 C、甲试管中的铁钉生锈,乙试管中的铁钉不生锈,说明只需与水接触铁钉就会生锈 D、向盛有NaOH固体的试管中滴加稀硫酸,烧杯中饱和的澄清石灰水变浑浊,说明H2SO4与NaOH发生中和反应放出热量13. 用pH计测得一些物质的pH值如下:
A、乙试管中产生气泡速率大于甲试管中产生气泡速率,说明金属活动性:镁>铁 B、蜡烛由低到高依次熄灭,说明通常状况下CO2不能燃烧,不支持燃烧,密度大于空气 C、甲试管中的铁钉生锈,乙试管中的铁钉不生锈,说明只需与水接触铁钉就会生锈 D、向盛有NaOH固体的试管中滴加稀硫酸,烧杯中饱和的澄清石灰水变浑浊,说明H2SO4与NaOH发生中和反应放出热量13. 用pH计测得一些物质的pH值如下:物质
苹果汁
西瓜汁
牛奶
鸡蛋清
炉具清洁剂
pH
2.9
5.8
6.4
7.6
12.5
下列说法中正确的是( )
A、鸡蛋清和牛奶显碱性 B、牛奶比西瓜汁的酸性强 C、炉具清洁剂可除水垢 D、胃酸过多的人应少饮苹果汁14. 柠檬酸是一种重要的有机酸,又名枸橼酸,无臭,有很强的酸味,易溶于水。其它的化学式是C6H7O8 , 关于柠檬酸的下列说法正确的是( ) A、柠檬酸中碳元素、氢元素、氧元素的个数比为6:7:8 B、每个柠檬酸分子中质子数与中子数一定相等 C、柠檬酸分子中含有21个原子核 D、柠檬酸能与铁锈反应,因而能够去除铁制水壶里的锈迹15. 下列有关实验操作或物质用途的说法错误的是( )A、将氢氧化钠固体放在小烧杯中称量 B、用 pH 试纸测定出某酸性溶液的 pH 为 3.45 C、测定溶液的pH时,将被测液滴到放在玻璃片上的pH试纸上,显色后,与标准比色卡比较 D、稀释浓硫酸时要将浓硫酸沿着容器壁慢慢注入水中,并用玻璃棒不断的搅拌
A、柠檬酸中碳元素、氢元素、氧元素的个数比为6:7:8 B、每个柠檬酸分子中质子数与中子数一定相等 C、柠檬酸分子中含有21个原子核 D、柠檬酸能与铁锈反应,因而能够去除铁制水壶里的锈迹15. 下列有关实验操作或物质用途的说法错误的是( )A、将氢氧化钠固体放在小烧杯中称量 B、用 pH 试纸测定出某酸性溶液的 pH 为 3.45 C、测定溶液的pH时,将被测液滴到放在玻璃片上的pH试纸上,显色后,与标准比色卡比较 D、稀释浓硫酸时要将浓硫酸沿着容器壁慢慢注入水中,并用玻璃棒不断的搅拌二、填空题
-
16. ①KOH、②HCl、③CaCl2、④HNO3、⑤SO2、⑥BaSO4、⑦CuO、⑧Ca(OH)2、⑨Na2CO3、⑩NH3·H2O,属于酸的是 ;属于碱的是;属于盐的是。
17. 请从A、B两题中任选一个作答。若两题均答,按A计分。题号
A
B
实验装置


实验原理
⑴化学方程式是
⑴化学方程式是
实验现象
⑵溶液由色变为色
⑵溶液由色变为色
18. Al(OH)3是两性氢氧化物,在常温下它既能与强酸,又能与强碱反应.写出氢氧化铝治疗胃酸过多症的化学方程式;已知氢氧化铝可以和氢氧化钠反应生成偏铝酸钠(NaAlO2)和水,试写出氯化铝和过量氢氧化钠溶液反应的化学方程式。
19. 填写实验报告。实 验 内 容
实 验 现 象
分析、结论及解释
①测定碱溶液的pH
取两片pH试纸,放在白瓷板上,分别用玻璃棒蘸取稀氢氧化钠溶液、澄清石灰水,再分别滴到pH试纸上,将试纸显示的颜色与比较,读出pH。
若实验过程中,用沾有水的玻璃棒蘸取溶液,则所测得的pH(填“>”、“=”或“<” )实际值。
②碱和指示剂作用
取两支洁净的试管,分别加入约2mL的稀氢氧化钠溶液、澄清石灰水,再分别加入3滴无色酚酞溶液,观察溶液颜色变化。
两支试管中的酚酞溶液均变为 色。
稀氢氧化钠溶液、澄清石灰水都呈_性。
③碱和非金属氧化物的反应
用排水法收集一瓶呼出的气体,然后加入约2mL澄清石灰水,振荡,观察现象。
澄清石灰水变浑浊。
反应的化学方程式:。
三、实验探究题
-
20. 某同学向100.00g水中加入0.56g氧化钙(见下图A),并设计了后续实验方案:
 (1)、氧化钙的俗称是。(2)、A中发生的反应的化学方程式为。(3)、在室温下,将B中白色浑浊液变为C中无色澄清液的“操作I”的名称是。(4)、测得C中液体质量仍为100.00g,则其中溶质的质量分数为(保留两位小数)。(5)、如操作II为通入一种气体,则发生反应的化学方程式为 。(6)、如操作II为加入少量某固体,则该固体可能是(填序号)。
(1)、氧化钙的俗称是。(2)、A中发生的反应的化学方程式为。(3)、在室温下,将B中白色浑浊液变为C中无色澄清液的“操作I”的名称是。(4)、测得C中液体质量仍为100.00g,则其中溶质的质量分数为(保留两位小数)。(5)、如操作II为通入一种气体,则发生反应的化学方程式为 。(6)、如操作II为加入少量某固体,则该固体可能是(填序号)。①氧化钙 ②冰块 ③氯化钠 ④氢氧化钠
21. 某同学设计了如下图所示的实验装置探究“分子的性质”,请回答下列问题: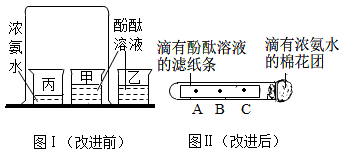
【查阅资料】氨水易分解产生有刺激性气味的氨气
(1)、【进行试验】图Ⅰ是课本中某个探究实验,几分钟后该实验中可以看到的现象是甲烧杯乙烧杯;其中烧杯乙的作用是;通过该实验可以得出或推导出一些结论:(答一条即可)。
(2)、【实验改进】老师对图Ⅰ所示的装置进行了改进(如图Ⅱ所示),并进行了以下操作:①取一长条形滤纸,等距离滴加无色酚酞试液;
②将滴加了无色酚酞试液的长条形滤纸放入一洁净的试管中,并在试管口塞一团棉花;
③向脱脂棉上滴加几滴浓氨水。
【分析讨论】
①按照改进后的实验,几分钟后观察到的现象是。
②实验过程中若发现滤纸条没有变红而棉花变红,其可能原因是。
(3)、【拓展延伸】同学们经过讨论后认为,图Ⅰ、图Ⅱ所示装置虽能证明分子的性质,但不能证明影响分子性质的因素,于是又设计了如图Ⅲ所示的装置。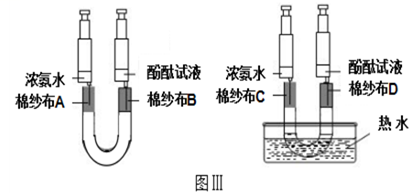
在U型管的两个管口分别放入卷成筒状的棉纱布,并用橡皮塞塞紧。用注射器吸取2mL的酚酞溶液从橡皮塞慢慢注入棉纱布上,使其润湿,从另一管口插入吸取了2mL浓氨水的注射器。按此方法再组装好另一套装置,将其中一套装置的下端放入热水中,并同时向两支U型管中注入浓氨水。
①按照图Ⅲ所示的装置进行操作,几分钟后看到的现象是 , 该现象说明了。
②图Ⅲ所示的实验方法相对于图Ⅰ所示的实验方法,具有哪些优点:
22. 耀华实验学校兴趣小组的同学们在实验室发现一瓶敞口放置 的氢氧化钠溶液,为了弄清楚这瓶溶液是否有变质及成分,他们进行了如下探究:〖提出猜想〗
(1)、文熙同学猜想认为已经全部变质了,原因是氢氧化钠与空气中的 CO2 发生了化学反应, 反应的化学方程式为。(2)、欣冉同学猜想认为,没有变质,该溶液的溶质就是 NaOH。晨杰同学猜想认为还可能是部分变质了,是(写化学式)的混合溶液。
(3)、〖实验探究〗为探究该溶液的溶质的成分,同学们进行了以下实验探究:
晨然同学取该溶液少量于试管中,滴入几滴无色的酚酞试液后溶液变成色,于是他得出的结论是没有变质。思宇同学认为晨然同学的结论不严密,理由是氢氧化钠与空气中 二氧化碳反应生成的碳酸钠溶液也显碱性,与氢氧化钠溶液一样也能使无色的酚酞试液变成同 样的颜色。
(4)、云蔚同学设计了以下实验,取少量溶液于试管中滴加稀盐酸,有产生, 反应方程式为 , 于是她得出的结论是氢氧化钠溶 液已经全部变质。(5)、章可同学认为也可能部分变质,于是他设计了以下实验:实验步骤
实验现象
实验结论及反应方程式
①取少量溶液于试管中,滴入 足量的 BaCl2 溶液
产生白色沉淀
溶液中有变质为 Na2CO3
Na2CO3+BaCl2=BaCO3↓+2NaCl
②取①中反应后的上层清液, 滴加氯化铜溶液
溶液中含有没有变质的氢氧化钠,反应 方程式从而得出氢氧化钠确实是部分变质。
四、推断题
-
23. A~F是初中化学的常见物质,A与B的组成元素相同,D、E在通常状况下是气体,F是大理石的主要成分。其转化关系如下图所示,部分反应物、生成物和反应条件未标出。
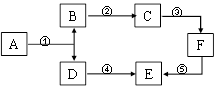 (1)、A的化学式是。(2)、若B+E+F→C,则C是(填名称或化学式)。(3)、反应④的化学方程式是。(4)、反应⑤的化学方程式是。
(1)、A的化学式是。(2)、若B+E+F→C,则C是(填名称或化学式)。(3)、反应④的化学方程式是。(4)、反应⑤的化学方程式是。