2018-2019学年人教版(五·四学制)化学九年级全一册第一单元测试卷
试卷更新日期:2019-01-24 类型:单元试卷
一、单选题
-
1. 地壳中含量最多的元素是( )A、Fe B、Al C、Si D、O2. 下列关于金属的说法中,错误的是( )A、铜有良好的导电性,常用于制作导线 B、所有的金属都能与稀盐酸反应 C、铁制品在干燥的空气中不易生锈 D、不能用铁桶盛放硫酸铜溶液3. 下列关于资源和能源的叙述中正确的是( )
A、目前已制得的纯金属只有90余种,合金已达几百种 B、海洋是巨大的资源宝库,海水中含有80多种元素 C、现在世界上每年因腐蚀而报废的金属设备和材料相当于年产量的40%以上 D、地壳中含量最多的金属元素及目前世界年产量最高的金属都是铁4. 要验证Zn、Cu、Ag三种金属的活动性顺序,同学们设计了以下四个实验。你认为其中不需要进行的是( )
A、将锌片放入稀硫酸中 B、将铜片放入稀硫酸中 C、将铜片放入硝酸银溶液中 D、将锌片放入硝酸银溶液中5. 现有甲、乙、丙三种金属,先将三者分别加入到稀硫酸中,只有乙金属表面有气泡生成;再将甲加入到丙的盐溶液中,无明显变化。据此判断三种金属的活动性由强到弱的顺序是( )A、甲>乙>两 B、甲>丙>乙 C、乙>丙>甲 D、丙>甲>乙6. 为验证Mg、Fe、Cu三种金属的活动性顺序,所选药品不能达到目的是( )
A、Mg、Cu、FeSO4溶液 B、Cu、Fe、稀硫酸、MgSO4溶液 C、Cu、FeSO4溶液、MgSO4溶液 D、Fe、MgSO4溶液、CuSO4溶液7. 研发高性能“中国芯”是我国信息产业的当务之急。“中国芯”的主要材料是高纯度的单质硅,工业上用SiO2+2C Si+2CO↑来制取粗硅,下列说法正确的是( )A、生成CO的原因是O2不足 B、该反应为置换反应 C、硅元素在地壳中的含量比氧元素多 D、该反应体现了C的氧化性8. 根据下面实验装置图,以下说法中正确的是( ) A、a处固体由黑色逐渐变为红棕色 B、该实验可验证CO的氧化性 C、实验结束后应先停止加热,待玻璃管冷却后再停止通CO D、在整个实验过程中,c处的尾气可不做处理直接排放到空气中9. 如图是探究铁和铜金属活动性实验,关于此实验说法错误的是( )
A、a处固体由黑色逐渐变为红棕色 B、该实验可验证CO的氧化性 C、实验结束后应先停止加热,待玻璃管冷却后再停止通CO D、在整个实验过程中,c处的尾气可不做处理直接排放到空气中9. 如图是探究铁和铜金属活动性实验,关于此实验说法错误的是( ) A、铁丝需要砂纸打磨 B、溶液由蓝色变为无色 C、金属活动性强弱:Fe>Cu D、化学反应方程式为:Fe+CuSO4=Cu+FeSO410. 将一定量的金属M加入到含有硝酸锌、硝酸铜、硝酸银的混合溶液中,充分反应后过滤,得到滤渣和滤液,根据实验分析,下列说法正确的是( )
A、铁丝需要砂纸打磨 B、溶液由蓝色变为无色 C、金属活动性强弱:Fe>Cu D、化学反应方程式为:Fe+CuSO4=Cu+FeSO410. 将一定量的金属M加入到含有硝酸锌、硝酸铜、硝酸银的混合溶液中,充分反应后过滤,得到滤渣和滤液,根据实验分析,下列说法正确的是( )①若滤液为蓝色,则滤渣中一定不含锌和M
②若滤液只含一种溶质,滤渣含四种金属,则几种金属活动性顺序:M>锌>铜>银
③若滤渣含有M,则滤液中的溶质种类最多含3种,最少含一种
④向滤渣中加入稀盐酸产生无色气体,则滤渣中一定含锌,可能含M
A、②④ B、①④ C、②③ D、①③11. 图中A、B、C、D是立在水田中的电线杆的铁丝拉线的四个部位,其中最容易生锈的是( ) A、A处 B、B处 C、C处 D、D处12. 某兴趣小组在研究Zn-Cu合金、Zn-Fe合金、Fe-Al合金、Fe-Cu合金时,发现其中一种合金6.5g与足量稀盐酸充分反应产生了0.5g气体,该合金可能是( )A、Zn-Cu合金 B、Zn-Fe合金 C、Fe-Al合金 D、Fe-Cu合金
A、A处 B、B处 C、C处 D、D处12. 某兴趣小组在研究Zn-Cu合金、Zn-Fe合金、Fe-Al合金、Fe-Cu合金时,发现其中一种合金6.5g与足量稀盐酸充分反应产生了0.5g气体,该合金可能是( )A、Zn-Cu合金 B、Zn-Fe合金 C、Fe-Al合金 D、Fe-Cu合金二、填空题
-
13. 铜丝作导线是利用了其良好的性;铁锈(主要成分是Fe2O3)可用稀硫酸除去,该反应的生成物为H2O和;铝制品耐腐蚀是因其表面生成了致密的氧化铝薄膜,该反应的化学方程式为。
14. 几种物质之间的转化关系如图所示,部分产物和反应条件已省去。请回答下列问题: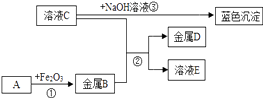
Ⅰ 金属B的活动性金属D的活动性(填“>”、“<”、“=”);
Ⅱ 若A是一种气体化合物,写出①的化学方程式:;
Ⅲ 向C溶液中加入AgNO3溶液,有白色沉淀,加入稀硝酸,沉淀不溶解,写出其化学反应方程式:;
Ⅳ 写出溶液C与NaOH溶液反应的基本类型:。
15. 木炭还原氧化铜制得的铜粉中混有少量木炭粉,为测定铜的质量分数,某同学取 W g铜粉样品,设计了如下装置进行实验:
①A 中反应的化学方程式为。
②充分反应后,装置 C 的质量增加了 4.4g,则生成的二氧化碳的物质的量是 mol。 求参加反应的氢氧化钠的物质的量。(根据化学方程式列式计算)
③关于该实验下列说法正确的是。
A.实验结束时,先熄灭两个酒精灯
B.氯酸钾的量对测定结果没有影响
C.石灰水的量对测定结果没有影响
D.只称量反应前后装置 B 中固体质量也可达到实验目的
16. 某同学为了探究相关金属的性质,做了下列实验: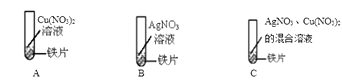
① A 中现象;B 中反应的基本类型是反应。
② 通过 A 和 B 实验不能证明铁、铜、银三种金属的活动性强弱,需补充一个实验达到 实验目的,写出该反应的化学方程式为。
③ 实验 C 中物质充分反应后,猜想试管中溶液的溶质是
Ⅰ. Fe(NO3)2、Cu(NO3)2、AgNO3 Ⅱ. Fe (NO3)2、AgNO3 Ⅲ.Fe (NO3)2、Cu(NO3)2 Ⅳ.。 其中只有一个不合理的猜想是。(填编号)
④ 进行定量实验可确定猜想。
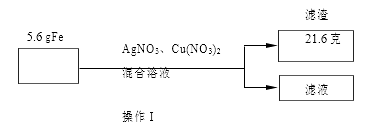
操作Ⅰ是。根据数据分析,③中猜想成立(填编号)。
三、推断题
-
17.
金属是我们学习的一类重要物质。
(1)下列金属制品中,利用金属导电性的是 (填字母序号)。
A.不锈钢餐具 B.金箔 C.铜导线
(2)同学们在探究金属的化学性质时,做了如右图所示的两个实验(金属片已打磨)。
①铁片插入硫酸铜溶液中,铁片表面的现象是 ;
②铜片插入硝酸银溶液中,化学的反应方程式是 。
请结合上述两个实验,推测此实验的目的是 。
(3)某同学以铁锈为起始反应物,设计实验流程如下(部分反应条件已省略)。
① F的化学式是 ;
② B与C反应的化学方程式是 ;
③ A-H中,能使紫色石蕊溶液变成红色的物质是 (填化学式)。四、实验探究题
-
18. 根据如图回答问题。
 (1)、A中仪器①的名称是 , 发生反应的化学方程式是。(2)、B中木条变黑,说明浓硫酸具有性。(3)、C中会出现明显现象的试管是(填序号),试管Ⅱ中的蒸馏水需要煮沸、迅速冷却后再使用,目的是。19.(1)、化学实验培养了我们科学的思维方法,也增强了我们学习化学的兴趣。为了便于研究,我们可以把化学实验从“实验装置、物质的性质、探究的方法”等角度进行分类。
(1)、A中仪器①的名称是 , 发生反应的化学方程式是。(2)、B中木条变黑,说明浓硫酸具有性。(3)、C中会出现明显现象的试管是(填序号),试管Ⅱ中的蒸馏水需要煮沸、迅速冷却后再使用,目的是。19.(1)、化学实验培养了我们科学的思维方法,也增强了我们学习化学的兴趣。为了便于研究,我们可以把化学实验从“实验装置、物质的性质、探究的方法”等角度进行分类。现有如下实验:
A组
B组
实验C



若请你将实验C 归类,你会选择归为组(填“A”或“B”),理由是。
(2)、化学反应中物质所含元素的化合价发生变化的反应叫做氧化还原反应,如H2+Cl2=2HCl,反应前后氢元素和氯元素的化合价发生了变化,该反应是氧化还原反应。请你判断Na2CO3+2HCl=H2O+CO2+2NaCl(选填“是”或“不是”)氧化还原反应。经过类比分析,化合反应(选填“一定”或“一定不”或“不定”)是氧化还原反应。五、综合题
-
20. 工业上用闪锌矿(主要含ZnS,还含PbS等杂质)制备锌的流程如下(部分产物略去):
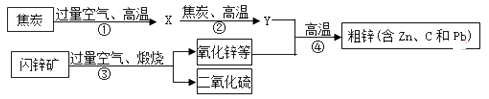 (1)、X的化学式是 , 图中用过量空气的目的是 。(2)、①~④中属于化合反应的是。(3)、Zn(填“能”或“不能 )与PbCl2溶液反应。(4)、写出反应③中生成ZnO的化学方程式。(5)、结合下表数据设计:从粗锌中分离出纯锌的方案是。
(1)、X的化学式是 , 图中用过量空气的目的是 。(2)、①~④中属于化合反应的是。(3)、Zn(填“能”或“不能 )与PbCl2溶液反应。(4)、写出反应③中生成ZnO的化学方程式。(5)、结合下表数据设计:从粗锌中分离出纯锌的方案是。物质
Zn
Pb
C
沸点℃
907
1749
4827
(6)、反应②中固体质量随反应时间的变化图示如下图,计算产生Y的质量。(写出必要的计算过程) 21. 小华有一只银手镯(银锌合金),她想用实验探究手镯中银的含量。先用电子秤称得手镯的质量是25.00克,再用稀盐酸分多次与此手镯充分反应。实验数据如下表:
21. 小华有一只银手镯(银锌合金),她想用实验探究手镯中银的含量。先用电子秤称得手镯的质量是25.00克,再用稀盐酸分多次与此手镯充分反应。实验数据如下表:第1次
第2次
第3次
第4次
第5次
加入烯盐酸的质量(克)
10.00
10.00
10.00
10.00
10.00
充分反应后剩余固体的质量(克)
24.35
23.70
23.05
23.00
23.00
根据上表中数据分析,完成下列问题:
(1)、手镯中银的质量是克。(2)、所用稀盐酸中溶质的质量分数是多少?
-