2018-2019学年人教版化学九年级下册第十单元课题1 酸和碱 同步训练
试卷更新日期:2019-01-24 类型:同步测试
一、单选题
-
1. 下列叙述正确的是( )
A、某无色溶液中加入几滴无色酚酞溶液变红,该溶液一定是碱溶液 B、取牵牛花在研钵中捣烂,加入水浸泡,可制得指示剂 C、硫酸是重要的化工原料,用于生产化肥、农药、火药等 D、同一种溶质的饱和溶液,其溶质的质量分数一定比不饱和溶液的溶质质量分数大2. 下列物质能使紫色石蕊试液变红的是( )A、CO2 B、O2 C、NaCl D、NaOH3. 对下列事实的解释错误的是( )序号
事 实
解 释
A
往养鱼池中通入空气
增大水中氧气的溶解量
B
敞口放置在空气中的浓硫酸变稀
浓硫酸具有吸水性,能吸收空气中的水分
C
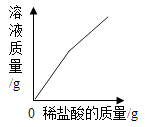
氢氧化钠溶液导电
氢氧化钠自身含有自由移动的粒子
D
餐具洗涤剂能除去餐具上的油污
餐具洗涤剂有乳化作用
A、A B、B C、C D、D4. 下列物质的用途中错误的是( )A、 用熟石灰改良酸性土壤
B、
用熟石灰改良酸性土壤
B、 用盐酸来制取药物
C、
用盐酸来制取药物
C、 用钛合金做人造骨
D、
用钛合金做人造骨
D、 用食盐配制生理盐水
5. 以下是某同学用8mL蒸馏水稀释浓硫酸的操作过程,其中有错误的环节是( )A、
用食盐配制生理盐水
5. 以下是某同学用8mL蒸馏水稀释浓硫酸的操作过程,其中有错误的环节是( )A、 B、
B、 C、
C、 D、
D、 6. 下列物质露置于空气中,能与氧气、水蒸气同时发生反应的是( )A、浓硫酸 B、生石灰 C、铁粉 D、食盐7. 用下列装置进行实验,不能达到实验目的的是( )
6. 下列物质露置于空气中,能与氧气、水蒸气同时发生反应的是( )A、浓硫酸 B、生石灰 C、铁粉 D、食盐7. 用下列装置进行实验,不能达到实验目的的是( )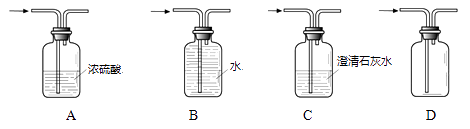 A、干燥O2 B、收集O2 C、检验CO2 D、收集O28. 下列气体不可用浓硫酸干燥的气体是( )A、氧气 B、氨气 C、二氧化碳气体 D、二氧化硫气体9. 氢氧化钠固体可用于干燥某些气体,是因为氢氧化钠固体具有( )A、脱水性 B、强腐蚀性 C、易潮解 D、强碱性10. 下列实验现象描述正确的是( )A、镁条在空气中燃烧:银白色固体燃烧,发出耀眼的强光,产生黄白色火焰 B、打开盛有浓盐酸的试剂瓶塞:试剂瓶瓶口处有白雾出现 C、向氢氧化镁中滴加无色酚酞溶液:无色酚酞溶液变红 D、把银丝放入硫酸铜溶液中:银白色固体表面产生紫红色固体,溶液由蓝色变成无色11. 下列说法正确的是( )A、稀盐酸、稀硫酸化学性质相似,是因为其溶液中都含有H+ B、生成盐和水的反应一定是中和反应 C、将硝酸铵固体溶于水溶液温度会升高 D、目前计入空气污染指数的有害气体包括:SO2、NO2、CO2、CO等12. 下表中,有关量的变化图像与其对应叙述相符的是( )
A、干燥O2 B、收集O2 C、检验CO2 D、收集O28. 下列气体不可用浓硫酸干燥的气体是( )A、氧气 B、氨气 C、二氧化碳气体 D、二氧化硫气体9. 氢氧化钠固体可用于干燥某些气体,是因为氢氧化钠固体具有( )A、脱水性 B、强腐蚀性 C、易潮解 D、强碱性10. 下列实验现象描述正确的是( )A、镁条在空气中燃烧:银白色固体燃烧,发出耀眼的强光,产生黄白色火焰 B、打开盛有浓盐酸的试剂瓶塞:试剂瓶瓶口处有白雾出现 C、向氢氧化镁中滴加无色酚酞溶液:无色酚酞溶液变红 D、把银丝放入硫酸铜溶液中:银白色固体表面产生紫红色固体,溶液由蓝色变成无色11. 下列说法正确的是( )A、稀盐酸、稀硫酸化学性质相似,是因为其溶液中都含有H+ B、生成盐和水的反应一定是中和反应 C、将硝酸铵固体溶于水溶液温度会升高 D、目前计入空气污染指数的有害气体包括:SO2、NO2、CO2、CO等12. 下表中,有关量的变化图像与其对应叙述相符的是( )A
B
C
D



浓硫酸敞口放置一段时间
向一定质量的氧化铁粉末中加入稀盐酸
向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn粉
向一定质量的二氧化锰中加入过氧化氢溶液
A、A B、B C、C D、D13. 氢氧化钠溶液、氢氧化钾溶液和氢氧化钙溶液具有相似的化学性质,其本质原因是( )A、都能离解出金属离子 B、都能使指示剂变色 C、都能离解出氢氧根离子 D、都能与酸反应生成盐和水14. 下列实验方案设计能达到实验目的是( )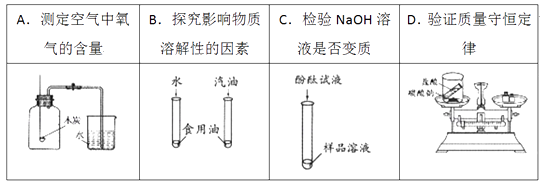 A、A B、B C、C D、D
A、A B、B C、C D、D二、填空题
-
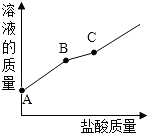
15. 浓H2SO4在空气中敞口放置一段时间后,其质量分数会填“增大”、“减 小”或“不变”);将 20 g 质量分数为 98%的浓H2SO4稀释为 10%的 H2SO4 , 需要水的质量为g;量取水时俯视读数则所配溶液中质的量分数(选填“偏大”、 “偏小”或“不变”)。16. 盐酸是气体的水溶液,打开盛有浓盐酸的瓶盖时,瓶口会出现 , 这是因为挥发出来的气体与空气中的结合形成小液滴,这一现象说明了浓盐酸具有性,也说明了气体易溶于水的性质.17. 生石灰的化学式为 , 通常是一种 色 体,遇水化合生成 并放出大量的 , 反应化学方程式为 . 该生成物又俗称 .18. 敞口放置的氢氧化钠溶液易吸收空气中的二氧化碳而变质,请写出此过程的化学方程式: . 现向一定质量且部分变质的氢氧化钠溶液中逐滴加入稀盐酸,并振荡.如图表示反应过程中溶液质量随加入盐酸质量的变化而变化的情况.那么,图线BC段对应的实验现象是 , 在C点时溶液中的溶质是 .
三、综合题
-
19. 结合教材请回答下列问题:
(1)、食醋中含有醋酸的化学式; (2)、炉具清洁剂中含有碱的化学式;
(2)、炉具清洁剂中含有碱的化学式; (3)、用玻璃棒蘸浓硫酸在纸上写字变黑的原因:浓硫酸具有性能夺取纸张中的水分,生成。
(3)、用玻璃棒蘸浓硫酸在纸上写字变黑的原因:浓硫酸具有性能夺取纸张中的水分,生成。 (4)、将水加入到浓硫酸中观察到的现象:放热,水沸腾,由于 , 会浮在上面,溶解时使水立刻沸腾,从而产生此现象。
(4)、将水加入到浓硫酸中观察到的现象:放热,水沸腾,由于 , 会浮在上面,溶解时使水立刻沸腾,从而产生此现象。 20. 分别用加入足量稀硫酸和加入过量的硫酸铜溶液的方法除去铜粉中的少量铁粉,充分反应后,将上述2个实验后的物质倒入同一个烧杯中,过滤得到滤液和滤渣。(1)、向滤液中加入铁粉,有大量气泡冒出,证明滤液中一定含有H2SO4 , 加入下列试剂中的________
20. 分别用加入足量稀硫酸和加入过量的硫酸铜溶液的方法除去铜粉中的少量铁粉,充分反应后,将上述2个实验后的物质倒入同一个烧杯中,过滤得到滤液和滤渣。(1)、向滤液中加入铁粉,有大量气泡冒出,证明滤液中一定含有H2SO4 , 加入下列试剂中的________
A、NaOH溶液 B、BaCl2溶液 C、CuO也能得出同样的结论。(2)、滤液中还一定含有的溶质是(3)、对滤渣洗涤并在石棉网上加热烘干,获得铜粉。但发现铜的产率高于100%,除因和CuSO4溶液反应生成部分铜外,还可能的原因是 。21. 古往今来,金属材料和制品在我们的社会生活中一直起者非常重要的作用。(1)、考古工作者发现铁质的出土文物往往锈蚀严重,铁生锈的条件是。在实验室常用稀盐酸清除铁锈,化学方程式为。(2)、近年来,我国高铁建设促进了经济、社会的快速发展。制造铁轨的材料是合金钢,主要原因是合金钢具有的优越性能(要求只答一条)。(3)、某同学在实验室进行了两个有关金属性质的实验:实验Ⅰ:硫酸铝溶液和铁粉混合
实验Ⅱ:硫酸铜溶液与铁粉混合
在上述两个实验结束后,该同学将实验Ⅰ和Ⅱ的物质全部倒入同一个烧杯中,发现烧杯内的红色固体明显增多,原因是(用文字说明)。一段时间后过滤,向滤渣中滴加盐酸,结果没有气泡产生。那么,滤液中所含金属离子的情况可能是(填写序号)。
①Al3+②Al3+、Fe2+③Al3+、Fe3+④Fe2+、Cu2+⑤Al3+、Fe2+、Cu2+
四、计算题
-
22. 将Cu与CuO固体混合物粉末11.2克放入烧杯中,当加入100克稀H2SO4时,CuO与H2SO4恰好完全反应, 过滤后所得溶液的质量为108克(不考虑过滤过程中溶液质量的损失)。请计算
⑴.原固体混合物中含铜的质量分数(计算结果保留到0.1%)。
⑵.稀硫酸中含H2SO4的质量分数。