2016-2017学年吉林省辽源市普通高中高二上学期期中化学试卷
试卷更新日期:2017-04-12 类型:期中考试
一、选择题
-
1. 下列说法正确的是( )A、1 mol硫酸与1 mol Ba(OH)2完全中和所放出的热量为中和热 B、101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热 C、CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2 , 所以CO的燃烧反应一定是吸热反应 D、25℃、101 kPa时,1 mol S和2 mol S的燃烧热相等2. 常温下,下列离子能使纯水中的H+离子数目增加的是( )A、S2﹣ B、CO32﹣ C、NH4+ D、Br﹣3. 某一反应在一定条件下的平衡转化率为25.3%,当使用了催化剂时,其转化率为( )A、大于25.3% B、小于25.3% C、等于25.3% D、约等于25.3%4. 下列各组离子一定能大量共存的是( )A、在含大量Fe3+的溶液中:NH4+、Na+、Cl﹣、SCN﹣ B、在强碱溶液中:Na+、K+、AlO2﹣、CO32﹣ C、在c(H+)=10﹣13mol/L的溶液中:NH4+、Al3+、SO42﹣、NO3﹣ D、在pH=0的溶液中:K+、Fe2+、Cl﹣、NO3﹣5. 对于合成氨反应N2(g)+3H2(g)⇌2NH3(g) 298K时,△H=﹣92.2kJ•mol﹣1 , △S=﹣198.2kJ•mol﹣1•K﹣1 ,
下列说法正确的是( )
A、升高温度和增大压强都有利于平衡向生成氨的方向移动 B、298K时合成氨反应不能自发进行 C、298K时合成氨的反应速率一定很大 D、298K时合成氨反应可自发进行6. 将4mol A气体和2mol B气体在体积为2L的密闭容器中混合,并在一定条件下发生反应:2A(g)+B(g)⇌xC(g),若经2s后测得A的物质的量为2.8mol,C的物质的量浓度为0.6mol/L.现有几种说法:①2s内用物质A表示的平均反应速率为0.3mol/(L•s);②2s内用物质B表示的平均反应速率为0.6mol/(L•s);③2s时物质B的转化率为70%;④x=2.其中正确的是( )A、①③ B、①④ C、②③ D、③④7. 用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )A、 B、 C、c(H+)和c(OH﹣)的乘积 D、OH﹣的物质的量8. 下列事实一定能说明HF是弱酸的是( )①常温下NaF溶液的pH大于7;
②用HF溶液做导电性实验,灯泡很暗;
③HF与NaCl不能发生反应;
④常温下0.1mol/L的HF溶液的pH为2.3;
⑤HF能与Na2CO3溶液反应,产生CO2气体;
⑥HF与水能以任意比混溶;
⑦1mol/L的HF水溶液能使紫色石蕊试液变红.
A、①②⑦ B、②③⑤ C、③④⑥ D、①④9. 一定温度下,水溶液中H+和OH﹣的浓度变化曲线如图,下列说法正确的是( )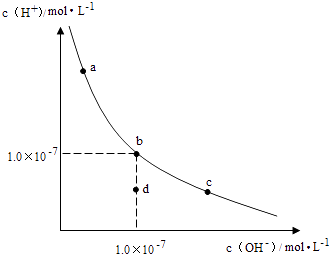 A、升高温度,可能引起由c向b的变化 B、该温度下,水的离子积常数为1.0×10﹣13 C、该温度下,加入FeCl3可能引起由b向a的变化 D、该温度下,稀释溶液可能引起由c向d的变化10. 已知化学反应:C(s)+ O2(g)═CO(g)△H1<0,CO(g)+ O2(g)═CO2(g)△H2<0,
A、升高温度,可能引起由c向b的变化 B、该温度下,水的离子积常数为1.0×10﹣13 C、该温度下,加入FeCl3可能引起由b向a的变化 D、该温度下,稀释溶液可能引起由c向d的变化10. 已知化学反应:C(s)+ O2(g)═CO(g)△H1<0,CO(g)+ O2(g)═CO2(g)△H2<0,C(s)+O2(g)═CO2(g)△H3<0;下列说法正确的是( )
A、56 g CO和32 g O2所具有的总能量小于88 g CO2所具有的总能量 B、碳的燃烧热是△H3 C、△H1<△H3 D、28 g CO的总能量比44 g CO2的总能量高11. 某温度下在密闭容器中发生如下反应:2M(g)+N(g)⇌2E(g)若开始时只充入2molE(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2molM和1molN的混合气体,达平衡时M的转化率为( )A、20% B、40% C、60% D、80%12. 已知下列热化学方程式:①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1=﹣26.7kJ•mol﹣1
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H2=﹣50.75kJ•mol﹣1
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3=﹣36.5kJ•mol﹣1
则反应FeO(s)+CO(g)═Fe(s)+CO2(g)的焓变为( )
A、+7.28 kJ•mol﹣1 B、﹣7.28 kJ•mol﹣1 C、+43.68 kJ•mol﹣1 D、﹣43.68 kJ•mol﹣113. 汽车尾气中,产生NO的反应为:N2(g)+O2(g)⇌2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化.下列叙述正确的是( ) A、若曲线b对应的条件改变是温度,可判断该反应的△H<0 B、温度T下,随着反应的进行,混合气体的密度减小 C、曲线b对应的条件改变可能是加入了催化剂 D、温度T下,该反应的平衡常数K=14. 将一定量的固体Ag2SO4置于容积不变的容器中(装有少量V2O5),在某温度下发生反应:
A、若曲线b对应的条件改变是温度,可判断该反应的△H<0 B、温度T下,随着反应的进行,混合气体的密度减小 C、曲线b对应的条件改变可能是加入了催化剂 D、温度T下,该反应的平衡常数K=14. 将一定量的固体Ag2SO4置于容积不变的容器中(装有少量V2O5),在某温度下发生反应:Ag2SO4(s)⇌Ag2O(s)+SO3(g),2SO3(g)⇌2SO2(g)+O2(g)反应经过10min达到平衡,测得c(SO3)=0.4mol/L、c(SO2)=0.1mol/L,则下列叙述中正确的是( )
A、容器里气体的密度为40 g/L B、SO3的分解率为30% C、在这10 min内的平均速率为v(O2)=0.05 mol•L﹣1•min﹣1 D、化学反应速率:v(Ag2SO4)=v(SO3)15. 氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是( )A、再通入少量氯气, 减小 B、通入少量SO2 , 溶液的漂白性增强 C、加入少量水,水的电离平衡向正反应方向移动 D、加入少量固体NaOH,一定有c(Na+)=c(Cl﹣)+c(ClO﹣)16. NH4HS(s)⇌NH3(g)+H2S(g)在一定温度下达到平衡,下列情况不能使平衡发生移动的是( )A、温度、容积不变,充入NH3 B、温度、容积不变时,充入SO2气体 C、充入N2 , 保持压强不变 D、移走一部分NH4HS固体17. 25℃时,在10mL浓度均为0.1mol•L﹣1的NaOH和NH3•H2O混合溶液中滴加0.1mol•L﹣1盐酸,下列有关溶液中粒子浓度关系正确的是( )A、未加盐酸时:c(OH﹣)>c(Na+)=c(NH3•H2O) B、加入10mL盐酸时:c(NH4+)+c(H+)=c(OH﹣) C、加入盐酸至溶液pH=7时:c(Cl﹣)=c(Na+) D、加入20mL盐酸时:c(Cl﹣)=c(NH4+)+c(Na+)18. 对于可逆反应mA(g)+nB(s)⇌pC(g)+qD(g)反应过程中,其他条件不变时,D的百分含量与温度(T)或压强(P)关系如图所示,反应达平衡后,下列叙述正确的是( ) A、升高温度,平衡正移 B、使用催化剂,D的百分含量增加 C、m<p+q D、B的颗粒越小,反应速率越快,有利于平衡向正反应方向移动19. 在容积一定的密闭容器中,反应2A⇌B (g)+C (g)达到平衡后,升高温度容器内气体密度增大,则下列叙述正确的是( )A、改变压强对该平衡的移动无影响 B、正反应是放热反应且A不是气态 C、其它条件不变,加入少量A,该平衡向正反应方向移动 D、正反应是吸热反应且A不是气态20. 羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害.在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
A、升高温度,平衡正移 B、使用催化剂,D的百分含量增加 C、m<p+q D、B的颗粒越小,反应速率越快,有利于平衡向正反应方向移动19. 在容积一定的密闭容器中,反应2A⇌B (g)+C (g)达到平衡后,升高温度容器内气体密度增大,则下列叙述正确的是( )A、改变压强对该平衡的移动无影响 B、正反应是放热反应且A不是气态 C、其它条件不变,加入少量A,该平衡向正反应方向移动 D、正反应是吸热反应且A不是气态20. 羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害.在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)⇌COS(g)+H2(g) K=0.1
反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是( )
A、升高温度,H2S浓度增加,表明该反应是吸热反应 B、通入CO后,正反应速率逐渐增大 C、反应前H2S物质的量为7mol D、CO的平衡转化率为80%二、解答题
-
21. 可逆反应3A(g)⇌3B(?)+C(?)△H>0达到化学平衡后,(1)、升高温度,用“变大”、“变小”、“不变”或“无法确定”填空.
a.若B、C都是气体,气体的平均相对分子质量;
b.若B、C都不是气体,气体的平均相对分子质量;
c.若B是气体,C不是气体,气体的平均相对分子质量;
(2)、如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是态,C是态.22. 已知:T℃、P kpa时,容积为V 的密闭容器中充有1molA和2molB,保持恒温恒压使反应达平衡:A(g)+B(g)⇌C(g),平衡时C 的体积分数为40%.(1)、欲保持温度、压强在上述条件下不变,在密闭容器中充入2molA和4molB,则平衡时体系容积为 , C的体积分数为 .(2)、另取一个容积固定不变的密闭容器,仍控制温度为T℃,加入1molB和1molC,要使平衡时C 的体积分数仍为40%,则该密闭容器体积为 .23. T℃、2L密闭容器中某一反应不同时刻各物质的量如图(E为固体,其余为气体).回答下列问题:
(1)、写出该反应的化学方程式 .(2)、反应开始至3min时,用D表示的平均反应速率为mol/(L•min).(3)、T℃时,该反应的化学平衡常数K= .(4)、第6min时,保持温度不变,将容器的体积缩小至原来的一半,重新达到平衡后,D的体积分数为 .物质
A
B
D
E
物质的量mol
0.8
1.0
0.4
0.2
(5)、另有一个2L的密闭容器,T℃、某一时刻时,容器中各物质的量如表所示:此时v(正)v(逆)(填“大于”或“等于”或“小于”).
24. 根据题意填空(1)、室温下,0.1 mol/L NaClO溶液的pH0.1 mol/L Na2SO3溶液的pH.(选填“大于”、“小于”或“等于”).浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中,SO32﹣、CO32﹣、HSO3﹣、HCO3﹣ 浓度从大到小的顺序为 .
已知:H2SO3 K1=1.54×10﹣2 K2=1.02×10﹣7 HClO K1=2.95×10﹣8
H2CO3 K1=4.3×10﹣7 K2=5.6×10﹣11
(2)、用标准碘溶液滴定容有SO2的水溶液,以测定水中SO2的含量,应选用作指示剂,达到滴定终点的现象是 .(3)、常温下,将amol/lCH3COONa溶于水配成溶液,向其中滴加等体积bmol•L﹣1的盐酸使溶液呈中性(不考虑醋酸和盐酸的挥发),用含a和b的代数式表示醋酸的电离平衡常数Ka= .25. 甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2+8H2O)甲组:利用如图装置,通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.(实验中所用KMnO4溶液均已加入H2SO4)

序号
A溶液
B溶液
①
2mL 0.2mol/LH2C2O4溶液
4mL 0.01mol/LKMnO4溶液
②
2mL 0.1mol/LH2C2O4溶液
4mL 0.01mol/LKMnO4溶液
③
2mL 0.2mol/LH2C2O4溶液
4mL 0.01mol/LKMnO4溶液和少量MnSO4
(1)、该实验的目的是探究对化学反应速率的影响.(2)、分液漏斗中A溶液应该加入(填“一次性”或“逐滴滴加”)(3)、实验结束后,读数前为了使两个量气管的压强相等,避免产生压强差,影响测定结果,需要进行的操作是 . 乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验实验编号
1
2
3
4
水/mL
10
5
0
X
0.5mol/L H2C2O4/mL
5
10
10
5
0.2mol/L KMnO4/mL
5
5
10
10
时间/s
40
20
10
﹣﹣﹣
(4)、X=A.5 B.10 C.15 D.20
4号实验中始终没有观察到溶液褪色,你认为可能的原因是 .