2016-2017学年山东省枣庄市滕州市高三上学期期中化学试卷(四)28
试卷更新日期:2017-04-12 类型:期中考试
一、选择题
-
1. 天然海水中主要含有Na+、K+、Ca2+、Mg2+、Cl﹣、SO42﹣、Br﹣、CO32﹣、HCO3﹣等离子.火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如图所示:
 下列说法错误的是( ) A、天然海水pH≈8的原因是由于海水中的CO32﹣、HCO3﹣水解 B、“氧化”是利用氧气将H2SO3、HSO3﹣、SO32﹣等氧化生成SO42﹣ C、“反应、稀释”时加天然海水的目的是中和、稀释经氧化后海水中生成的酸 D、“排放”出来的海水中SO42﹣的物质的量浓度与进入吸收塔的天然海水相同2. 设NA为阿伏加德罗常数,下列说法正确的是( )A、常温下,22gCO2含碳氧双键数目为2NA B、12.0gNaHSO4固体中含阳离子数为0.1NA C、标准状况下,22.4LBr2中所含分子数为NA D、7.8gNa2O2与足量的水反应转移电子数为0.2NA3. 下列各组离子在指定溶液中能大量共存的是( )A、含大量OH﹣的溶液:Ba2+、K+、NO3﹣、AlO2﹣ B、加入Na2O2粉末的溶液:Na+、Cl﹣、SO32﹣、OH﹣ C、c(KNO3)=1.0mol/L的溶液:H+、Fe2+、Cl﹣、SO42﹣ D、加入石蕊呈蓝色的溶液:NH4+、Ba2+、HCO3﹣、Br﹣4. 东晋炼丹家葛洪的《抱朴子》里记载“丹砂(HgS)烧之成水银,积变又还成了丹砂”这句话里没有涉及到的反应类型为( )A、氧化还原反应 B、化合反应 C、分解反应 D、置换反应5. 太阳能的开发和利用是21世纪一个重要课题.利用储能介质储存太阳能的原理是:白天在太阳照射下某种盐熔化,吸收热量,晚间熔盐固化释放出相应的能量,已知数据:
下列说法错误的是( ) A、天然海水pH≈8的原因是由于海水中的CO32﹣、HCO3﹣水解 B、“氧化”是利用氧气将H2SO3、HSO3﹣、SO32﹣等氧化生成SO42﹣ C、“反应、稀释”时加天然海水的目的是中和、稀释经氧化后海水中生成的酸 D、“排放”出来的海水中SO42﹣的物质的量浓度与进入吸收塔的天然海水相同2. 设NA为阿伏加德罗常数,下列说法正确的是( )A、常温下,22gCO2含碳氧双键数目为2NA B、12.0gNaHSO4固体中含阳离子数为0.1NA C、标准状况下,22.4LBr2中所含分子数为NA D、7.8gNa2O2与足量的水反应转移电子数为0.2NA3. 下列各组离子在指定溶液中能大量共存的是( )A、含大量OH﹣的溶液:Ba2+、K+、NO3﹣、AlO2﹣ B、加入Na2O2粉末的溶液:Na+、Cl﹣、SO32﹣、OH﹣ C、c(KNO3)=1.0mol/L的溶液:H+、Fe2+、Cl﹣、SO42﹣ D、加入石蕊呈蓝色的溶液:NH4+、Ba2+、HCO3﹣、Br﹣4. 东晋炼丹家葛洪的《抱朴子》里记载“丹砂(HgS)烧之成水银,积变又还成了丹砂”这句话里没有涉及到的反应类型为( )A、氧化还原反应 B、化合反应 C、分解反应 D、置换反应5. 太阳能的开发和利用是21世纪一个重要课题.利用储能介质储存太阳能的原理是:白天在太阳照射下某种盐熔化,吸收热量,晚间熔盐固化释放出相应的能量,已知数据:盐
熔点(℃)
熔化吸热(kJ•mol﹣1)
参考价格(元•t﹣1)
CaCl2•6H2O
29.9
37.3
780~850
Na2SO4•10H2O
32.4
77.0
800~900
Na2HPO4•12H2O
35.1
100.1
1 600~2 000
Na2S2O3•5H2O
45.0
49.7
1 400~1 800
其中最适宜选用作为储能介质的是( )
A、CaCl2•6H2O B、Na2SO4•10H2O C、Na2HPO4•12H2O D、Na2S2O3•5H2O6. R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)( )A、若R(OH)n为强碱,则W(OH)n+1也为强碱 B、若HnXOm为强酸,则Y是活泼的非金属元素 C、若Y的最低化合价为﹣2,则Z的最高正化合价为+7 D、若X的最高正化合价为+5,则五种元素都是非金属元素7. 将0.1mol•L﹣1的KI溶液和0.05mol•L﹣1 Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I﹣⇌2Fe2++I2”的是( )实验编号
实验操作
实验现象
①
滴入KSCN溶液
溶液变红色
②
滴入AgNO3溶液
有黄色沉淀生成
③
滴入K3[Fe(CN)6]溶液
有蓝色沉淀生成
④
滴入淀粉溶液
溶液变蓝色
A、①和② B、②和④ C、③和④ D、①和③8. 室温下,0.1mol/L的二元酸H2A溶液中,溶液体系可能存在的含A粒子(H2A、HA﹣、A2﹣)所占物质的量分数随pH变化的关系如图所示,下列说法正确的是( ) A、H2A的电离方程式为:H2A⇌H++HA﹣ B、pH=5时,在NaHA和Na2A的混合溶液中:c(HA﹣):c(A2﹣)=1:100 C、等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为c(Na+)>c(HA﹣)>c(A2﹣) D、Na2A溶液必存在c(OH﹣)=c(H+)+c(HA﹣)+2c(H2A),各粒子浓度均大于09. 三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42﹣可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( )
A、H2A的电离方程式为:H2A⇌H++HA﹣ B、pH=5时,在NaHA和Na2A的混合溶液中:c(HA﹣):c(A2﹣)=1:100 C、等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为c(Na+)>c(HA﹣)>c(A2﹣) D、Na2A溶液必存在c(OH﹣)=c(H+)+c(HA﹣)+2c(H2A),各粒子浓度均大于09. 三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42﹣可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( )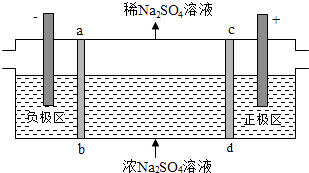 A、通电后中间隔室的SO42﹣离子向正极迁移,正极区溶液pH增大 B、该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 C、负极反应为2H2O﹣4e﹣=O2+4H+ , 负极区溶液pH降低 D、当电路中通过1mol电子的电量时,会有0.5mol的O2生成10. 下列说法正确的是( )A、在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实.2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g),则可推测该反应是吸热反应 B、室温下,将浓度为0.1mol•L‾1HF溶液加水稀释,其电离平衡常数和 均不变 C、电解精练铜时,阳极泥中常含有金属金、银、锌等 D、锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后再用酸溶解去除11. 下表中关于物质分类的正确组合是( )
A、通电后中间隔室的SO42﹣离子向正极迁移,正极区溶液pH增大 B、该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 C、负极反应为2H2O﹣4e﹣=O2+4H+ , 负极区溶液pH降低 D、当电路中通过1mol电子的电量时,会有0.5mol的O2生成10. 下列说法正确的是( )A、在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实.2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g),则可推测该反应是吸热反应 B、室温下,将浓度为0.1mol•L‾1HF溶液加水稀释,其电离平衡常数和 均不变 C、电解精练铜时,阳极泥中常含有金属金、银、锌等 D、锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后再用酸溶解去除11. 下表中关于物质分类的正确组合是( )类别组合
酸性氧化物
碱性氧化物
酸
碱
盐
A
CO
CuO
H2SO4
NH3•H2O
Na2S
B
CO2
Na2O
HCl
NaOH
NaCl
C
SO2
Na2O2
CH3COOH
KOH
CaF2
D
NO2
CaO
HNO3
Cu(OH)2CO3
CaCO3
A、A B、B C、C D、D12. 有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06g Na2CO3和0.84g NaHCO3 , A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是( ) A、A装置的气球膨胀速率大 B、若最终两气球体积不同,则盐酸的浓度一定小于或等于1mol/L C、若最终两气球体积相同,则盐酸的浓度一定大于或等于2mol/L D、最终两试管中Na+、Cl﹣的物质的量一定相同13. 下列说法正确的是( )A、500 mL 1mol/L Fe2(SO4)3溶液和250 mL 3 mol/L的Na2SO4溶液所含硫酸根离子的浓度相等 B、若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q C、1.2 g NaHSO4晶体中阳离子和阴离子的总数为0.03NA D、含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L14. 将一定量的Fe、Fe2O3、CuO的混合物放入体积为100mL、浓度为2.1mol•L﹣1的H2SO4溶液中,充分反应后,生成气体896mL(标准状况),得到不溶固体1.28g.过滤后,滤液中的金属离子只有Fe2+(假设滤液体积仍为100mL).向滤液中滴加2mol•L﹣1NaOH溶液,直至30mL时开始出现沉淀.则原混合物中Fe物质的量为( )A、2 mol B、1.2 mol C、0.1mol D、1.6 mol15. 将50g质量分数为ω1 , 物质的量浓度为C1的浓硫酸沿玻璃棒加入到VmL水中,稀释后得到质量分数为ω2 , 物质的量浓度为C2的稀溶液.下列说法中正确的是( )A、若C1=2C2 , 则ω1<2ω2 , V<50mL B、若C1=2C2 , 则ω1<2ω2 , V>50mL C、若ω1=2ω2 , 则C1<2C2 , V=50mL D、若ω1=2ω2 , 则C1>2C2 , V<50Ml16. 某温度下,水的离子积常数KW=1×10﹣12 . 该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为( )A、1:10 B、9:1 C、1:9 D、99:2117. NA代表阿伏加德罗常数,下列有关热化学方程式:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJ•mol﹣1的说法中正确的是( )A、有4 NA个电子转移时,放出890kJ的能量 B、有NA个C﹣H共价键断裂时,放出890kJ的能量 C、有NA个水分子生成且水为液体时,放出890kJ的能量 D、有2NA个C、O间的共用电子对生成时,放出445kJ的能量18. 一定条件下,向密闭容器中加入 X物质,发生反应3X(g)═Y(g)+Z(g)△H<0,反应一定时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示,下列说法中不正确的是( )
A、A装置的气球膨胀速率大 B、若最终两气球体积不同,则盐酸的浓度一定小于或等于1mol/L C、若最终两气球体积相同,则盐酸的浓度一定大于或等于2mol/L D、最终两试管中Na+、Cl﹣的物质的量一定相同13. 下列说法正确的是( )A、500 mL 1mol/L Fe2(SO4)3溶液和250 mL 3 mol/L的Na2SO4溶液所含硫酸根离子的浓度相等 B、若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q C、1.2 g NaHSO4晶体中阳离子和阴离子的总数为0.03NA D、含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L14. 将一定量的Fe、Fe2O3、CuO的混合物放入体积为100mL、浓度为2.1mol•L﹣1的H2SO4溶液中,充分反应后,生成气体896mL(标准状况),得到不溶固体1.28g.过滤后,滤液中的金属离子只有Fe2+(假设滤液体积仍为100mL).向滤液中滴加2mol•L﹣1NaOH溶液,直至30mL时开始出现沉淀.则原混合物中Fe物质的量为( )A、2 mol B、1.2 mol C、0.1mol D、1.6 mol15. 将50g质量分数为ω1 , 物质的量浓度为C1的浓硫酸沿玻璃棒加入到VmL水中,稀释后得到质量分数为ω2 , 物质的量浓度为C2的稀溶液.下列说法中正确的是( )A、若C1=2C2 , 则ω1<2ω2 , V<50mL B、若C1=2C2 , 则ω1<2ω2 , V>50mL C、若ω1=2ω2 , 则C1<2C2 , V=50mL D、若ω1=2ω2 , 则C1>2C2 , V<50Ml16. 某温度下,水的离子积常数KW=1×10﹣12 . 该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为( )A、1:10 B、9:1 C、1:9 D、99:2117. NA代表阿伏加德罗常数,下列有关热化学方程式:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJ•mol﹣1的说法中正确的是( )A、有4 NA个电子转移时,放出890kJ的能量 B、有NA个C﹣H共价键断裂时,放出890kJ的能量 C、有NA个水分子生成且水为液体时,放出890kJ的能量 D、有2NA个C、O间的共用电子对生成时,放出445kJ的能量18. 一定条件下,向密闭容器中加入 X物质,发生反应3X(g)═Y(g)+Z(g)△H<0,反应一定时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示,下列说法中不正确的是( )反应时间(min)
0
5
15
17
20
X的浓度(mol/L)
1.0
0.4
0.4
0.7
0.7
A、0~5 min时,该反应的速率为v(X)=0.12 mol/(L•min) B、5 min时反应达到第一次平衡,该温度下的平衡常数数值为0.625 C、15 min时改变的条件不可能是升高温度 D、从初始到18 min时,X的转化率为30%19. 有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的混合气体体积为(设反应中HNO3被还原成NO)( )A、0.448L B、0.672L C、0.896L D、0.224L20. 在120℃时,某混合烃和过量O2在一密闭容器中完全反应,测知反应前后的压强没有变化,则该混合烃可能是( )A、CH4和C2H4 B、C2H2和C2H4 C、C2H4和C2H6 D、C4H8和C3H621. 某溶液中有NH4+、Mg2+、Fe2+和Al3+四种阳离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子组合是( )A、NH4+、Mg2+ B、Mg2+、Fe2+ C、NH4+、Fe2+ D、Mg2+、Al3+22. 下列实验中,对应的现象以及结论都正确的是( )选项
实验
现象
结论
A
用洁淨铂丝蘸取少量待测液在酒精灯火焰上灼烧
火焰呈现黄色
待测液中只含Na+ , 不含K+
B
用铁作电极电解饱和食盐水
两极上均产生气体
阴、阳极分别生成H2和Cl2
C
向饱和氯水中加入少量石灰石
产生无色气体
酸性:HCl0>H2CO3
D
向Ca(ClO)2溶液中 通入足SO2
产生白色沉淀
Ca(ClO)2具有氧化性,沉淀为CaSO4
A、A B、B C、C D、D23. X、Y、Z、W有如图所示的转化关系,则X、W可能是( )①C、O2 ②AlCl3、NaOH ③Fe、HNO3 ④CO2、NaOH.
 A、①②③ B、①② C、③④ D、①②③④
A、①②③ B、①② C、③④ D、①②③④二、解答题
-
24. 已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.
I、用如图所示装置进行Mg与SO2反应的实验.
 (1)、选择制取SO2的合适试剂
(1)、选择制取SO2的合适试剂①10%的H2SO4溶液 ②70%的H2SO4溶液
③Na2SO3固体 ④CaSO3固体
(2)、写出装置B中发生的主要反应的化学方程式 . 装置C中NaOH溶液的作用是 .(3)、该装置仍有不足之处,请说明 .Ⅱ、某研究小组进行了“实验室制Si”的研究,它们以课本为基础,查阅资料得到以下可供参考的四条信息:
①Mg在加热的条件下即可与SiO2反应
②金属硅化物与稀H2SO4反应生成硫酸盐与SiH4
③Si和SiO2均不与稀H2SO4反应
④SiH4在空气中自燃
他们在研究报告中记载着“…选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量…在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”.
(4)、该小组“实验室制Si”的化学方程式是 .(5)、你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是(用化学方程式说明): .25. 含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O.Cu2O在稀硫酸中生成Cu和CuSO4 .(1)、基态Cu原子核外有 个不同运动状态的原子.Cu+基态核外电子排布式为(2)、醛基中碳原子的轨道杂化类型是;1mol乙醛分子中含有σ的键的数目为 . 乙醛可被氧化为乙酸.乙酸的沸点明显高于乙醛,其主要原因是: .(3)、氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有个铜原子.(4)、铜晶胞为面心立方晶体,其晶胞参数a=361.49pm,晶胞中铜原子的配位数为 . 列式表示铜单质的密度 g•cm﹣3 (不必计算出结果).将Cu单质的粉末加入NH3的浓溶液中,通入O2 , 充分反应后溶液呈深蓝色,该反应的离子方程式是26. 工业生产中产生的SO2、NO直接排放将对大气造成严重污染,利用电化学原理吸收SO2和NO,同时获得Na2S2O4和NH4NO3产品的工艺流程图如下(Ce为铈元素).
请回答下列问题.
(1)、装置Ⅱ中NO在酸性条件下生成NO2﹣的离子方程式 .(2)、含硫各微粒(H2SO3、HSO3﹣和SO32﹣)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示.
①下列说法正确的是(填标号).
A.pH=7时,溶液中c(Na+)<c(HSO3﹣)+c(SO32﹣)
B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10﹣7
C.为获得尽可能纯的NaHSO3 , 应将溶液的pH控制在4~5为宜
D.pH=9时的溶液中c(OH﹣)=c(H+)+c(HSO4﹣)+c(H2SO4)
②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2 , 则反应的离子方程式为 .
③取装置Ⅰ中的吸收液vmL,用cmol/L的酸性高锰酸钾溶液滴定.酸性高锰酸钾溶液应装在(填“酸式”或“碱式”)滴定管中,判断滴定终点的方法是 .
(3)、装置Ⅲ的作用之一是再生Ce4+ , 其原理如图2所示.图中A为电源的(填“正”或“负”)极.右侧反应室中发生的主要电极反应式为 .
(4)、已知进人装置Ⅳ的溶液中NO2﹣的浓度为0.4mol/L,要使1m3该溶液中的NO2﹣完全转化为NH4NO3 , 需至少向装置Ⅳ中通入标准状况下的O2的体积为L.27. 常温下,pH=1的某溶液A中含有NH4+、K+、Na+、Fe2+、Al3+、Fe3+、CO32﹣、NO3﹣、Cl﹣、I﹣、SO42﹣中的几种,且各离子浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如图所示:
回答下列问题:
(1)、溶液A中一定不存在的阴离子有 .(2)、生成沉淀甲和沉淀乙的离子方程式分别为 .(3)、气体乙的结构式为 .(4)、生成气体丙的离子方程式为若实验消耗Cu 144g,则最多生成气体丁的体积(标准状况下)为 .28. 焦亚硫酸钠(Na2S2O5)在食品加工中常用作防腐剂、漂白剂和疏松剂.焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化.实验室制备焦亚硫酸钠过程中依次包含以下几步反应:2NaOH+SO2═Na2SO3+H2O …(a)
Na2SO3+H2O+SO2═2NaHSO3…(b)
2NaHSO3 Na2S2O5+H2O …(c)
实验装置如图:
 (1)、实验室可用废铝丝与NaOH溶液反应制取H2 , 制取H2的离子方程式为 .(2)、如图1装置中,导管X的作用是(3)、通氢气一段时间后,以恒定速率通入SO2 , 开始的一段时间溶液温度迅速升高,随后温度缓慢变化,溶液开始逐渐变黄.“温度迅速升高”的原因为;实验后期须保持温度在约80℃,可采用的加热方式为 .(4)、反应后的体系中有少量白色亚硫酸钠析出,参照题如图2溶解度曲线,除去其中亚硫酸钠固体的方法是;然后获得较纯的无水Na2S2O5应将溶液冷却到30℃左右抽滤,控制“30℃左右”的理由是 .(5)、用如图3装置干燥Na2S2O5晶体时,通入H2的目的是;真空干燥的优点是 .(6)、测定产品中焦亚硫酸钠的质量分数常用剩余碘量法.已知:S2O52﹣+2I2+3H2O═2SO42﹣+4I﹣+6H+;2S2O32﹣+I2═S4O62﹣+2I﹣
(1)、实验室可用废铝丝与NaOH溶液反应制取H2 , 制取H2的离子方程式为 .(2)、如图1装置中,导管X的作用是(3)、通氢气一段时间后,以恒定速率通入SO2 , 开始的一段时间溶液温度迅速升高,随后温度缓慢变化,溶液开始逐渐变黄.“温度迅速升高”的原因为;实验后期须保持温度在约80℃,可采用的加热方式为 .(4)、反应后的体系中有少量白色亚硫酸钠析出,参照题如图2溶解度曲线,除去其中亚硫酸钠固体的方法是;然后获得较纯的无水Na2S2O5应将溶液冷却到30℃左右抽滤,控制“30℃左右”的理由是 .(5)、用如图3装置干燥Na2S2O5晶体时,通入H2的目的是;真空干燥的优点是 .(6)、测定产品中焦亚硫酸钠的质量分数常用剩余碘量法.已知:S2O52﹣+2I2+3H2O═2SO42﹣+4I﹣+6H+;2S2O32﹣+I2═S4O62﹣+2I﹣请补充实验步骤(可提供的试剂有:焦亚硫酸钠样品、标准碘溶液、淀粉溶液、酚酞溶液、标准Na2S2O3溶液及蒸馏水).
①精确称取产品0.2000g放入碘量瓶(带磨口塞的锥形瓶)中.
②准确移取一定体积和已知浓度的标准碘溶液(过量)并记录数据,在暗处放置5min,然后加入5mL冰醋酸及适量的蒸馏水.
③用标准Na2S2O3溶液滴定至接近终点.
④ .
⑤ .
⑥重复步骤①~⑤;根据相关记录数据计算出平均值.