甘肃省武威市第十八中学2018-2019学年高三上学期化学期末考试试卷
试卷更新日期:2019-01-17 类型:期末考试
一、单选题
-
1. 化学与生活密切相关。下列说法错误的是( )A、碳酸钠可用于去除餐具的油污 B、漂白粉可用于生活用水的消毒 C、氢氧化铝可用于中和过多胃酸 D、碳酸钡可用于胃肠X射线造影检查2. 根据所给信息和标志,判断下列说法错误的是( )
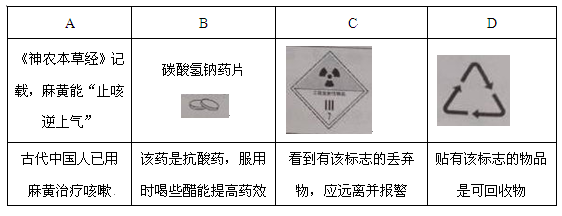 A、A B、B C、C D、D3. 下列有关物质性质与用途具有对应关系的是( )A、NaHCO3受热易分解,可用于制胃酸中和剂 B、铁比铜金属性强,FeCl3腐蚀Cu刻制印刷电路板 C、Al2O3是两性氧化物,可用作耐高温材料 D、CaO能与水反应,可用作食品干燥剂4. 我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na 2Na2CO3+C。下列说法错误的是()。
A、A B、B C、C D、D3. 下列有关物质性质与用途具有对应关系的是( )A、NaHCO3受热易分解,可用于制胃酸中和剂 B、铁比铜金属性强,FeCl3腐蚀Cu刻制印刷电路板 C、Al2O3是两性氧化物,可用作耐高温材料 D、CaO能与水反应,可用作食品干燥剂4. 我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na 2Na2CO3+C。下列说法错误的是()。 A、放电时,ClO4-向负极移动 B、充电时释放CO2 , 放电时吸收CO2 C、放电时,正极反应为:3CO2+4e-=2CO32-+C D、充电时,正极反应为:Na++e-=Na5. 下列叙述正确的是( )A、24 g 镁与27 g铝中,含有相同的质子数 B、同等质量的氧气和臭氧中,电子数相同 C、1 mol重水与1 mol水中,中子数比为2∶1 D、1 mol乙烷和1 mol乙烯中,化学键数相同6. 锌–空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O=2Zn(OH)42-。下列说法正确的是( )A、充电时,电解质溶液中K+向阳极移动 B、充电时,电解质溶液中c(OH-) 逐渐减小 C、放电时,负极反应为:Zn+4OH–-2e–= Zn(OH)42- D、放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)7. 一定温度下,在1L恒容密闭容器中加入1mol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g) 2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法错误的是( )
A、放电时,ClO4-向负极移动 B、充电时释放CO2 , 放电时吸收CO2 C、放电时,正极反应为:3CO2+4e-=2CO32-+C D、充电时,正极反应为:Na++e-=Na5. 下列叙述正确的是( )A、24 g 镁与27 g铝中,含有相同的质子数 B、同等质量的氧气和臭氧中,电子数相同 C、1 mol重水与1 mol水中,中子数比为2∶1 D、1 mol乙烷和1 mol乙烯中,化学键数相同6. 锌–空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O=2Zn(OH)42-。下列说法正确的是( )A、充电时,电解质溶液中K+向阳极移动 B、充电时,电解质溶液中c(OH-) 逐渐减小 C、放电时,负极反应为:Zn+4OH–-2e–= Zn(OH)42- D、放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)7. 一定温度下,在1L恒容密闭容器中加入1mol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g) 2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法错误的是( )时间(min)
0
t1
t2
t3
NH3物质的量(mol)
0
0.2
0.3
0.3
A、0〜t1min,v(NH3)=0.2/t1mol·L-1·min-1 B、t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1 C、N2(g)+3H2(g)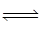 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g) 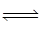 N2(g)+3H2(g)的活化能
D、升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
8. 含有下列各组离子的溶液中,后各离子仍能大量存在的是( )
N2(g)+3H2(g)的活化能
D、升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
8. 含有下列各组离子的溶液中,后各离子仍能大量存在的是( )选项
溶液中的离子
通入(或加入)过量的某种物质
A
H+、Ba2+、Fe3+、NO3-
通入SO2气体
B
AlO2-、Na+、Br-、SO42-
通入CO2气体
C
HCO3-、Na+、I-、HS-
加入AlCl3溶液
D
Ca2+、Cl-、K+、H+
通入CO2气体
A、A B、B C、C D、D9. 能正确表示下列反应的离子方程式是( )A、过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑ B、向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH- =2Al(OH)3↓+3BaSO4↓ C、用铜做电极电解CuSO4溶液:2Cu2++2H2O 2Cu+O2↑+4H+
D、FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
10. 短周期主族元素X、Y、Z、W的原子序数依次增大,其中X原子最外层电子数是内层电子数的两倍,元素Y的核电荷数等于W原子的最外层电子数,Z在空气中燃烧发出耀眼的白光。下列说法正确的是( )A、X和Y的氧化物都是可导致酸雨的污染物 B、Z和W形成的化合物中既有离子键又有共价键 C、最高价氧化物对应水化物的酸性由强到弱的顺序:W、Y、X D、原子半径由大到小的顺序:r(X)>r(Y)>r(Z)11. W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。下列叙述正确的是( )A、X与其他三种元素均可形成两种或两种以上的二元化合物 B、Y与其他三种元素分别形成的化合物中只含有离子键 C、四种元素的简单离子具有相同的电子层结构 D、W的氧化物对应的水化物均为强酸12. NA代表阿伏加德罗常数的值。下列说法正确的是( )A、常温常压下,124gP4中所含P—P键数目为4NA B、100mL1mol·L−1FeCl3溶液中所含Fe3+的数目为0.1NA C、标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA D、密闭容器中,2molSO2和1molO2催化反应后分子总数为2NA13. 下列各组离子在指定的溶液中能大量共存的是( )
2Cu+O2↑+4H+
D、FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
10. 短周期主族元素X、Y、Z、W的原子序数依次增大,其中X原子最外层电子数是内层电子数的两倍,元素Y的核电荷数等于W原子的最外层电子数,Z在空气中燃烧发出耀眼的白光。下列说法正确的是( )A、X和Y的氧化物都是可导致酸雨的污染物 B、Z和W形成的化合物中既有离子键又有共价键 C、最高价氧化物对应水化物的酸性由强到弱的顺序:W、Y、X D、原子半径由大到小的顺序:r(X)>r(Y)>r(Z)11. W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。下列叙述正确的是( )A、X与其他三种元素均可形成两种或两种以上的二元化合物 B、Y与其他三种元素分别形成的化合物中只含有离子键 C、四种元素的简单离子具有相同的电子层结构 D、W的氧化物对应的水化物均为强酸12. NA代表阿伏加德罗常数的值。下列说法正确的是( )A、常温常压下,124gP4中所含P—P键数目为4NA B、100mL1mol·L−1FeCl3溶液中所含Fe3+的数目为0.1NA C、标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA D、密闭容器中,2molSO2和1molO2催化反应后分子总数为2NA13. 下列各组离子在指定的溶液中能大量共存的是( )①无色溶液中:K+、Cu2+、Na+、SO42﹣
②碱性溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣
③酸性溶液中:Fe2+、Al3+、NO3﹣、Cl﹣
④加入Al能放出H2的溶液中:Cl﹣、HCO3﹣、NO3﹣、NH4+
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、Cl﹣、S2﹣、ClO﹣
⑥含Fe2+的溶液中:Na+、Ba2+、Cl﹣、I﹣
A、①② B、②③ C、②⑥ D、②⑤⑥14. 处于平衡状态的反应:2H2S(g) 2H2(g)+S2(g) ΔH>0,不改变其他条件的情况下正确的是( )A、加入催化剂,反应途径将发生改变,ΔH也将随之改变 B、升高温度,正、逆反应速率都增大,H2S分解率也增大 C、增大压强,平衡向逆反应方向移动,将引起体系温度降低 D、若体系恒容,注入一些H2后达新平衡,H2浓度将减小15. 如图曲线a表示放热反应 X(g) + Y(g) Z(g) + M(g) + N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( ) A、升高温度 B、加大X的投入量 C、加催化剂 D、增大体积16. 以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备 Fe(OH)2 , 装置如图所示,其中电解池两极材料分别为铁和石墨,通电一段时间后,右侧玻璃管中产生大量的白色沉淀。则下列说法正确的是( )
A、升高温度 B、加大X的投入量 C、加催化剂 D、增大体积16. 以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备 Fe(OH)2 , 装置如图所示,其中电解池两极材料分别为铁和石墨,通电一段时间后,右侧玻璃管中产生大量的白色沉淀。则下列说法正确的是( ) A、石墨电极Ⅱ处的电极反应式为O2+4e-=2O2- B、X是铁电极 C、电解池中有1mol Fe溶解,石墨Ⅰ耗H2 22.4 L D、若将电池两极所通气体互换,X、Y两极材料也要互换。
A、石墨电极Ⅱ处的电极反应式为O2+4e-=2O2- B、X是铁电极 C、电解池中有1mol Fe溶解,石墨Ⅰ耗H2 22.4 L D、若将电池两极所通气体互换,X、Y两极材料也要互换。二、综合题
-
17. 氮的化合物在生产、生活中广泛存在。(1)、键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知下列化学键的键能如下表:

写出1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式。
(2)、用焦炭还原NO的反应为:2NO(g)+C(s) N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示: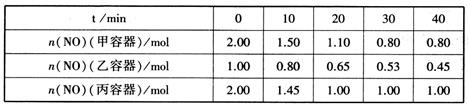
①该反应为(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率v(NO)=。
(3)、用焦炭还原NO2的反应为:2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示: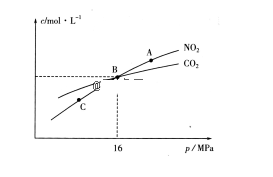
①A、C两点的浓度平衡常数关系:Kc(A)Kc(C)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是(填“A”或“B”或“C”)点。
18. 反应aA(g)+bB(g) cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示: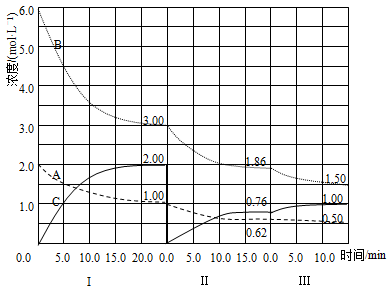
回答问题:
(1)、反应的化学方程式中a∶b∶c为;(2)、A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为;(3)、B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是 , 其值是;(4)、由第一次平衡到第二次平衡,平衡移动的方向是 , 采取的措施是;(5)、比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低;T2T3 (填“<”“>”“=”),判断的理由是。19. 碳和氮是动植物体中的重要组成元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会产生光化学烟雾,目前,这些有毒有害气体的处理成为科学研究的重要内容。(1)、已知热化学方程式:①2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH1
②C(s)+O2(g)=CO2(g) ΔH2
③H2(g)+1/2O2(g)=H2O(l) ΔH3
则反应④2C(s)+H2(g)=C2H2(g)的ΔH=。(用含ΔH1、ΔH2、ΔH3的关系式表示)
(2)、利用上述反应①设计燃料电池(电解质溶液为氢氧化钾溶液),写出电池的负极反应式:。(3)、用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) ΔH<0。在T1℃时,反应进行到不同时间测得各物质的浓度如下:时间/min
浓度/(mol·L-1)
物质
0
10
20
30
40
50
NO
1.00
0.58
0.40
0.40
0.48
0.48
N2
0
0.21
0.30
0.30
0.36
0.36
CO2
0
0.21
0.30
0.30
0.36
0.36
①1~10 min内,NO的平均反应速率v(NO)= , T1℃时,该反应的平衡常数K1=。T2温度下的平衡常数为K2 , 若T1>T2 , 则K1K2
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(填字母编号)。
a.通入一定量的NO
b.加入一定量的C
c.适当升高反应体系的温度
d.加入合适的催化剂
e.适当缩小容器的体积
三、填空题
-
20. 知识的梳理和感悟是有效学习的方法之一。某学习小组将有关“电解饱和食盐水”的相关内容进行梳理,形成如下问题(显示的电极均为石墨)。(1)、图中,电解一段时间后,气球b中的气体是(填化学式),U形管(填“左”或“右”)边的溶液变红。
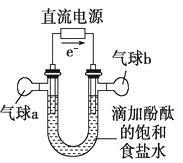 (2)、利用图制作一种环保型消毒液发生器,可制备“84”消毒液的有效成分,则c为电源的极;该发生器中反应的总离子方程式为。
(2)、利用图制作一种环保型消毒液发生器,可制备“84”消毒液的有效成分,则c为电源的极;该发生器中反应的总离子方程式为。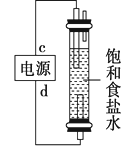 (3)、氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。
(3)、氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。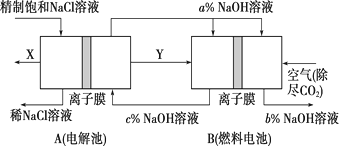
①燃料电池B中的电极反应式分别为
负极: ,
正极:。
②分析图3可知,氢氧化钠的质量分数为a%、b%、c%,由大到小的顺序为。