甘肃省武威市第十八中学2018-2019学年高二上学期化学期末考试试卷
试卷更新日期:2019-01-17 类型:期末考试
一、单选题
-
1. 下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
选项
A
B
C
D
强电解质
Fe
NaCl
CaCO3
HNO3
弱电解质
CH3COOH
NH3
H3PO4
Fe(OH)3
非电解质
蔗糖
BaSO4
酒精
H2O
A、A B、B C、C D、D2. 2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3+Cl2⇌PCl5 . 达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2 , 在相同温度下再达平衡时PCl5的物质的量是( )A、0.40mol B、0.20mol C、小于0.20mol D、大于0.20mol,小于0.40mol3. 在100℃时,水的离子积等于1.0×10-12 , 若该温度下某溶液中的c(H+)=1×10-7 mol/L,则该溶液( )A、呈碱性 B、呈酸性 C、呈中性 D、c(H+)=c(OH-)4. 某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) Z(g)+W(s);ΔH>0 下列叙述正确的是( )A、加入少量W,逆反应速率增大 B、当容器中气体压强不变时,反应达到平衡状态 C、升高温度,平衡逆向移动 D、平衡后加入X,上述反应的ΔH增大5. 常温下,关于溶液的稀释,下列说法正确的是( )A、pH=3的醋酸溶液稀释100倍,pH=5 B、pH=4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的c(H+)=1×10-6 mol·L-1 C、将1 L 0.1 mol·L-1的Ba(OH)2溶液稀释为2 L,pH=13 D、pH=8的NaOH溶液稀释100倍,其pH=66. 在下列实验方法中,不能证明醋酸是弱酸的是( )A、25 ℃时,醋酸钠溶液呈碱性 B、25 ℃时,0.1 mol/L的醋酸的pH约为3 C、25 ℃时,等体积的盐酸和醋酸,前者比后者的导电能力强 D、25 ℃时,将pH=3的盐酸和醋酸稀释成pH=4的溶液,醋酸所需加入的水多7. 把pH=3的H2SO4溶液和pH=10的NaOH溶液混合,两者恰好中和,则酸和碱的体积比应是( )A、10∶1 B、1∶10 C、1∶100 D、1∶28. 下列事实不属于盐类水解应用的是( )A、明矾净水 B、使用热的纯碱溶液去除油污 C、实验室配制FeCl3溶液时加入少量稀盐酸 D、向FeCl3溶液中加入NaOH溶液产生红褐色沉淀9. 常温下,盐酸与氨水混合,所得溶液pH=7,则此溶液中的关系正确的是( )A、c(NH4+)<c(Cl-) B、c(NH4+)=c(Cl-) C、c(NH4+)>c(Cl-) D、无法确定c(NH4+)与c(Cl-)10. HA为酸性略强于醋酸的一元弱酸,在0.1 mol·L-1 NaA溶液中,离子浓度关系正确的是( )A、c(Na+)>c(A-)>c(H+)>c(OH-) B、c(Na+)>c(OH-)>c(A-)>c(H+) C、c(Na+)+ c(OH-)= c(A-)+ c(H+) D、c(Na+)+ c(H+) = c(A-)+ c(OH-)11. 将下列物质的溶液在蒸发皿中加热蒸干并灼烧(400℃),可以得到该物质的固体的是( )A、AlCl3 B、NaHCO3 C、MgSO4 D、KMnO412. 实验室在配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀硫酸中,再加水稀释至所需浓度,如此操作的目的是( )A、防止硫酸铁分解 B、抑制硫酸铁水解 C、提高硫酸铁的溶解度 D、提高溶液的pH13. 在下列给定条件的溶液中,一定能大量共存的离子组是( )A、无色溶液:Ca2+、H+、Cl-、HSO3- B、能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- C、FeCl3溶液:K+、Na+、SO42-、AlO2- D、常温下, Kw/c(H+)=0.1 mol·L-1的溶液:Na+、K+、SiO32-、NO3-14. 有关原电池的下列说法中正确的是( )A、在外电路中电子由正极流向负极 B、在原电池中负极发生还原反应 C、阳离子向正极方向移动 D、原电池中正极一定是不活泼金属15. 下列装置中,能构成原电池的是( )A、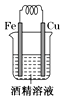 B、
B、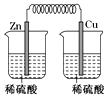 C、
C、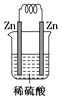 D、
D、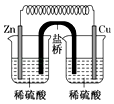 16. 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
16. 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )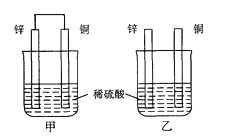 A、两烧杯中铜片表面均无气泡产生 B、甲中铜片是正极,乙中铜片是负极 C、两烧杯中溶液的pH均增大 D、产生气泡的速度甲比乙慢17. 下列说法中,错误的是( )A、化学电池是将化学能转变成电能的装置 B、化学电池的种类包括一次电池、二次电池和燃料电池等 C、化学电池供能稳定可靠,可以制成各种形状和大小,使用方便,易于维护 D、废旧电池可以随意丢弃18. 关于铅蓄电池的说法正确的是( )。A、在放电时,正极发生的反应是Pb(s)+SO42-(aq)-2e-=PbSO4(s) B、在放电时,该电池的负极材料是铅板 C、在充电时,电池中硫酸的浓度不断变小 D、在充电时,阳极发生的反应是PbSO4(s)+2e-=Pb(s)+SO42-(aq)19. 下列关于电解池的叙述中错误的是( )A、与电源正极相连的是电解池的阴极 B、与电源负极相连的是电解池的阴极 C、在电解池的阳极发生氧化反应 D、电子从电源的负极沿导线流入电解池的阴极20. 若要在铜片上镀银时,下列叙述错误的是( )
A、两烧杯中铜片表面均无气泡产生 B、甲中铜片是正极,乙中铜片是负极 C、两烧杯中溶液的pH均增大 D、产生气泡的速度甲比乙慢17. 下列说法中,错误的是( )A、化学电池是将化学能转变成电能的装置 B、化学电池的种类包括一次电池、二次电池和燃料电池等 C、化学电池供能稳定可靠,可以制成各种形状和大小,使用方便,易于维护 D、废旧电池可以随意丢弃18. 关于铅蓄电池的说法正确的是( )。A、在放电时,正极发生的反应是Pb(s)+SO42-(aq)-2e-=PbSO4(s) B、在放电时,该电池的负极材料是铅板 C、在充电时,电池中硫酸的浓度不断变小 D、在充电时,阳极发生的反应是PbSO4(s)+2e-=Pb(s)+SO42-(aq)19. 下列关于电解池的叙述中错误的是( )A、与电源正极相连的是电解池的阴极 B、与电源负极相连的是电解池的阴极 C、在电解池的阳极发生氧化反应 D、电子从电源的负极沿导线流入电解池的阴极20. 若要在铜片上镀银时,下列叙述错误的是( )①将铜片接在电源的正极 ②将银片接在电源的正极 ③在铜片上发生的反应是:Ag+ +e-=Ag ④在银片上发生的反应是:4OH- - 4e-=O2 +2H2O ⑤可用硫酸溶液作电解质 ⑥可用硝酸银溶液作电解质
A、①③⑥ B、②③⑥ C、①④⑤ D、②③④⑥21. 下列关于平衡常数K的说法中,正确的是( )A、在任何条件下,化学平衡常数是一个恒定值 B、改变反应物浓度或生成物浓度都会改变平衡常数K C、平衡常数K只与温度有关,与反应浓度、压强无关 D、从平衡常数K的大小不能推断一个反应进行的程度22. 关于下列过程熵变的判断错误的是( )A、溶解少量食盐于水中,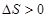 B、纯碳和氧气反应生成
B、纯碳和氧气反应生成 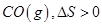 C、H2O(g)变成液态水,
C、H2O(g)变成液态水, 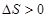 D、CaCO3(s)加热分解为CaO和CO2(g),
D、CaCO3(s)加热分解为CaO和CO2(g),  23. 下列能发生水解的粒子是( )A、HCl B、Na+ C、
23. 下列能发生水解的粒子是( )A、HCl B、Na+ C、 D、CH3COO-
24. 为了避免电解液中CuSO4因水解发生沉淀,正确的操作方法是( )A、稀释 B、加稀硫酸 C、加NaOH溶液 D、加热25. 在含有浓度均为0.01mol•L-1的Cl-、Br-、I-离子的溶液中,缓慢加入AgNO3稀溶液,析出三种沉淀的先后顺序是( )A、AgCl、AgBr、AgI B、AgI、AgBr、AgCl C、AgBr、AgCl、AgI D、三种沉淀同时析出
D、CH3COO-
24. 为了避免电解液中CuSO4因水解发生沉淀,正确的操作方法是( )A、稀释 B、加稀硫酸 C、加NaOH溶液 D、加热25. 在含有浓度均为0.01mol•L-1的Cl-、Br-、I-离子的溶液中,缓慢加入AgNO3稀溶液,析出三种沉淀的先后顺序是( )A、AgCl、AgBr、AgI B、AgI、AgBr、AgCl C、AgBr、AgCl、AgI D、三种沉淀同时析出二、填空题
-
26. 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答:
 (1)、“O”点导电能力为0的理由是(2)、a、
(1)、“O”点导电能力为0的理由是(2)、a、B、c三点处,溶液的c(H+)由小到大的顺序为。
(3)、a、B、c三点处,电离程度最大的是。
27.(1)、.向纯碱溶液中滴入酚酞溶液,①观察到的现象是 , 原因是(用离子方程式表示)。②若微热溶液,观察到的现象是 , 原因是。
(2)、.在一定温度下,向AgI的饱和溶液中:(填“增大”、“减小”或“不变”)① 若加入AgNO3固体,c(I-)。
② 若加入更多的AgI固体,则c(Ag+)。
28. 阿波罗宇宙飞船使用的是氢氧燃料电池,其电极反应为:2H2+4OH--4e-=4H2O O2+2H2O+4e-=4OH-(1)、在负极发生反应的物质是 , 负极发生的是(填“氧化”或“还原”)反应。(2)、在正极发生反应的物质是 , 正极发生的是(填“氧化”或“还原”)反应。电池总反应是。三、实验题
-
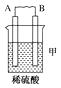
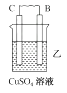
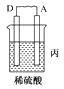
29. 由A、B、C、D四种金属按下表中装置进行实验。
装置
现象
二价金属A
不断溶解
C的质量增加
A上有气体产生
根据实验现象回答下列问题:
(1)、装置甲中负极的电极反应式是。(2)、装置乙中正极的电极反应式是。(3)、装置丙中溶液的pH(填“变大”“变小”或“不变”)。(4)、四种金属活动性由强到弱的顺序是。30. 某学习小组用0.80 mol/L标准浓度的烧碱溶液测定未知浓度的盐酸。 (1)、.滴定管如图所示,用滴定管盛装标准浓度的氢氧化钠溶液 (填“甲”或“乙”)。(2)、.用滴定的方法来测定盐酸的浓度,实验数据如下所示:
(1)、.滴定管如图所示,用滴定管盛装标准浓度的氢氧化钠溶液 (填“甲”或“乙”)。(2)、.用滴定的方法来测定盐酸的浓度,实验数据如下所示:实验编号
待测HCl溶液的体积/mL
滴入NaOH溶液的体积/mL
1
20.00
23.00
2
20.00
23.10
3
20.00
22.90
该实验中用去标准液的体积为mL。
(3)、.下列操作会使所测得的盐酸的浓度偏低的是________。A、盛装待测液的锥形瓶用水洗后未干燥 B、滴定前,碱式滴定管尖端有气泡,滴定后气泡消失 C、碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗 D、读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数(4)、.滴定过程中,眼睛应注视;在铁架台上垫一张白纸,其目的是;若用酚酞作指示剂,则判断达到滴定终点时的现象是。
(5)、.根据上表数据,计算被测盐酸的物质的量浓度是mol/L。(小数点后保留两位有效数字)