2018-2019学年粤教版化学九年级下册7.2物质溶解的量 同步训练
试卷更新日期:2019-01-15 类型:同步测试
一、单选题
-
1. 符合如图所示从属关系的是( )
选项
A
B
C
D
X
金属
溶液
浓溶液
氧化物
Y
单质
乳浊液
饱和溶液
空气
A、A B、B C、C D、D2. 如图是恒温下模拟海水晒盐过程的示意图,所表示溶液一定是不饱和溶液的是( ) A、甲 B、甲和乙 C、乙和丁 D、丁3. 下列有关饱和溶液的说法中,正确的是( )A、饱和溶液的浓度一定比不饱和溶液的浓 B、饱和溶液降温析出晶体后的溶液一定是不饱和溶液 C、任何饱和溶液升温后都会变成不饱和溶液 D、一定温度下,向氯化钠饱和溶液中加入水后会变成不饱和溶液4. 周末,感到有点饿的甲同学泡了一杯白糖开水,他用筷子充分搅拌杯中的白糖后,将杯子放在一边等待糖水变凉,喝糖水时,发现杯底有少量未溶解的白糖(如图所示)。下列操作或现象能说明糖水一定属于饱和溶液的是( )
A、甲 B、甲和乙 C、乙和丁 D、丁3. 下列有关饱和溶液的说法中,正确的是( )A、饱和溶液的浓度一定比不饱和溶液的浓 B、饱和溶液降温析出晶体后的溶液一定是不饱和溶液 C、任何饱和溶液升温后都会变成不饱和溶液 D、一定温度下,向氯化钠饱和溶液中加入水后会变成不饱和溶液4. 周末,感到有点饿的甲同学泡了一杯白糖开水,他用筷子充分搅拌杯中的白糖后,将杯子放在一边等待糖水变凉,喝糖水时,发现杯底有少量未溶解的白糖(如图所示)。下列操作或现象能说明糖水一定属于饱和溶液的是( ) A、泡糖水时进行了充分搅拌 B、糖水热的时候白糖全部溶解 C、凉的糖水底部有剩余的白糖 D、喝糖水时感到很甜5. 要将一瓶接近饱和的石灰水变成饱和溶液(已知生石灰能与水发生反应产生氢氧化钙),小明选择了如下方法。
A、泡糖水时进行了充分搅拌 B、糖水热的时候白糖全部溶解 C、凉的糖水底部有剩余的白糖 D、喝糖水时感到很甜5. 要将一瓶接近饱和的石灰水变成饱和溶液(已知生石灰能与水发生反应产生氢氧化钙),小明选择了如下方法。①加入生石灰②加入Ca(OH)2
③升高温度④降低温度
其中可行的是( )
A、②③ B、②④ C、①②③ D、①②④6. 如图是甲、乙两固体物质(不含结晶水)的溶解度曲线,下列说法错误的是( )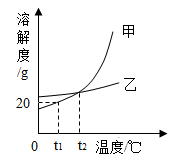
A、t1℃时,向50g水中加入10g甲,所得溶液可以达到饱和状态 B、采用升高温度的方法,可使乙的饱和溶波变为乙的不饱和溶液 C、甲中混有少量乙,可以采用冷却热的饱和溶液的方法提纯甲 D、t2℃时,将甲、乙两容液热发等质量的水。析出晶体质量一定相等7. A,B,C三种固体物质的溶解度曲线如图所示,下列说法正确的是( ) A、t1℃时,三种物质的溶解度由大到小的顺序是A>B>C B、t2℃时,A和C的溶解度相等 C、将B的饱和溶液变为不饱和溶液可采用升高温度的方法 D、A,B,C三种物质的溶解度都随温度的升高而增大8. 20℃时,氯化钠的溶解度为36g,则饱和氯化钠溶液中溶质、溶剂、溶液的质量比为( )
A、t1℃时,三种物质的溶解度由大到小的顺序是A>B>C B、t2℃时,A和C的溶解度相等 C、将B的饱和溶液变为不饱和溶液可采用升高温度的方法 D、A,B,C三种物质的溶解度都随温度的升高而增大8. 20℃时,氯化钠的溶解度为36g,则饱和氯化钠溶液中溶质、溶剂、溶液的质量比为( )
A、1:1:2 B、1:5:6 C、9:16:25 D、9:25:349. 常温时打开汽水瓶,可以看到许多气泡冒出,这是因为( )A、温度降低,二氧化碳在水中的溶解能力减弱 B、温度升高,二氧化碳在水中的溶解能力减弱 C、压强降低,二氧化碳在水中的溶解能力减弱 D、压强升高,二氧化碳在水中的溶解能力减弱二、填空题
-
10. 某温度下,有一种接近饱和的硝酸钾溶液,可以用; ; 的方法使之成为饱和溶液。11. 已知蔗糖的溶解度随温度升高而变大。现在20℃下用蔗糖进行如下图所示的实验,该蔗糖溶液(填“一定”或“不一定”)是饱和溶液,若要让试管中的蔗糖固体全部溶解,下列办法不可行的是(填序号)。

①试管内加入适量水 ②烧杯内加入适量氢氧化钠固体
③烧杯内加入适量生石灰 ④烧杯内加入适量硝酸铵固体
12. 如图是甲乙两种固体物质的溶解度曲线图。请你根据图示回答问题: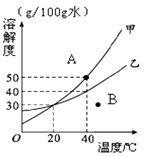
①甲和乙的溶解度相等时,温度为 ℃;
② 40 ℃时,将相同质量的甲、乙的饱和溶液,分别降温至20℃,析出晶体较多的是 ;
③ 40℃时,要完全溶解60 g乙得到饱和溶液,需要水 g;
④ A、B两点是甲物质的两种不同状态的溶液,要实现A到B的转化方法是。
13. 甲、乙、丙三种物质在水中形成的饱和溶液溶质质量分数随温度变化如下图所示,请回答下列问题: (1)、25℃时,甲物质中的溶解度为g(答案保留一位小数);(2)、从乙溶液中获得乙晶体的方法是(填“蒸发结晶”或“降温结晶”)。(3)、将50℃甲的饱和溶液降温至25℃,溶液为(填“饱和溶液”或“不饱和溶液”)。(4)、气体的溶解度随温度的变化规律与(填“甲”、“乙”或“丙”)相似。
(1)、25℃时,甲物质中的溶解度为g(答案保留一位小数);(2)、从乙溶液中获得乙晶体的方法是(填“蒸发结晶”或“降温结晶”)。(3)、将50℃甲的饱和溶液降温至25℃,溶液为(填“饱和溶液”或“不饱和溶液”)。(4)、气体的溶解度随温度的变化规律与(填“甲”、“乙”或“丙”)相似。三、综合题
-
14. 根据下表数据,回答下列问题.
温度/℃
10
20
30
40
50
60
70
80
90
溶解度/g
KCl
31.0
34.0
37.0
40.0
42.6
45.5
48.3
51.1
54.0
KNO3
20.9
31.6
45.8
53.9
85.5
110
138
160
202
(1)、KCl 和 KNO 3 中,溶解度受温度影响较小的是;(2)、30℃时,KCl 饱和溶液中,KCl 和 H 2 O 的质量比为;(3)、将200gKNO 3 和 2gKCl 的混合物,投入到 100g90℃的水中完全溶解,再降温至 20℃,析出晶体的化学式为 .15. 以饱和NaCl溶液和饱和NH4HCO3溶液为原料制备NaHCO3的原理为:NaCl+NH4HCO3=NaHCO3↓+NH4Cl。(已知NH4HCO3在40℃受热易分解)回答下列问题:(1)、该反应中的几种物质溶解度曲线如图所示:
①35℃时,比较A、B溶解度的大小:AB(填“<”或“>”)。
②图中表示NaHCO3溶解度曲线的是(填“A”或“B”) 。
(2)、为探究NaHCO3析出的最佳条件,完成了如图几组实验实验序号
反应温度/℃
反应时间/min
NaHCO3产率/%
a
30
60
86.8
b
30
120
X
c
35
60
89.4
d
35
120
92.5
e
40
60
85.3
f
40
120
85.6
①实验c和d的目的是。
②表格中X的数值可能为。
A.85.8
B.86.8
C.92.1
D.93.1
③在相同反应时间,40℃时NaHCO3的产率比35℃时低的原因是。