浙江省乐清市2017-2018学年九年级上学期科学9月月考试卷(实验班)
试卷更新日期:2019-01-07 类型:月考试卷
一、选择题
-
1. 下列变化中属于物理变化的是 ( )A、氢气燃烧 B、菜刀生锈 C、冰雪熔化 D、电解水2. 我市对生活垃圾已经实施分类投放,金属饮料罐应投放在标有哪种标志的垃圾箱中 ( )A、
 可回收废物
B、
可回收废物
B、 有害垃圾
C、
有害垃圾
C、 厨房垃圾
D、
厨房垃圾
D、 其它垃圾
3. 科学实验必须按规范进行操作,下列实验操作中规范的是 ( )A、取少 量氯化钠
其它垃圾
3. 科学实验必须按规范进行操作,下列实验操作中规范的是 ( )A、取少 量氯化钠 B、闻药品气味
B、闻药品气味  C、滴加液体
C、滴加液体  D、稀释浓硫酸
D、稀释浓硫酸  4. 我国是世界上发现、利用金属锑(Sb)较早的国家之一,目前锑的产量位居世界第一。冶炼金属锑的过程中,发生的反应为:2Sb2O3+3C 4Sb+3CO2↑。该反应的类型为( )A、分解反应 B、化合反应 C、复分解反应 D、置换反应5. 如图所示是蹦床运动员表演的情景,运动员从最低点到达最高点的过程中,运动员的动能和重力势能变化情况分别是( )
4. 我国是世界上发现、利用金属锑(Sb)较早的国家之一,目前锑的产量位居世界第一。冶炼金属锑的过程中,发生的反应为:2Sb2O3+3C 4Sb+3CO2↑。该反应的类型为( )A、分解反应 B、化合反应 C、复分解反应 D、置换反应5. 如图所示是蹦床运动员表演的情景,运动员从最低点到达最高点的过程中,运动员的动能和重力势能变化情况分别是( ) A、动能减小,重力势能增大 B、动能增大,重力势能减小 C、动能先增大后减小,重力势能增大 D、动能先减小后增大,重力势能减小6. 下列实验方案或措施不合理的是( )A、用浓硫酸干燥氢气 B、用氯化钡溶液鉴别稀硫酸和稀盐酸 C、用酚酞试液检验氢氧化钠溶液是否变质 D、用稀盐酸除去盛过石灰水的试剂瓶内壁上的碳酸钙7. 四个同学进行登山比赛,如果规定功率最大者获胜,那么最终胜出者一定是 ( )A、体重最大的一个 B、时间最短的一个 C、速度最大的一个 D、做功最快的一个8. 把研究工作视为游戏是2010年诺贝尔物理学奖得主海姆及其团队的特别之处。他们发现的新材料石墨烯有许多奇特的属性:密度小、硬度大、柔软、可回收,有优良的导电性、导热性及抗拉伸能力,它也将会代替现有的硅材料。根据石墨烯的属性,下列不能用石墨烯来制造的是 ( )A、新型半导体材料 B、优良的绝缘材料 C、超轻型飞机材料 D、新型防弹衣材料9. 硫酸铜溶液能用于植物灭菌治病。配制好的溶液,若用铁制容器盛放,铁制容器内壁上会产生一层红色物质。下列解释和结论正确的是 ( )A、铁的表面被腐蚀了,使铁生锈,该红色物质是铁锈 B、铁的金属活动性比铜强,铁置换出铜,红色物质是铜 C、铁与硫酸铜发生了置换反应,红色物质是铁锈 D、铁与硫酸铜发生了复分解反应,红色物质是铜。10. 建立宏观和微观之间的联系是一种科学的思维方式。下列对宏观事实的微观解释不正确的是( )A、白色的无水硫酸铜遇水变蓝色,是因为CuSO4遇H2O转化为CuSO4·5H2O B、警用缉毒犬能根据气味发现毒品,是因为分子在不断运动 C、5mL酒精和5mL水混合后体积小于10mL,是因为混合过程中分子变小了 D、不同种酸的化学性质有所不同,与酸电离生成的阴离子不同有关11. 向一定质量CaCl2和HCl的混合溶液中,逐滴加入Na2CO3溶液。反应过程中产生气体或沉淀的质量与加入的Na2CO3溶液的质量关系如图。下列说法错误的是( )
A、动能减小,重力势能增大 B、动能增大,重力势能减小 C、动能先增大后减小,重力势能增大 D、动能先减小后增大,重力势能减小6. 下列实验方案或措施不合理的是( )A、用浓硫酸干燥氢气 B、用氯化钡溶液鉴别稀硫酸和稀盐酸 C、用酚酞试液检验氢氧化钠溶液是否变质 D、用稀盐酸除去盛过石灰水的试剂瓶内壁上的碳酸钙7. 四个同学进行登山比赛,如果规定功率最大者获胜,那么最终胜出者一定是 ( )A、体重最大的一个 B、时间最短的一个 C、速度最大的一个 D、做功最快的一个8. 把研究工作视为游戏是2010年诺贝尔物理学奖得主海姆及其团队的特别之处。他们发现的新材料石墨烯有许多奇特的属性:密度小、硬度大、柔软、可回收,有优良的导电性、导热性及抗拉伸能力,它也将会代替现有的硅材料。根据石墨烯的属性,下列不能用石墨烯来制造的是 ( )A、新型半导体材料 B、优良的绝缘材料 C、超轻型飞机材料 D、新型防弹衣材料9. 硫酸铜溶液能用于植物灭菌治病。配制好的溶液,若用铁制容器盛放,铁制容器内壁上会产生一层红色物质。下列解释和结论正确的是 ( )A、铁的表面被腐蚀了,使铁生锈,该红色物质是铁锈 B、铁的金属活动性比铜强,铁置换出铜,红色物质是铜 C、铁与硫酸铜发生了置换反应,红色物质是铁锈 D、铁与硫酸铜发生了复分解反应,红色物质是铜。10. 建立宏观和微观之间的联系是一种科学的思维方式。下列对宏观事实的微观解释不正确的是( )A、白色的无水硫酸铜遇水变蓝色,是因为CuSO4遇H2O转化为CuSO4·5H2O B、警用缉毒犬能根据气味发现毒品,是因为分子在不断运动 C、5mL酒精和5mL水混合后体积小于10mL,是因为混合过程中分子变小了 D、不同种酸的化学性质有所不同,与酸电离生成的阴离子不同有关11. 向一定质量CaCl2和HCl的混合溶液中,逐滴加入Na2CO3溶液。反应过程中产生气体或沉淀的质量与加入的Na2CO3溶液的质量关系如图。下列说法错误的是( )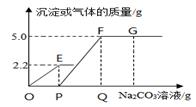 A、OE段发生的化学反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑ B、PF段有沉淀生成 C、G点溶液的pH >7 D、反应过程有气体和沉淀生成,不遵循质量守恒定律12. 除去下列各物质中混有的少量杂质,所用试剂正确的是( )
A、OE段发生的化学反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑ B、PF段有沉淀生成 C、G点溶液的pH >7 D、反应过程有气体和沉淀生成,不遵循质量守恒定律12. 除去下列各物质中混有的少量杂质,所用试剂正确的是( )序号
物质
杂质
所用试剂
A
氢气
氯化氢
氢氧化钠溶液
B
二氧化硫
水
碱石灰
C
氧化钙
碳酸钙
适量的稀盐酸
D
氢氧化钠
碳酸钠
适量的氯化钡溶液
A、A B、B C、C D、D13. 金属腐蚀的快慢与外界条件密切相关。下列条件下,铁钉的腐蚀速度最快的是( )A、 B、
B、 C、
C、 D、
D、 14. 在台球比赛中,选手推动球杆撞击白球。白球发生运动后碰撞其它球。以下说法正确的是 ( )
14. 在台球比赛中,选手推动球杆撞击白球。白球发生运动后碰撞其它球。以下说法正确的是 ( ) A、在水平桌面滚动的球受到了重力,重力对它做了功 B、手推动球杆前进时,手对球杆做了功 C、桌面对球的支持力做了功 D、白球撞击黑球后没有静止,是因为人的手还在对白球做功15. 向一定质量的甲中逐渐加入乙至过量,此过程中溶液的溶质总质量与加入乙的质量之间的关系,能用如图曲线表示的是 ( )
A、在水平桌面滚动的球受到了重力,重力对它做了功 B、手推动球杆前进时,手对球杆做了功 C、桌面对球的支持力做了功 D、白球撞击黑球后没有静止,是因为人的手还在对白球做功15. 向一定质量的甲中逐渐加入乙至过量,此过程中溶液的溶质总质量与加入乙的质量之间的关系,能用如图曲线表示的是 ( )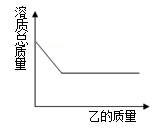
甲
乙
A
稀硫酸
氢氧化钠溶液
B
稀盐酸
碳酸钙粉末
C
稀盐酸
锌粒
D
硝酸银溶液
铜粉
A、A B、B C、C D、D二、填空题
-
16. 如图所示,一个静止小球从A点沿粗糙程度相同的轨道下滑,经B点到达C点,从A点到达C点的过程中,小球的动能;小球的重力势能;小球的机械能。(选填序号)
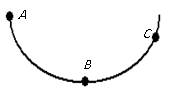
①保持不变; ②一直减小; ③先增大后减小
④一直增大; ⑤先减小后增大
17. 我国国务院在2000年2月批准启动“西气东输”工程,这是我国的一项重大工程,其中“气”是指天然气,主要成分为甲烷CH4.(1)、如图,集气瓶里盛有甲烷,U形管左右液面相平,将整个装置放置在阳光之下一定时间,液面 , 再将该装置放入黑暗中,若观察到液面仍保持原状,即可证明甲烷是气体. (2)、天然气管道在第一次输送到用户家里时必须先在管道内充满氮气,这样做的原因是 .18. 皮蛋是我国传统风味食品,制作皮蛋的方法有多种,一种制作含锌皮蛋的方法是把鸭蛋放在培养液中浸泡,培养液由水、食盐、氢氧化钠、少量硫酸锌等物质配制而成。(1)、取少量培养液于试管中,滴入无色酚酞溶液后变红,则培养液的pH7(填“<”、“>”或“=”)(2)、在(1)的试管中滴加过量稀硫酸,红色褪去,发生反应的化学方程式为:(3)、在(2)所得的溶液中加入一种盐溶液产生了沉淀,该盐不可能是 ( )A、BaCl2 B、CuSO4 C、AgNO3 D、KNO319. 在里约奥运会上,在男子跳远比赛中中国队也实现了奖牌零的突破,董斌为中国队获得了一块宝贵的铜牌,跳远运动的几个阶段如图所示,运动员到达最高点时的动能(“为0”或“不为0”),解释原因。
(2)、天然气管道在第一次输送到用户家里时必须先在管道内充满氮气,这样做的原因是 .18. 皮蛋是我国传统风味食品,制作皮蛋的方法有多种,一种制作含锌皮蛋的方法是把鸭蛋放在培养液中浸泡,培养液由水、食盐、氢氧化钠、少量硫酸锌等物质配制而成。(1)、取少量培养液于试管中,滴入无色酚酞溶液后变红,则培养液的pH7(填“<”、“>”或“=”)(2)、在(1)的试管中滴加过量稀硫酸,红色褪去,发生反应的化学方程式为:(3)、在(2)所得的溶液中加入一种盐溶液产生了沉淀,该盐不可能是 ( )A、BaCl2 B、CuSO4 C、AgNO3 D、KNO319. 在里约奥运会上,在男子跳远比赛中中国队也实现了奖牌零的突破,董斌为中国队获得了一块宝贵的铜牌,跳远运动的几个阶段如图所示,运动员到达最高点时的动能(“为0”或“不为0”),解释原因。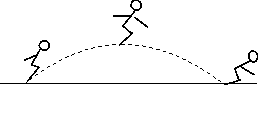 20. 为了在明年的体育考试中取得好成绩,小科同学在认真准备着。(1)、在某次跳绳训练中,他1min跳了180次。若他的质量为40kg,每次跳起的平均高度为5厘米,则他跳绳时的功 率是W。(2)、他第一次去学习游泳时发现,泳池中的水看上去似乎有点蓝色,而必经之路上还有一个小水池,里面的水似乎有点紫红色。教练告诉他,这里面分别加入了两种小科同学学过的盐,它们均有一定的杀菌消毒作用。请你根据所学知识帮助小科判断这两种盐的成分是。21. 为了验证铁、铜、银的金属活动性顺序,设计了如下实验:
20. 为了在明年的体育考试中取得好成绩,小科同学在认真准备着。(1)、在某次跳绳训练中,他1min跳了180次。若他的质量为40kg,每次跳起的平均高度为5厘米,则他跳绳时的功 率是W。(2)、他第一次去学习游泳时发现,泳池中的水看上去似乎有点蓝色,而必经之路上还有一个小水池,里面的水似乎有点紫红色。教练告诉他,这里面分别加入了两种小科同学学过的盐,它们均有一定的杀菌消毒作用。请你根据所学知识帮助小科判断这两种盐的成分是。21. 为了验证铁、铜、银的金属活动性顺序,设计了如下实验:Ⅰ.将铁片浸入稀硫酸 Ⅱ.将铜片浸入称硫酸 Ⅲ.将铁片浸入硝酸银溶液
(1)、上述实验(选填“能”或“不能”)验证三种金属的活动性顺序。(2)、将铁、铜、银三种金属浸入溶液(只填一种),即可验证它们的活动性顺序。22. 物质的结构决定性质,性质反映结构,据此回答.(1)、稀盐酸(HCl)和稀硫酸(H2SO4)具有相似的化学性质,原因是它们在电离时都产生了 .(2)、稀盐酸和稀硫酸都是无色透明的液体,为鉴别它们,小柯设计了如下图四种方案(每种方案的两支试管中事先分别加入等量的上述两种酸),其中可行的方案有 23. 科学兴趣小组做碳还原金属氧化物实验后,收集到CO和CO2的混合废气,考虑到废气直接排放会污染环境,想把废气初步分离回收再利用.用如图所示的装置进行分离实验(收集装置略去).
23. 科学兴趣小组做碳还原金属氧化物实验后,收集到CO和CO2的混合废气,考虑到废气直接排放会污染环境,想把废气初步分离回收再利用.用如图所示的装置进行分离实验(收集装置略去).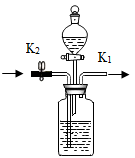 (1)、广口瓶中加入的是 .A、NaOH溶液 B、NaCl溶液 C、Ca(OH)2溶液(2)、打开阀门K2通入混合气体,首先分离得到气体,接着关闭阀门K2打开阀门K1 , 将分液漏斗中装的溶液滴入广口瓶中,在广口瓶中看到有气泡产生,从而分离出第二种气体.
(1)、广口瓶中加入的是 .A、NaOH溶液 B、NaCl溶液 C、Ca(OH)2溶液(2)、打开阀门K2通入混合气体,首先分离得到气体,接着关闭阀门K2打开阀门K1 , 将分液漏斗中装的溶液滴入广口瓶中,在广口瓶中看到有气泡产生,从而分离出第二种气体.三、实验探究题
-
24. 学习了“物体的动能与什么因素有关”的实验后,小军开展了如图甲的实验:
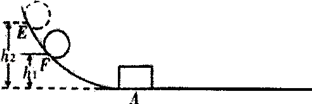
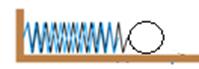
步骤一:让铁球甲从斜面E点静止滚下,打到A处木块,推动木块;
步骤二:让铁球甲从斜面F点滚下,打到A处相同的木块,推动木块;
步骤三:换一铁球乙(m乙>m甲)从斜面上F点静止滚下,打到A处相同的木块,推动木块。
(1)、铁球动能的大小事通过(选填:“木块移动的距离S”或“铁球的高度h”)来反应,这种研究方法叫转换法。(2)、实际操作中,小军发现几次木块并未发生移动,对此你建议的改进方法。(3)、为了让质量不同的甲、乙两球获得相同的初速度,有同学认为可以不用让两球都从E点滚下,而是设计了如图乙装置,只要每次让两球压缩弹簧到同样的形变程度后自然释放即可。不考虑各种能量损耗,该方法(合理/不合理),请说明理由。25. 将一定量的稀HCl加入到盛有NaOH溶液的烧杯中,未观察到明显现象。对“反应后溶液中的溶质是什么?”同学们提出了以下的猜想:猜想一:只有NaCl; 猜想二:有NaCl和HCl; 猜想三:有NaCl和NaOH
为探究溶质的成分,他们进行以下实验:
(1)、取烧杯中的少量溶液于试管中,滴加几滴CuSO4溶液,无明显变化,则溶液中一定没有的成分是。(2)、他们选用了pH试纸、AgNO3溶液、Na2CO3溶液,继续进行下面的实验:实验方案
测溶液pH
滴加Na2CO3溶液
滴加AgNO3溶液
实验操作



实验现象
试纸变色,对比比色卡,pH<7
有气泡产生
产生白色沉淀
实验结论
溶液中有HCl
溶液中有HCl
溶液中有HCl
根据上述实验结果,同学们得出猜想是正确。
(3)、评价反思:反思发现在上表中的实验操作,存在一处明显错误,该错误操作是;有同学对上表中的某一实验所得出结论也有异议,理由。26. “一般不用K、Ca、Na等活泼金属来置换盐溶液中的其他金属元素”,这是教科书上的一句话。小科对此进行了思考,并查阅资料,对金属钠和硫酸铜溶液的反应进行探究。【查阅资料】钠常温下就能与水发生剧烈反应,反应方程式为:2Na +2H2O====2NaOH +H2↑。
【提出猜想】猜想一:金属钠和硫酸铜溶液反应会有铜生成。
实验编号
钠块大小
硫酸铜溶液
实验中产生沉淀的现象
①
绿豆大小
稀溶液10mL
产生蓝绿色沉淀
②
绿豆大小
浓溶液10mL
产生蓝色絮状沉淀
③
豌豆大小
稀溶液10mL
产生蓝色絮状沉淀
④
豌豆大小
浓溶液10mL
产生蓝色絮状沉淀,并出现黑色固体
猜想二:金属钠和硫酸铜溶液反应,生成的沉淀只有氢氧化铜。
【实验及现象】切取不同大小的钠块分别投入到两种不同浓度的硫酸铜溶液中,有关产生沉淀的现象如下表所示。
小科咨询老师后得知蓝绿色沉淀为碱式铜盐。
(1)、【实验结论】⑴上述实验中均未观察到色固体生成,由此判断猜想一错误;⑵实验①中观察到的沉淀是蓝绿色的,由此判断猜想二也错误。
(2)、【实验反思】(1)实验中生成氢氧化铜沉淀的原理是。(3)、由上述实验可知,导致钠和硫酸铜溶液反应的产物不同的因素有.(4)、为了用钠置换硫酸铜中的铜元素,小科设计了如下实验方案:方案一:把钠块和无水硫酸铜直接混合,在干燥的空气中加热。
方案二:把钠块和无水旒酸铜直接混合,隔绝空气加热。
请从两个方案中选出合理的方案,并说明理由。.
四、解答题
-
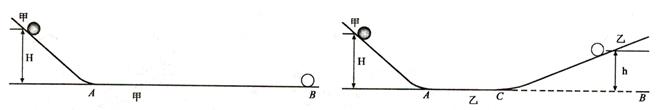
27. 光滑斜面甲与水平面AB平滑连接。从斜面甲高H处静止释放小球,小球运动到B点静止,如图甲。在 AB上的C点平滑拼接另一光滑斜面乙,已知AB=3 AC,如图乙。回答下列问题:如果小球从斜面甲高H处静止释放,说明小球在乙斜面到达的最大高度h与H的数量关系及理由。
 28. 乐清某蔬菜基地在种植蔬菜时,常采用下列方法。(1)、施用适量的氮肥可以使种植的蔬菜叶色浓绿。
28. 乐清某蔬菜基地在种植蔬菜时,常采用下列方法。(1)、施用适量的氮肥可以使种植的蔬菜叶色浓绿。①下列化肥中,属于氮肥的是。(填字母)
A.碳酸氢铵[NH4HCO3] B.草木灰(主要成分[K2CO3] C.磷矿粉[Ca3(P04)2]
②草木灰呈碱性,你认为它(“能”或“不能”)与所选的氮肥混合施用,理由是。
(2)、用大棚种植蔬菜时,常向大棚中补充气体肥料CO2。①目的是促进绿色植物的光合作用。
②若提供的气体肥料CO2中混有少量的SO2 , 为了除去SO2 , 现设计以下两种方法。
甲方法:将气体通过足量的碳酸氢钠溶液。乙方法:将气体通过足量的氢氧化钠溶液。
【提供资料】 :
I.CO2与NaHCO3不会发生反应。 Ⅱ.SO2+2NaHCO3==Na2SO3+H2O+2CO2
Ⅲ.SO2+2Na0H==Na2SO3+H2O
请你利用提供的资料和所学的知识分析:上述方法(填“甲”或“乙”)可行,理由是.
29. 重15000牛的小汽车受到发动机800牛的牵引力作用,在水平地面上做匀速直线运动,其路程随时间变化如图所示。求: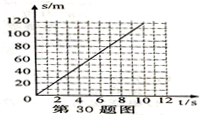 (1)、10秒内重力对小汽车做的功。(2)、10秒内发动机对小汽车做的功和发动机的功率。30. 某课外活动小组的同学将16克氧化铜和过量的炭粉均匀混合,用如图1所示装置进行实验.图中铁架台等装置已略去.请回答有关问题:
(1)、10秒内重力对小汽车做的功。(2)、10秒内发动机对小汽车做的功和发动机的功率。30. 某课外活动小组的同学将16克氧化铜和过量的炭粉均匀混合,用如图1所示装置进行实验.图中铁架台等装置已略去.请回答有关问题: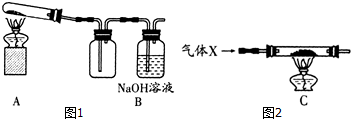
(1)、实验中最多能得到铜克.
(2)、同学们想通过测定消耗碳、氧元素的质量和生成二氧化碳的质量,以进一步分析氧化铜和炭粉反应产生的气体除CO2外是否还有其它产物.反应一段时间后停止加热,冷却到室温.反应前.后测得的数据如下:装置
反应前
反应后
A
试管的质量36.2 克
氧化铜和炭粉混合物的质量20.0克
试管和固体物质的质量54.8 克
B
反应后瓶内液体比反应前增重1.1 克
分析数据发现,反应中消耗碳和氧元素的质量(填“大于”或“小于”或“等于”)生成二氧化碳的质量. 下列4项中跟这一结果有关的有哪几项? .(填编号)
A.装置中还有一部分CO2未被NaOH溶液吸收 B.氧化铜和炭粉反应产生的气体除CO2外还有CO
C.氧化铜和炭粉没有完全反应 D.该反应不符合质量守恒定律
(3)、有同学认为用图2所示装置C代替上面的装置A,加热前先通一会气体X,停止加热后再通一会该气体,这样可使实验测得的数据更能准确的说明问题.你认为在O2、N2和H2三种气体中,X应选择哪一种气体 ?。31. 调味剂的主要作用是补充、增强或增加食品的味道.食醋是一种能增强食品酸味的调味剂,主要成分为醋酸(CH3COOH),与我们生活密切相联.根据所学知识回答:(1)、食醋的酸味能促进人胃酸的分泌,胃酸的成分是 (填化学式)。(2)、食醋能软化鱼骨和鸡蛋壳,原因是醋酸能与 (填化学式)反应。(3)、若NaOH溶液溅到皮肤上,应用水冲洗后,再用食醋清洗.清洗过程中发生反应的化学方程式为 。(4)、生活中常用酒来制取食醋,原理是酒中的CH3CH2OH在酶的作用下与空气中O2反应得到醋酸和另一种液体.已知在用酒制取食醋过程中,质量增加了16kg,则所得食醋中醋酸的质量为kg。32. 铝箔是现代生活中常见的包装材料,放置久了,其银白色光泽会变暗淡,故又称假银箔。(1)、小柯用放置很久的铝箔与稀盐酸反应,产生氢气质量和反应时间关系如图所示。在0~t1时间段内,铝箔表面看不到明显的气泡,原因是。在t2~t3时间段产生气泡的速度逐渐放缓,直到反应停止时,铝箔还有大量剩余。t2~t3时间段产生气泡速度放缓的原因是。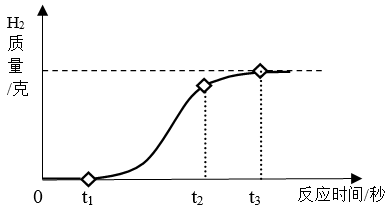 (2)、为进一步测量铝箔中单质铝的质量分数,小柯取1.9克铝箔样品与50.0克稀盐酸充分反应(2Al+6HCl=2AlCl3+3H2↑),铝箔完全溶解后剩余溶液的总质量为51.7克。计算样品中单质铝的质量分数。
(2)、为进一步测量铝箔中单质铝的质量分数,小柯取1.9克铝箔样品与50.0克稀盐酸充分反应(2Al+6HCl=2AlCl3+3H2↑),铝箔完全溶解后剩余溶液的总质量为51.7克。计算样品中单质铝的质量分数。