浙江省宁波市2018-2019学年九年级上学期科学教学质量检测(一)
试卷更新日期:2019-01-07 类型:月考试卷
一、选择题
-
1. 下列各组物质的名称、俗称、化学式表示同一种物质的是( )A、氢氧化钠 纯碱 Na2CO3 B、氯化钠 食盐 NaCl C、硫酸铜晶体 胆矾 CuSO4 D、碳酸钙 生石灰 Ca(OH)22. 为庆祝建军 90 周年,我国在内蒙古朱日举行了大阅兵。期间有多种新型战机接受检阅,特别是歼 20 战斗机的首次亮相备受瞩目。据悉,歼 20 战斗机的机身使用了钛合金等多种特殊材料。关于金属“钛”,下列说法错误的是( )A、钛合金是金属钛和其他金属(或非金属)经高温熔合而成的物质,是一种化合物 B、钛合金能承受剧烈的温差考验,可适应战斗机在不同温度大气层高速飞行 C、金属钛密度高于铝低于铁、铜等金属,可减少战斗机的自重 D、包括军事在内,金属钛在各领域中的应用越来越广泛,可能跃居为除铁和铝之外的“第三金属”3. 如图是汽车“尾气催化转换器”中将尾气中有毒气体转变为无毒气体的微观示意图。下列说法中不正确的是( )
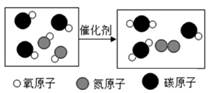
 A、分子在化学变化中可以再分 B、原子在化学变化中是不可再分的 C、图中参加反应的两种物质的分子个数比为 3∶2 D、该反应中生成两种物质4. 不用指示剂,将含有盐酸的氯化钙溶液由酸性变为中性,应选用的试剂是( )A、澄清石灰水 B、硝酸银溶液 C、生石灰粉末 D、石灰石5. 下列离子能在 pH=1 的溶液中大量共存的是( )A、Ag+、
A、分子在化学变化中可以再分 B、原子在化学变化中是不可再分的 C、图中参加反应的两种物质的分子个数比为 3∶2 D、该反应中生成两种物质4. 不用指示剂,将含有盐酸的氯化钙溶液由酸性变为中性,应选用的试剂是( )A、澄清石灰水 B、硝酸银溶液 C、生石灰粉末 D、石灰石5. 下列离子能在 pH=1 的溶液中大量共存的是( )A、Ag+、 -、Cl-、Na+
B、OH-、K+、
-、Cl-、Na+
B、OH-、K+、  、Ba2+
C、Mg2+、
、Ba2+
C、Mg2+、  、Al3+、
、Al3+、  D、Na+、
D、Na+、  、Ca2+、Cl-
6. 根据下列实验得出的结论,正确的是( )A、某固体加入稀盐酸,产生了无色气体,证明该固体一定含有
、Ca2+、Cl-
6. 根据下列实验得出的结论,正确的是( )A、某固体加入稀盐酸,产生了无色气体,证明该固体一定含有 B、某溶液中滴加 BaCl2 溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定有
B、某溶液中滴加 BaCl2 溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定有  C、某无色溶液滴入酚酞溶液后显红色,该溶液不一定是碱溶液
D、验证某烧碱样品中是否含有 Cl- , 先加入稀盐酸除去 OH- , 再加入 AgNO3 溶液,有不溶于稀硝酸的白色沉淀出现,证明含有 Cl-
7. 下列变化过程中,没有新物质生成的是( )A、稀释浓硫酸
C、某无色溶液滴入酚酞溶液后显红色,该溶液不一定是碱溶液
D、验证某烧碱样品中是否含有 Cl- , 先加入稀盐酸除去 OH- , 再加入 AgNO3 溶液,有不溶于稀硝酸的白色沉淀出现,证明含有 Cl-
7. 下列变化过程中,没有新物质生成的是( )A、稀释浓硫酸 B、镁带燃烧
B、镁带燃烧  C、电解水
C、电解水  D、火药爆炸
D、火药爆炸  8. 如图所示、广口瓶中盛有气体 X,胶头滴管中盛有液体 Y,若挤压胶头滴管使液体滴入广口瓶中,振荡,一段时间后可见小气球 a 膨胀鼓起。下表中的各组物质不会出现上述现象的是( )
8. 如图所示、广口瓶中盛有气体 X,胶头滴管中盛有液体 Y,若挤压胶头滴管使液体滴入广口瓶中,振荡,一段时间后可见小气球 a 膨胀鼓起。下表中的各组物质不会出现上述现象的是( )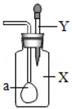
X
Y
A
CO
Ca(OH)2 溶液
B
CO2
NaOH 溶液
C
HCl
Ca(OH)2 溶液
D
SO2
NaOH 溶液
A、A B、B C、C D、D9. 向氢氧化钠溶液不断滴入盐酸(每点反应都很充分),得到如图的曲线,下列有关判断不正确的是( ) A、a 点时溶液中有氢氧化钠和氯化钠 B、a 点到 b 点溶液中盐酸的量不断增大 C、b 点时,HCl 与 NaOH 恰好完全反应 D、b 点到 c 点时,溶液中氯化钠的量不再增加10. 推理是学习化学的一种重要方法,下列推理正确的是( )A、氧化物中含有氧元素,所以含有氧元素的化合物都是氧化物 B、溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小 C、碱性溶液能使紫色石蕊试液变蓝,所以能使石蕊试液变蓝的溶液一定呈碱性 D、碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐11. 用数轴表示某些化学知识直观、简明、易记,下列数轴表示错.误.的是( )A、
A、a 点时溶液中有氢氧化钠和氯化钠 B、a 点到 b 点溶液中盐酸的量不断增大 C、b 点时,HCl 与 NaOH 恰好完全反应 D、b 点到 c 点时,溶液中氯化钠的量不再增加10. 推理是学习化学的一种重要方法,下列推理正确的是( )A、氧化物中含有氧元素,所以含有氧元素的化合物都是氧化物 B、溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小 C、碱性溶液能使紫色石蕊试液变蓝,所以能使石蕊试液变蓝的溶液一定呈碱性 D、碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐11. 用数轴表示某些化学知识直观、简明、易记,下列数轴表示错.误.的是( )A、 溶液的 pH 由小到大
B、
溶液的 pH 由小到大
B、 不同种原子间的原子序数依次递增
C、
不同种原子间的原子序数依次递增
C、 含铁化合物中铁元素的质量分数由小到大
D、
含铁化合物中铁元素的质量分数由小到大
D、 含氮物质中氮元素的化合价从低到高
12. 下列图象能正确反映其对应关系的是( )
含氮物质中氮元素的化合价从低到高
12. 下列图象能正确反映其对应关系的是( ) A、①向等质量、等浓度的稀硫酸中分别加入过量的 Zn 和 Fe B、②向含有少量 NaOH 的 Na2CO3 溶液中逐滴加入稀盐酸 C、③用等质量、等浓度的过氧化氢溶液在有、无催化剂条件下制取氧气 D、④一定温度时,向一定量的饱和石灰水中加入生石灰13. 有四瓶无色溶液,他们分别是:①稀盐酸 ②稀硫酸 ③氢氧化钠溶液 ④硫酸钠溶液。某实验小组分别对四种溶液进行了一系列实验,结果如下表:
A、①向等质量、等浓度的稀硫酸中分别加入过量的 Zn 和 Fe B、②向含有少量 NaOH 的 Na2CO3 溶液中逐滴加入稀盐酸 C、③用等质量、等浓度的过氧化氢溶液在有、无催化剂条件下制取氧气 D、④一定温度时,向一定量的饱和石灰水中加入生石灰13. 有四瓶无色溶液,他们分别是:①稀盐酸 ②稀硫酸 ③氢氧化钠溶液 ④硫酸钠溶液。某实验小组分别对四种溶液进行了一系列实验,结果如下表:实验操作
甲
乙
丙
丁
加入无色酚酞试液
不变色
变红
不变色
不变色
加入硝酸钡溶液
白色沉淀
无明显现象
白色沉淀
无明显现象
加入锌粒
无明显现象
无明显现象
产生无色气体
产生无色气体
则对应甲、乙、丙、丁顺序的四种物质是( )
A、④③②① B、②③④① C、③④①② D、①②④③14. a 和 b 为两份质量相等的固体,已知 a 为混有少量二氧化锰的氯酸钾,b 为氯酸钾。当分别同时加热 a 和 b 至完全反应时,能正确表示生成氧气的质量随反应时间而变化的图象是( )A、 B、
B、 C、
C、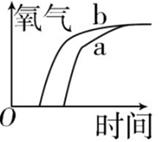 D、
D、 15. 将一定质量的 Ba(OH)2 溶液与 Na2CO3 溶液混合恰好完全反应,向反应后的混合物中加入稀盐酸,产生气体的体积与加入稀盐酸的体积的关系如图所示,下列说法中正确的是( )
15. 将一定质量的 Ba(OH)2 溶液与 Na2CO3 溶液混合恰好完全反应,向反应后的混合物中加入稀盐酸,产生气体的体积与加入稀盐酸的体积的关系如图所示,下列说法中正确的是( ) A、N 点时,所得溶液的 pH=7 B、Q 点时,所得溶液中的溶质只含有 BaCl2 C、O 至 P 段发生反应的化学方程式为 NaOH+HCl= NaCl+H2O D、P 至 Q 段发生反应的化学方程式为 Ba(OH)2+2HCl= BaCl2+2H2O
A、N 点时,所得溶液的 pH=7 B、Q 点时,所得溶液中的溶质只含有 BaCl2 C、O 至 P 段发生反应的化学方程式为 NaOH+HCl= NaCl+H2O D、P 至 Q 段发生反应的化学方程式为 Ba(OH)2+2HCl= BaCl2+2H2O二、填空题
-
16. 无数实验已经证实:所有的化学反应都遵循定律。以下选项中,在化学反应前后一定不变的是。
①原子的数目 ②分子的数目 ③元素的种类 ④物质的种类 ⑤原子的种类⑥物质的总质量 ⑦元素的化合价
17. 填空:(1)、稀盐酸、稀硫酸具有相似化学性质是因为溶液中都含有相同的。(2)、检验某醋酸溶液的酸碱度用测定。(3)、①Ba(OH)2、②Na2SO4、③HNO3、④FeCl3 , 不用其他试剂就可将它们逐一鉴别出来, 最先鉴别出来的物质是(填序号)。(4)、蚊虫叮咬时会分泌出蚁酸,可以涂抹下列物质中的(填序号)消除。①稀盐酸 ②食醋 ③肥皂水 ④食盐水
18. 某科学小组为了验证铁、铜、镁、汞的金属活动性顺序,设计了如下实验方案: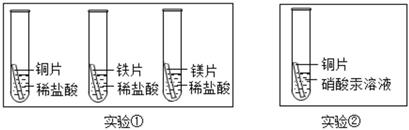
根据实验①判断出镁的金属活动性比铁强,依据的现象是 , 根据实验②判断反应后得到溶液的质量(填“>”或“<”或“=”)反应前溶液的质量。
19. 气体的制备是科学实验基本技能之一。现用如图所示装置制取初中科学中常见的气体。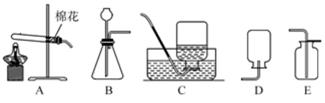 (1)、实验室制取并收集一瓶二氧化碳气体应选择的装置是。(2)、实验室用氯酸钾和二氧化锰的混合物制取氧气,应选择的发生装置为 , 如果选择 C 装置收集氧气,是利用氧气这一物理性质。20. 金属是人们生活、生产中离不开的材料,不仅因为其物理性能优良,还与其化学性质密切相关,试回答:(1)、钛被称为“21 世纪金属”,呈灰色,密度较小,它能在氮气中燃烧,熔点较高。钛合金是新型的结构材料,主要用于航天和航海工业。上述描述中属于钛的化学性质的是;(2)、某小组用如图所示装置对铁生锈的条件进行探究。5 min 后发现 A 中铁钉表面灰暗,B 中铁钉仍然光亮,对比可得:决定铁生锈快慢的一个重要因素是。
(1)、实验室制取并收集一瓶二氧化碳气体应选择的装置是。(2)、实验室用氯酸钾和二氧化锰的混合物制取氧气,应选择的发生装置为 , 如果选择 C 装置收集氧气,是利用氧气这一物理性质。20. 金属是人们生活、生产中离不开的材料,不仅因为其物理性能优良,还与其化学性质密切相关,试回答:(1)、钛被称为“21 世纪金属”,呈灰色,密度较小,它能在氮气中燃烧,熔点较高。钛合金是新型的结构材料,主要用于航天和航海工业。上述描述中属于钛的化学性质的是;(2)、某小组用如图所示装置对铁生锈的条件进行探究。5 min 后发现 A 中铁钉表面灰暗,B 中铁钉仍然光亮,对比可得:决定铁生锈快慢的一个重要因素是。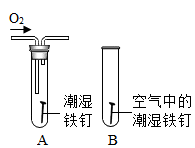 21. 在学习碱的性质时,为了验证溶液中的氢氧化钠能与二氧化碳反应,老师做了下面两个实验。
21. 在学习碱的性质时,为了验证溶液中的氢氧化钠能与二氧化碳反应,老师做了下面两个实验。实验一:如图甲,将一支充满二氧化碳的试管倒扣在盛有氢氧化钠溶液的烧杯中,观察试管中的液面变化情况。
实验二:如图乙,向两个装满二氧化碳的同样规格的瓶中分别注入等量的氢氧化钠溶液和蒸馏水,振荡后放在水平的桌面上,观察 U 形管(装有红墨水)两端液面的变化情况,请问:
 (1)、实验二中若观察到 U 形管左端液面(填“升高”或“降低”),则证明溶液中的氢氧化钠能与二氧化碳反应。(2)、与实验一相比,同学们认为实验二更合理,因为它排除对实验的干扰。22. 某化学兴趣小组为了验证某氯化钠溶液中混有碳酸钠、硫酸钠、氢氧化钠,其实验流程及部分实验现象如图所示,(提示:Na2CO3 可使酚酞试液变红,BaSO4 不溶于强酸溶液)
(1)、实验二中若观察到 U 形管左端液面(填“升高”或“降低”),则证明溶液中的氢氧化钠能与二氧化碳反应。(2)、与实验一相比,同学们认为实验二更合理,因为它排除对实验的干扰。22. 某化学兴趣小组为了验证某氯化钠溶液中混有碳酸钠、硫酸钠、氢氧化钠,其实验流程及部分实验现象如图所示,(提示:Na2CO3 可使酚酞试液变红,BaSO4 不溶于强酸溶液) (1)、试剂甲是溶液;(2)、第Ⅲ实验中还可观察到的实验现象是;(3)、证明样品中含有 NaOH 的证据是。
(1)、试剂甲是溶液;(2)、第Ⅲ实验中还可观察到的实验现象是;(3)、证明样品中含有 NaOH 的证据是。三、实验探究题
-
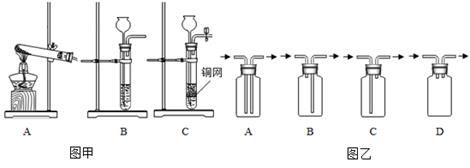
23. 如图甲中的 A、B、C 是实验室制备某些常见气体的发生装置示意图,图乙是四种气体收集装置。请结合所学知识回答:
 (1)、图甲中的 A 可用作实验室制取氧气,其化学方程式为。(2)、图乙的四种装置中,可用来进行“排空气法”收集 H2 的是(填字母编号)。(3)、某同学在图甲装置 B 的基础上,增加了隔离铜网和止水夹等改成装置 C 来制取二氧化 碳,图甲中装置 C 与 B 相比,突出优点是。24. 小明和同学用稀硫酸与锌制取氢气时,发现添加少量硫酸铜溶液能加快反应。硫酸铜溶液是稀硫酸和锌反应的催化剂吗?硫酸铜溶液量的多少会影响反应速率吗?(1)、他们先进行如图实验,观察到右边试管中产生气泡速度快得多,并有暗红色固体生成。他认为 CuSO4 溶液不是催化剂,所依据的实验现象是。
(1)、图甲中的 A 可用作实验室制取氧气,其化学方程式为。(2)、图乙的四种装置中,可用来进行“排空气法”收集 H2 的是(填字母编号)。(3)、某同学在图甲装置 B 的基础上,增加了隔离铜网和止水夹等改成装置 C 来制取二氧化 碳,图甲中装置 C 与 B 相比,突出优点是。24. 小明和同学用稀硫酸与锌制取氢气时,发现添加少量硫酸铜溶液能加快反应。硫酸铜溶液是稀硫酸和锌反应的催化剂吗?硫酸铜溶液量的多少会影响反应速率吗?(1)、他们先进行如图实验,观察到右边试管中产生气泡速度快得多,并有暗红色固体生成。他认为 CuSO4 溶液不是催化剂,所依据的实验现象是。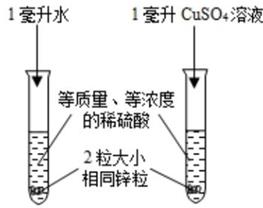 (2)、在 6 支试管中分别加入 2 颗大小形状都相同的锌粒,倒入等质量、等质量分数的稀硫酸;按下表所示条件进行实验,并测量收集 50 毫升氢气所用的时间。记录如下:
(2)、在 6 支试管中分别加入 2 颗大小形状都相同的锌粒,倒入等质量、等质量分数的稀硫酸;按下表所示条件进行实验,并测量收集 50 毫升氢气所用的时间。记录如下:试管
A
B
C
D
E
F
CuSO4 溶液/毫升
0
0.5
1
1.5
2
4
水/毫升
4
3.5
3
V1
V2
0
收集 H2 所用的时间/秒
348
246
190
165
230
360
试管 D 中加入水的体积 V1=毫升;由上表可得出,CuSO4 的溶液的量对稀硫 酸与锌反应速率影响的变化趋势是。
25. 学习了 CO2 的相关知识之后,小明对 CO2 的性质进行三个实验。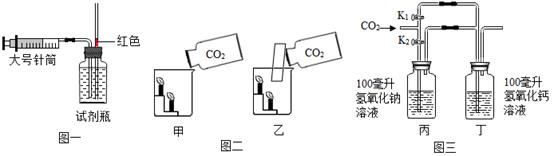
图一:探究 CO2 在水中的溶解能力。
①试剂瓶加满(填“蒸馏水”或“干净雨水”),恰好 200 mL,塞紧橡皮塞; ②用针筒抽取 200 mLCO2;连接装置,缓慢推动活塞,将 CO2 注入瓶内;
③当注入 CO2 气体体积达到 120 mL 时,红色油柱开始向上移动。则表明在该条件下,1
体积水中能溶解体积 CO2。
图二:验证 CO2 的密度比空气大,应选装置易成功。
图三:验证 CO2 能否与 NaOH、Ca(OH)2 反应。
①关闭 K1 , 打开 K2 , 缓缓通入 600 mL CO2 , 丙、丁容器中均无明显现象;
②打开 K1 , 打开 K2 , 继续通入 CO2 , 丁容器中出现浑浊。
根据上述现象,可推断 CO2。
A.一定能与 NaOH 反应 B.可能与 NaOH 反应
C.一定能与 Ca(OH)2 反应 D.可能与 Ca(OH)2 反应
26. 同学们用 Na2CO3 溶液和浓盐酸来研究简易灭火器的反应原理时,对反应后废液的成分进行探究。大家判断废液中溶质一定有 NaCl(NaCl 溶液呈中性),设计一个简单的实验确定废液中另一成分是 Na2CO3 还是盐酸。(1)、小明同学向废液中逐滴加入经硝酸酸化的 AgNO3 溶液来确定废液中另一成分是Na2CO3 还是盐酸,小芳认为此方法不可行,原因是。
(2)、小芳用实验测出废液的 pH 大于 7,确定废液中一定含有。(3)、欲从废液中得到纯净的 NaCl,请完成下表实验方案设计。方案
加入试剂
分离方法
方案评价
1
适量 Ca(OH)2 溶液
过滤、蒸发、结晶
不可行,理由
是
2
过量的稀盐酸
蒸发结晶
可行
四、解答题
-
27. 花青素(化学式 C15H11O6)具有缓解眼睛疲劳,保护视力的作用,该物质主要来源于各种蔬菜和水果。(1)、一个花青素分子中共有个原子;(2)、花青素中碳、氢、氧元素的质量比是;(3)、28.7 克花青素中含有多少克碳元素(请列式计算)。28. 将一定质量的 a、b、c、d 四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应前后各物质的质量如下:
物质
a
b
c
d
反应前质量/g
8.4
5.2
6.0
0.6
反应后质量/g
待测
4.56
9.2
0.6
分析表中数据可知:
(1)、d 可能是不参与反应的杂质,也可能是剂。(2)、上表中待测的数据为。(3)、该反应的基本类型是。29. 有 2.3 g 某物质在纯氧中完全燃烧,只生成 4.4 g 二氧化碳和 2.7 g 水,(1)、该过程消耗氧气的质量为g。(2)、则该物质中一定含有元素(填元素符号),其元素质量比为。30. 2017年8月9日,波音 737 配套改扩建工程设计及概算评审会在浙江舟山举行。大飞机离我们越来越近了。金属铝具有质轻、抗腐蚀性能好等优点,在飞机制造领域具有广泛的用途。(1)、与铁、铜等常见金属相比,铝的性质相对活泼,为什么却有好的抗腐蚀性能?(2)、小科用放置很久的铝箔与稀盐酸反应,产生氢气质量和反应时间关系如图所示。反应开始到 t1 之前,没有氢气产生的原因是; 在 t2~t3 时间段产生气泡的速度逐渐放慢,到反应停止时,铝 箔还有大量剩余,t2~t3 时间段产生气泡速度放慢的原因是。 (3)、为进一步测量铝箔中单质铝的质量分数,小科取 3.0 g 铝箔样品与 100 g 稀盐酸充分反应(2Al+6HCl=2AlCl3+3H2↑),铝箔完全溶解后剩余溶液的总质量为 102.7 g,计算样 品中单质铝的质量分数。31. 实验室现有氯化钠和碳酸钠的固体混合物样品,小明同学想测定样品中碳酸钠的质量。先称取该混合物样品 5 g,完全溶于水中,然后取用了一定溶质质量分数的氯化钡溶液 40 g 平均分四次加入其中,充分振荡,实验所得数据见下表,请你分析并进行有关计算:
(3)、为进一步测量铝箔中单质铝的质量分数,小科取 3.0 g 铝箔样品与 100 g 稀盐酸充分反应(2Al+6HCl=2AlCl3+3H2↑),铝箔完全溶解后剩余溶液的总质量为 102.7 g,计算样 品中单质铝的质量分数。31. 实验室现有氯化钠和碳酸钠的固体混合物样品,小明同学想测定样品中碳酸钠的质量。先称取该混合物样品 5 g,完全溶于水中,然后取用了一定溶质质量分数的氯化钡溶液 40 g 平均分四次加入其中,充分振荡,实验所得数据见下表,请你分析并进行有关计算:次数
物质的质量
1
2
3
4
加入氯化钡溶液的质量/g
10
10
10
10
生成沉淀的质量/g
1.97
X
5.91
5.91
(1)、上表中 X 的数值为;(2)、计算原固体混合物样品中碳酸钠的质量是多少?(3)、上述实验中所用到的氯化钡溶液的质量分数是多少?32. 在一烧杯中盛有 100 g BaCl2 和 HCl 的混合溶液,向其中逐渐滴加溶质质量分数为10%的 Na2CO3 溶液,混合溶液的质量与所滴入的 Na2CO3 溶液的质量关系图像如图所示。 (1)、在实验过程中,可以先后看到的明显实验现象是。(2)、求原溶液中 BaCl2 的质量分数为多少?(3)、当滴入 Na2CO3 溶液至图中 B 点时,通过计算求所得不饱和溶液中溶质质量分数为多少?(计算结果精确到 0.1%)33. 碳酸氢钠片是一种常用药,能用于治疗胃酸过多,这是因为人体的胃液中含有盐酸。已知:NaHCO3+HCl=NaCl+H2O+CO2↑,为测定药片中碳酸氢钠的 含量,小科进行了如下实验:(1)、小科认为,要测定药片中碳酸氢钠的含量,实验中需要采集两个数据:一是测出碳酸氢钠片样品的质量;二是根据碳酸氢钠与盐酸的反应原理,通过实验测出反应生成的质量。(2)、小科按如图甲的实验方案,取药片和足量的稀盐酸进行实验,通过测量反应前后总质量的变化来采集实验数据。同学们认为,测得碳酸氢钠的质量分数会偏大,原因是(3)、为减小实验误差,小科又设计了如图乙的实验方案,取药片和足量的稀盐酸进行了三次实验,采集的实验数据如表:
(1)、在实验过程中,可以先后看到的明显实验现象是。(2)、求原溶液中 BaCl2 的质量分数为多少?(3)、当滴入 Na2CO3 溶液至图中 B 点时,通过计算求所得不饱和溶液中溶质质量分数为多少?(计算结果精确到 0.1%)33. 碳酸氢钠片是一种常用药,能用于治疗胃酸过多,这是因为人体的胃液中含有盐酸。已知:NaHCO3+HCl=NaCl+H2O+CO2↑,为测定药片中碳酸氢钠的 含量,小科进行了如下实验:(1)、小科认为,要测定药片中碳酸氢钠的含量,实验中需要采集两个数据:一是测出碳酸氢钠片样品的质量;二是根据碳酸氢钠与盐酸的反应原理,通过实验测出反应生成的质量。(2)、小科按如图甲的实验方案,取药片和足量的稀盐酸进行实验,通过测量反应前后总质量的变化来采集实验数据。同学们认为,测得碳酸氢钠的质量分数会偏大,原因是(3)、为减小实验误差,小科又设计了如图乙的实验方案,取药片和足量的稀盐酸进行了三次实验,采集的实验数据如表:
实验序号
1
2
3
碳酸氢钠片样品质量/克
3.0
3.0
3.0
反应前总质量/克
193.8
194.6
193.6
反应后总质量/克
192.6
193.6
192.5
二氧化碳质量/克
请计算药片中碳酸氢钠的质量分数。