浙江省杭州市八校联盟2018-2019学年高一上学期化学期中考试试卷
试卷更新日期:2019-01-03 类型:期中考试
一、选择题
-
1. 当光束通过下列分散系时,能观察到丁达尔现象的是( )A、盐酸 B、食盐溶液 C、氢氧化铁胶体 D、碘的酒精溶液2. 下列仪器及其名称不正确的是( )A、 量筒
 B、 试管
B、 试管  C、 圆底烧瓶
C、 圆底烧瓶 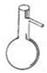 D、 分液漏斗
D、 分液漏斗  3. 20世纪初,通过a粒子散射实验提出带核的原子结构模型的科学家是( )A、舍勒 B、卢瑟福 C、汤姆生 D、玻尔4. 下列属于氧化还原反应的是 ( )A、2KBr+Cl2=2KCl+Br2 B、CaCO3=CaO+CO2↑ C、SO3+H2O=H2SO4 D、MgCl2+2NaOH=Mg(OH)2↓+2NaCl5. 下列各组物质中,按单质、化合物、混合物顺序排列的是( )A、铁、四氧化三铁、冰水混合物 B、氯气、纯碱、漂白粉 C、水银、空气、干冰 D、二氧化硫、水蒸气、盐酸6. 下列说法不正确的是( )A、复分解反应一定不是氧化还原反应 B、置换反应一定是氧化还原反应 C、有单质参加的反应一定是氧化还原反应 D、部分分解反应是氧化还原反应7. 标准状况下,气体的体积大小主要取决于( )A、分子数目 B、分子间距 C、分子大小 D、分子种类8. 下列说法正确的是( )A、H2、D2、T2互为同位素 B、Na2CO3电离方程式Na2CO3 = 2Na+ + C 4 + + 3O 2 - C、20g D2O含有的电子数为10NA D、
3. 20世纪初,通过a粒子散射实验提出带核的原子结构模型的科学家是( )A、舍勒 B、卢瑟福 C、汤姆生 D、玻尔4. 下列属于氧化还原反应的是 ( )A、2KBr+Cl2=2KCl+Br2 B、CaCO3=CaO+CO2↑ C、SO3+H2O=H2SO4 D、MgCl2+2NaOH=Mg(OH)2↓+2NaCl5. 下列各组物质中,按单质、化合物、混合物顺序排列的是( )A、铁、四氧化三铁、冰水混合物 B、氯气、纯碱、漂白粉 C、水银、空气、干冰 D、二氧化硫、水蒸气、盐酸6. 下列说法不正确的是( )A、复分解反应一定不是氧化还原反应 B、置换反应一定是氧化还原反应 C、有单质参加的反应一定是氧化还原反应 D、部分分解反应是氧化还原反应7. 标准状况下,气体的体积大小主要取决于( )A、分子数目 B、分子间距 C、分子大小 D、分子种类8. 下列说法正确的是( )A、H2、D2、T2互为同位素 B、Na2CO3电离方程式Na2CO3 = 2Na+ + C 4 + + 3O 2 - C、20g D2O含有的电子数为10NA D、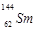 与
与  的核外电子数和中子数均为62
9. 现有四组液体:①氯化钠溶液和四氯化碳组成的混合液 ②43%的乙醇溶液 ③含单质溴的水溶液 ④粗盐溶液中混有泥沙,分离以上各混合液的正确方法依次是( )A、分液、萃取、蒸馏、结晶 B、萃取、蒸馏、分液、结晶 C、蒸馏、萃取、分液、过滤 D、分液、蒸馏、萃取、过滤10. 向四支试管中分别加入少量不同的无色溶液进行如下操作,现象、结论正确的是( )
的核外电子数和中子数均为62
9. 现有四组液体:①氯化钠溶液和四氯化碳组成的混合液 ②43%的乙醇溶液 ③含单质溴的水溶液 ④粗盐溶液中混有泥沙,分离以上各混合液的正确方法依次是( )A、分液、萃取、蒸馏、结晶 B、萃取、蒸馏、分液、结晶 C、蒸馏、萃取、分液、过滤 D、分液、蒸馏、萃取、过滤10. 向四支试管中分别加入少量不同的无色溶液进行如下操作,现象、结论正确的是( )操作
现象
结论
A
加入浓NaOH溶液,加热,将湿润红色石蕊试纸置于试管口
试纸不变蓝
原溶液中一定无NH4+
B
加入苯,振荡、静置
分层,下层溶液显橙红色
原溶液中一定有溴单质
C
滴加氯化钡溶液,再加盐酸
白色沉淀产生
一定有SO42-
D
用洁净铁丝蘸取溶液进行焰色反应
火焰呈黄色
原溶液一定含钠盐
A、A B、B C、C D、D11. 同温同压下,相同体积的CO和CO2相比较,下列说法不正确的是( )A、分子个数之比为1:1 B、密度之比为11:7 C、质量之比为7:11 D、所含氧原子个数比为1:212. 下列溶液中的Cl-浓度与100 mL 1 mol·L-1 AlCl3溶液中Cl-浓度相等的是 ( )A、200 mL 1.5 mol·L-1 NaCl溶液 B、150 mL 1 mol·L-1 MgCl2溶液 C、100 mL 3 mol·L-1 NaClO溶液 D、50 mL 3 mol·L-1 KCl溶液13. 已知碳元素有12C、14C两种核素,氧元素有16O、18O两种核素,则它们所形成的二氧化碳分子共有( )A、2种 B、4种 C、6种 D、12种14. 下列反应需要加入氧化剂才能实现的是( )A、Cl2→Cl- B、H+→H2 C、CO32-→CO2 D、Zn→Zn2+15. 下列氯化物,既能由金属和氯气直接化合制得,又能由金属和盐酸反应制得的是( )A、MgCl2 B、FeCl3 C、FeCl2 D、CuCl216. 下列说法正确的是( )A、工业上用氯气与澄清石灰水反应制取漂白粉 B、氯气能与铁反应,所以液氯不宜贮存在钢瓶中 C、漂白粉露置于空气中会变质 D、工业上利用冷却结晶法提取海水中的食盐17. 下列说法不正确的是( )A、新制氯水可使紫色石蕊试液先变红后褪色 B、新制氯水有漂白性是因为HClO的强氧化性 C、新制氯水能杀菌消毒是因为Cl2有毒,能毒杀细菌 D、新制氯水与久置的氯水中加小苏打溶液都能产生气泡18. 检验氯化氢气体中是否混有Cl2 , 可采用的方法是( )A、用干燥的蓝色石蕊试纸 B、用干燥有色布条 C、将气体通入硝酸银溶液 D、用湿润的淀粉碘化钾试纸19. 在不用指示剂的情况下,欲将氯化钙溶液中的盐酸除去,最好选用下列物质中的( )A、碳酸钙粉末 B、生石灰粉末 C、石灰水 D、熟石灰粉末20. 设NA代表阿伏加德罗常数的数值。下列有关叙述不正确的是( )A、标准状况下,2.24LH2O含有的分子数等于0.1NA B、23gNa在氯气中完全燃烧失去电子数一定为NA C、常温常压下,32gO2或O3中所含氧原子数为2NA D、由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2 NA21. 为了除去粗盐中的CaCl2、MgCl2、Na2SO4及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。正确的操作顺序是 ( )A、①④②⑤③ B、④①②⑤③ C、⑤④①②③ D、⑤②④①③22. 带有2个单位正电荷的微粒X2+ , 它的质量数等于137,中子数是81,则核外电子数为( )A、56 B、54 C、58 D、13723. 在2L由NaCl、MgCl2、CaCl2组成的混合液中,c(Cl-)=2.5mol•L-1 、c(Na+ )=1.0 mol•L-1 、c(Mg2 + )=0.50 mol•L- 1 则此溶液中Ca2 + 离子的物质的量是( )A、0.5 mol B、1.0 mol C、2.0 mol D、3.0 mol24. 已知反应:KClO3 + 6HCl = 3Cl2 + KCl + 3H2O下列说法正确的是( )A、反应中还原剂是HCl,还原产物是KCl B、氧化性强弱关系为:KClO3>Cl2 C、反应中氧化剂与还原剂的物质的量之比为1:6 D、当消耗1mol氧化剂时,反应中转移电子的物质的量为6mol25. 向 30mL 1mol•L﹣1盐酸中加入 20mL 1mol•L﹣1 的 AgNO3溶液,充分反应后,溶液中 H+ 物质的量浓度为(设稀溶液相混合后总体积为原溶液体积之和) ( )A、0.2mol•L﹣1 B、1mol•L﹣1 C、0.5mol•L﹣1 D、0.6mol•L﹣1二、填空题
-
26.(1)、书写电离方程式:KClO3 : ;H2SO4 :(2)、现有以下物质:①NaOH固体 ②盐酸 ③CaCO3固体 ④熔融KCl ⑤蔗糖 ⑥铜 ⑦CO2 ⑧纯醋酸 ⑨液氨
以上物质中能导电的是;(填序号,下同)
以上物质中属于电解质的是 。
(3)、在标准状况下,11.2L O2和CO2的混合气体的质量为19g,该混合气体中含O2mol,CO2g。27. 有X、Y、Z、三种元素,X元素原子核内无中子,Y元素原子核内有8个质子,Z元素原子得到1个电子后与氩原子核外电子排布相同。(1)、写出X元素符号 , 画出Y元素的原子结构示意图。(2)、写出Z单质与X2Y反应化学方程式。28. 火药是中国的“四大发明”之一,黑火药在发生爆炸时,发生如下的反应:2KNO3 + C + S = K2S + 2NO2↑+ CO2↑。
(1)、其中氧化剂是 , 氧化产物是;(2)、当消耗8g硫磺时,反应中共转移电子mol。29. 实验是化学研究的一种重要手段,现有下图所示A—G七种仪器,请根据要求填空。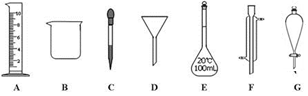 (1)、写出仪器名称: F 。(2)、下列实验操作中用到仪器G的是 (选填下列选项的编号字母)。
(1)、写出仪器名称: F 。(2)、下列实验操作中用到仪器G的是 (选填下列选项的编号字母)。a.分离水和CCl4的混合物 b.分离水和酒精的混合物 c.分离水和泥砂的混合物
(3)、实验室需配制90mL 1.2 mol/L的稀盐酸。①本实验需取6.0mol/L的盐酸mL,取用该盐酸时,需要用到上述仪器中的A和(选填仪器的编号字母)
②在定容操作时,因不慎加水至凹液面最低处超过了刻度线,该如何处理:
(4)、在配制过程中,其他操作都是正确的,下列操作中会引起误差且使浓度偏大的是。①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
30. 实验室用下图装置(夹持及加热仪器已略)制备氯气并进行相关实验。 (1)、实验室常用A装置制取氯气,写出实验室制取氯气的化学方程式;(2)、装置B中饱和食盐水的作用是;(3)、装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入;
(1)、实验室常用A装置制取氯气,写出实验室制取氯气的化学方程式;(2)、装置B中饱和食盐水的作用是;(3)、装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入;Ⅰ
Ⅱ
Ⅲ
a
干燥的有色布条
碱石灰
湿润的有色布条
b
干燥的有色布条
无水氯化钙
湿润的有色布条
c
湿润的有色布条
浓硫酸
干燥的有色布条
d
湿润的有色布条
无水氯化钙
干燥的有色布条
(4)、装置D的作用是尾气处理,写出烧杯中发生的反应化学方程式;(5)、实验室常用湿润的KI淀粉试纸检验氯气,写出氯气与KI发生反应的化学方程式。三、计算题:
-
31. 研究性学习小组用化学方法测量一个不规则容器的体积,测量过程如下:
称取7.5gCuSO4·5H2O晶体放入500mL烧杯中,加入150mL蒸馏水。待晶体完全溶解、冷却后,将溶液全部转移到容器中,用蒸馏水稀释到完全充满容器,从中取出溶液100mL ,该溶液恰好与20mL 0.1mol/L BaCl2溶液完全反应。
(1)、求100mL CuSO4 溶液的物质的量浓度 ;(2)、试计算该容器的体积。