广东省2018-2019学年九年级上学期化学第二次月考试卷
试卷更新日期:2019-01-02 类型:月考试卷
一、选择题
-
1. 主持测定铟、铱等元素相对原子质量新值的我国科学家是( )A、门捷列夫 B、道尔顿 C、张青莲 D、拉瓦锡2. 实验结束后,下列仪器放置的方法正确的是( )A、
 B、
B、 C、
C、 D、
D、 3. 下列物质燃烧时既能产生火焰,又能产生白烟的是( )A、木炭在氧气中燃烧 B、镁条在空气中燃烧 C、红磷在空气中燃烧 D、酒精在空气中燃烧4. 空气中含量最多的气体是( )A、O2 B、N2 C、H2 D、CO25. CO、CO2、O2 这三种气体的共同点是( )A、都易溶于水 B、都含有氧元素 C、都能燃烧 D、都有毒6. 右图是元素周期表的一部分,下列说法正确的是( )A、质量相同的 B,C,Al 三种单质,其中原子数目最多的是 B
3. 下列物质燃烧时既能产生火焰,又能产生白烟的是( )A、木炭在氧气中燃烧 B、镁条在空气中燃烧 C、红磷在空气中燃烧 D、酒精在空气中燃烧4. 空气中含量最多的气体是( )A、O2 B、N2 C、H2 D、CO25. CO、CO2、O2 这三种气体的共同点是( )A、都易溶于水 B、都含有氧元素 C、都能燃烧 D、都有毒6. 右图是元素周期表的一部分,下列说法正确的是( )A、质量相同的 B,C,Al 三种单质,其中原子数目最多的是 B B、铝原子的结构示意图为
B、铝原子的结构示意图为  C、碳元素的原子序数是 12.01
D、硼元素是第一周期元素
7. 英国科技人员研制出自动灭火陶瓷砖,砖里压入了一定量的氦气和二氧化碳。这种砖砌成的房屋发生火灾时,在高温烘烧下,砖会裂开并喷出氦气和二氧化碳,从而抑制和扑灭火焰。自动灭火陶瓷砖的灭火原理是 ( )
C、碳元素的原子序数是 12.01
D、硼元素是第一周期元素
7. 英国科技人员研制出自动灭火陶瓷砖,砖里压入了一定量的氦气和二氧化碳。这种砖砌成的房屋发生火灾时,在高温烘烧下,砖会裂开并喷出氦气和二氧化碳,从而抑制和扑灭火焰。自动灭火陶瓷砖的灭火原理是 ( )
A、清除可燃物 B、使燃烧物与氧气隔绝 C、降低燃烧物的着火点 D、使燃烧物的温度降低到着火点以下8. 我科学家预言并合成新的碳单质“T-碳”,其结构如下图所示,能比肩石墨和金刚石,密度约为石墨的 ,金刚石的一半,但硬度却很大,具有蓬松的结构,拥有广泛的应用前景。下列关于 T-碳的说法正确的是( ) A、密度相对石墨和金刚石较小是描述 T-碳的化学性质 B、T-碳没有可燃性 C、T-碳具有吸附性 D、T-碳中的碳原子排列方式跟金刚石相同9. “生命可贵,安全第一”。下列采取的安全措施错误的是( )A、厨房天然气管道漏气,应马上打开换气扇换气 B、进入久未开启的菜窖前,应用蜡烛做灯火实验 C、点燃甲烷前应检验其纯度 D、冬天室内用炭火取暖时应经常开窗通风10. 如图是我国《可再生资源法》倡导的碳资源的转化与循环利用示意图。下列做法与该图体现的理念不符的是( )
A、密度相对石墨和金刚石较小是描述 T-碳的化学性质 B、T-碳没有可燃性 C、T-碳具有吸附性 D、T-碳中的碳原子排列方式跟金刚石相同9. “生命可贵,安全第一”。下列采取的安全措施错误的是( )A、厨房天然气管道漏气,应马上打开换气扇换气 B、进入久未开启的菜窖前,应用蜡烛做灯火实验 C、点燃甲烷前应检验其纯度 D、冬天室内用炭火取暖时应经常开窗通风10. 如图是我国《可再生资源法》倡导的碳资源的转化与循环利用示意图。下列做法与该图体现的理念不符的是( ) A、将秸秆加工转化为酒精燃料 B、二氧化碳作为原料生产尿素 C、过度开采煤、石油作为燃料 D、将石油精炼,制备合成材料11. 下列说法中正确的是( )A、物质膨胀是构成该物质的粒子体积变大 B、LPG 表示压缩天然气 C、用剩药品放回原瓶以免浪费 D、原子的质量主要集中在其原子核上12. 珍珠是一种名贵的中药材,其主要成分是一种含钙的化合物。把盐酸滴在珍珠粉上,产生大量气泡。若将生成的气体通入澄清的石灰水,澄清的石灰水变浑浊。据此推断,珍珠的主要成分可能是( )A、K2CO3 B、Ca(OH)2 C、CaCO3 D、Ca(NO3)213. 在相同温度和相同体积的条件下,气体压强(p)与气体分子数目(n)成正比关系(p=kn)。若 ag 碳和 bg 氧气放入一密闭容器中,测得容器内的气体压强为 p,然后提供一定条件使容器内的物质发生充分反应,待温度复原时,测得容器内的气体压强仍然为 p。则 a 与 b 的关系可能为( )A、a=
A、将秸秆加工转化为酒精燃料 B、二氧化碳作为原料生产尿素 C、过度开采煤、石油作为燃料 D、将石油精炼,制备合成材料11. 下列说法中正确的是( )A、物质膨胀是构成该物质的粒子体积变大 B、LPG 表示压缩天然气 C、用剩药品放回原瓶以免浪费 D、原子的质量主要集中在其原子核上12. 珍珠是一种名贵的中药材,其主要成分是一种含钙的化合物。把盐酸滴在珍珠粉上,产生大量气泡。若将生成的气体通入澄清的石灰水,澄清的石灰水变浑浊。据此推断,珍珠的主要成分可能是( )A、K2CO3 B、Ca(OH)2 C、CaCO3 D、Ca(NO3)213. 在相同温度和相同体积的条件下,气体压强(p)与气体分子数目(n)成正比关系(p=kn)。若 ag 碳和 bg 氧气放入一密闭容器中,测得容器内的气体压强为 p,然后提供一定条件使容器内的物质发生充分反应,待温度复原时,测得容器内的气体压强仍然为 p。则 a 与 b 的关系可能为( )A、a= B、a<
B、a<  C、a>
C、a>  D、a>
D、a>  14. 利用数字化实验可以更准确地比较不同聚集状态的碳酸钙与稀盐酸反应的速率。如下图 所示,倾斜锥形瓶使试管内稀盐酸流入瓶中与固体发生反应,瓶内气压的变化如曲线所示。下列说法正确的是( )
14. 利用数字化实验可以更准确地比较不同聚集状态的碳酸钙与稀盐酸反应的速率。如下图 所示,倾斜锥形瓶使试管内稀盐酸流入瓶中与固体发生反应,瓶内气压的变化如曲线所示。下列说法正确的是( )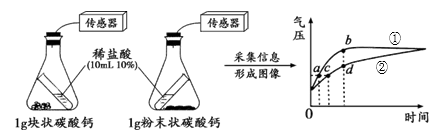 A、a 点表示碳酸钙与盐酸反应已停止 B、曲线①表示的是块状的碳酸钙与稀盐酸的反应 C、等质量不同聚集状态的碳酸钙参加反应,粉末状碳酸钙产生的 CO2 质量更多 D、对比曲线①②中的 a、c 两点可知,产生相同质量的 CO2 , 粉末状碳酸钙用时更少
A、a 点表示碳酸钙与盐酸反应已停止 B、曲线①表示的是块状的碳酸钙与稀盐酸的反应 C、等质量不同聚集状态的碳酸钙参加反应,粉末状碳酸钙产生的 CO2 质量更多 D、对比曲线①②中的 a、c 两点可知,产生相同质量的 CO2 , 粉末状碳酸钙用时更少二、填空题 第二卷
-
15. 请根据示例写出下列虚线框中对应的化学符号或符号所表达的含义。

(1)(2)(3)16. 氧烛是一种用于缺氧环境中自救的化学氧源,其主要成分为 NaClO3 , 还含有适量的催化剂、成型剂等,一定条件下能持续放出高纯氧气。 (1)、氧烛可用于自救是由于产生的氧气能够;(2)、NaClO3 中 Cl 的化合价为;(3)、Na、Cl、O 三种元素的本质区别是;(4)、NaClO3 反应制氧气类似 KClO3 的分解,请写出氧蜡中 NaClO3 反应的化学方程:。
(1)、氧烛可用于自救是由于产生的氧气能够;(2)、NaClO3 中 Cl 的化合价为;(3)、Na、Cl、O 三种元素的本质区别是;(4)、NaClO3 反应制氧气类似 KClO3 的分解,请写出氧蜡中 NaClO3 反应的化学方程:。
17. 清华大学研究人员成功研制出一种纳米纤维催化剂,可将二氧化碳转化成液体燃料甲醇(CH3OH),其微观示意图如图。请回答下列问题 (1)、请在上图的方框中画出丁物质的分子模型;
(1)、请在上图的方框中画出丁物质的分子模型;
(2)、该反应的化学方程式为:;(3)、由上图可知化学反应的实质是原子的重新组合,这是定律成立的理论依据。18. 水是生命之源,“珍惜水、节约水、保护水”是每个公民的义务和责任。请回答下列问题。 (1)、甲、乙、丙、丁中只有丙中的水发生变化(填“物理”或“化学”);(2)、丙中的管 b 产生气体 5mL,则管 a 产生气体mL;(3)、乙中玻璃导管尽量设计长些有利;(4)、高铁酸钾(K2FeO4)是一种新型、高效的多功能水处理剂。高铁酸钾受热时发生的反应为 4K2FeO4 2R+4K2O+3O2↑,则 R 是(填化学式);(5)、自然界中的水都不是纯水,利用沉淀、、吸附和蒸馏等方法可以净化水 。丁是用来净化河水的简易装置,下面对该净水装置的作用分析正确的是。
(1)、甲、乙、丙、丁中只有丙中的水发生变化(填“物理”或“化学”);(2)、丙中的管 b 产生气体 5mL,则管 a 产生气体mL;(3)、乙中玻璃导管尽量设计长些有利;(4)、高铁酸钾(K2FeO4)是一种新型、高效的多功能水处理剂。高铁酸钾受热时发生的反应为 4K2FeO4 2R+4K2O+3O2↑,则 R 是(填化学式);(5)、自然界中的水都不是纯水,利用沉淀、、吸附和蒸馏等方法可以净化水 。丁是用来净化河水的简易装置,下面对该净水装置的作用分析正确的是。A.能杀菌消毒 B.能得到纯净水
C.能把硬水变为软水 D.能使河水变得澄清
19. 课外小组的同学自制一块多槽铜板,设计了下图所示装置,用以探究燃烧的条件。回答下列问题: (1)、该实验中二氧化锰起作用;(2)、滴水之前白磷不燃烧,滴水之后白磷燃烧, 说明可燃物燃烧条件之一是;(3)、该实验中气球的作用;(4)、将过氧化氢溶液滴入盛有 MnO2 的金属槽中,
(1)、该实验中二氧化锰起作用;(2)、滴水之前白磷不燃烧,滴水之后白磷燃烧, 说明可燃物燃烧条件之一是;(3)、该实验中气球的作用;(4)、将过氧化氢溶液滴入盛有 MnO2 的金属槽中,发生反应的化学方程式为。
足量白磷
(5)、在该实验中,应该先挤压(填“左”或“右”)边的胶头滴管的胶帽滴下液体。20. 知识整理是一种重要的学习能力。右边是某同学小结整理出的物质互化三角关系图: (1)、若该三角是“碳三角”(甲、乙、丙三种物质都含 有碳元素),则:
(1)、若该三角是“碳三角”(甲、乙、丙三种物质都含 有碳元素),则:①甲的化学式;
②乙的固体俗名干冰,写出干冰的一种用途;
③该三角中涉及到属于吸热反应的化学方程式:。
(2)、若该三角是“氧三角”(甲、乙、丙三种物质都含有氧元素),且已知乙是相对 分子质量最小的氧化物,则:①乙的化学式:;
②该三角中初中阶段反应条件为唯一性的反应化学方程式:。
21. 电脑、手机芯片的研发离不开硅这种物质,下图是工业上以石英砂(主要成分SiO2)为主要原料制取纯硅的一种方法,请回答以下问题。 (1)、地壳中硅元素的含量仅次于元素;(2)、流程①中石英砂和焦炭粉碎的作用是;(3)、流程①的反应化学方程;(4)、流程②的基本反应类型是;(5)、SiCl4 是一种遇水极易变质的液体,沸点 57.7℃。在流程③蒸馏时的蒸馏装置中温度计(填“需要”或“不能”)插入 SiCl4 中。(6)、尾气 HCl 有毒,若让其分解为 H2 和 Cl2 , 这样不单能避免污染环境,在经济角度上还能。
(1)、地壳中硅元素的含量仅次于元素;(2)、流程①中石英砂和焦炭粉碎的作用是;(3)、流程①的反应化学方程;(4)、流程②的基本反应类型是;(5)、SiCl4 是一种遇水极易变质的液体,沸点 57.7℃。在流程③蒸馏时的蒸馏装置中温度计(填“需要”或“不能”)插入 SiCl4 中。(6)、尾气 HCl 有毒,若让其分解为 H2 和 Cl2 , 这样不单能避免污染环境,在经济角度上还能。三、实验题
-
22. 根据下列装置图,回答问题:
 (1)、装置①中两种铁制仪器的名称分别是、。在仪器安装过程发现试管固定太高,不可以通过调节螺母(编号 A~D)进行调整(选填字母)。(2)、用高锰酸钾制取氧气,发生装置选择 , 收集较干燥氧气选择(数字 代号)。涉及反应的化学方程式为。(3)、用装置④收集 H2 , 气流的流入端是(填“a”或“b”)。(4)、用装置③制取气体,反应物 X 和 Y 必须具备什么特点:。(5)、用装置⑦做硫在氧气中燃烧实验,瓶预先加水的作用。(6)、某同学用“气球法”设计实验来验证 CO2 的密度大于空气(见下图)
(1)、装置①中两种铁制仪器的名称分别是、。在仪器安装过程发现试管固定太高,不可以通过调节螺母(编号 A~D)进行调整(选填字母)。(2)、用高锰酸钾制取氧气,发生装置选择 , 收集较干燥氧气选择(数字 代号)。涉及反应的化学方程式为。(3)、用装置④收集 H2 , 气流的流入端是(填“a”或“b”)。(4)、用装置③制取气体,反应物 X 和 Y 必须具备什么特点:。(5)、用装置⑦做硫在氧气中燃烧实验,瓶预先加水的作用。(6)、某同学用“气球法”设计实验来验证 CO2 的密度大于空气(见下图)
①该同学所用气球装的气体 A 是(填“空气”或“CO2”)
②该同学在验证过程中发现气球没有上浮,而是沉在杯底,请你
分析造成实验失败的可能因素:。
23. 纳米级 Cu2O 因具有优良的催化性能备受关注。某兴趣小组同学在《培养中学生基本科学素养的化学实验教学研究》课题组老师的带领下开展了系列研究。(1)、Ⅰ.纳米级 Cu2O 的用途研究【查阅资料】
①氨气是一种有刺激性气味的气体,在高浓度氧气中才能燃烧,生成氮气和水;
②在纳米级 Cu2O 的催化作用下,氨气与氧气在一定温度下发生以下化学反应:
4NH3+5O2 ═ 4NO+6H2O 和 4NH3+3O2 ═ 2N2+6H2O;
③工业上用 NO 制备硝酸、氮肥等化工产品。
【实验 1】
设计如图的实验装置验证氨气在氧气中燃烧:将过量的氧气与氨气分别从 a、b 两管进气口通入,并在 b 管上端点燃氨气。实验组需先通入氧气,后通入氨气,理由是。
(2)、【实验 2】设计如下图 A 实验装置,并对生成物进行成分分析:

根据气体成分分析数据,同学们绘制了曲线图(见图 B),发现在纳米级 Cu2O 的催化作用下,300℃时以生产为主。若利用后续处理装置模拟硝酸的工业制 法,最好将电热丝的温度控制在℃左右。
(3)、Ⅱ.纳米级 Cu2O 的制备研究
利用某些特殊的细菌,在一定条件下将某岩石中的不溶性硫化铜(CuS)转化为 可溶性硫酸铜,进而制得纳米级 Cu2O,其流程如下:a.在细菌作用下,岩石中的硫化铜(CuS)与空气中的氧气反应生成硫酸铜,反应的 化学方程式为。
b.③中观察到的现象是。
c.在加热条件下,用液态肼(N2H4)还原新制 Cu(OH)2 生成 Cu2O、N2 和 H2O,反应的化学方程式为。
四、计算题
-
24. 从 2018 年 5 月 1 日起,我国对进口的全部抗癌药实现零关税。其中有一种被应用于各类癌症患者的药物——聚乙二醇非格司亭(C37H47N3O6)。请回答:(1)、聚乙二醇非格司亭的相对分子质量为;(2)、聚乙二醇非格司亭分子中,碳、氧原子的个数比为;(3)、聚乙二醇非格司亭中,氢、氮元素的质量比为;(4)、聚乙二醇非格司亭中,(填元素名称)元素的质量分数最高。25. 现有 25 ℃时含有 7.4 g 溶质的饱和澄清石灰水,请按下面要求计算:(1)、向上述石灰水中通入 CO2 , 当二者恰好完全反应生成碳酸钙沉淀时,通入 CO2的质量是多少克?(写出计算过程)(2)、已知持续向饱和澄清石灰水中通入 CO2 , 过量的 CO2 会跟生成的 CaCO3 反应,生成可溶于水的 Ca(HCO3)2 , 反 应 方 程 为 : CaCO3+H2O+CO2 = Ca(HCO3)2。现向含有 7.4 g溶质的饱和澄清石灰水持续通入二氧化碳,请在图中画出产生沉淀的质量与通入二氧化碳的质量关系。
 (3)、另取一定量的饱和澄清石灰水,通入一段时间的 CO2 , 反应物与生成物的质量如表:
(3)、另取一定量的饱和澄清石灰水,通入一段时间的 CO2 , 反应物与生成物的质量如表:
则m = , 该反应的总化学方程式为。