浙江省温州市苍南县金乡二中2017-2018学年九年级上学期科学第一次次月考试卷
试卷更新日期:2018-12-26 类型:月考试卷
一、选择题
-
1. 下列是科学上常见的现象,其中涉及到化学变化的是( )A、立秋过后,早晨经常看到停止路边汽车玻璃上有露水 B、硫酸铜晶体受热变成白色 C、中秋期间公园或校园经常闻到一阵一阵桂花香味 D、浓硫酸敞口放置在空气中质量变大了2. 下列各组离子属于酸电离出来的是 ( )A、H+、
 、Na+
B、OH-、Na+ Ba2+
C、H+、
、Na+
B、OH-、Na+ Ba2+
C、H+、  、
、 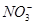 D、Na+、
D、Na+、  、K+
3. 下表所列物质的分类,正确的是( )
、K+
3. 下表所列物质的分类,正确的是( )选项
单质
氧化物
混合物
A
钢
氧化铜
稀盐酸
B
白磷
水
空气
C
氧气
干冰
冰水混合物
D
水银
硫酸
食盐水
A、A B、B C、C D、D4. 可用于清洗铁制品表面铁锈的是 ( )A、稀硫酸 B、氢氧化钠溶液 C、硫酸铜溶液 D、水5. 下列对实验现象描述不正确的是 ( )A、铁丝在空气中剧烈燃烧,火星四射,生成红棕色固体. B、向碎鸡蛋壳中滴加稀盐酸,有气泡产生 C、硫在空气里燃烧,发出微弱的淡蓝色火焰,生成有刺激性气体 D、向CuSO4溶液中滴加NaOH溶液,产生蓝色沉淀6. 下列物质的俗名,化学名称和化学式相吻合的是( )A、纯碱、氢氧化钠、NaOH B、生石灰、氧化钙、CaO C、石灰石、氢氧化钙、Ca(OH)2 D、熟石灰、碳酸钙、CaCO37. 区别稀盐酸和稀硫酸最好用( )A、紫色石蕊 B、氯化钡 C、硝酸银 D、 无色酚酞8. 我国内陆一些盐碱地的土壤呈碱性,难以种植植物。当地农民通过引用淡水反复“浸洗”来降低土壤的碱性。下列图象符合上述操作的是( )A、 B、
B、 C、
C、 D、
D、 9. 土壤的酸碱度直接影响农作物的生长。已知某地区土壤显微酸性。参照下表,从土壤酸碱性考虑,在该地区不适宜种植的作物是( )
9. 土壤的酸碱度直接影响农作物的生长。已知某地区土壤显微酸性。参照下表,从土壤酸碱性考虑,在该地区不适宜种植的作物是( )作物
小麦
油菜
西瓜
甘草
最适宜的土壤pH范围
5.5~6.5
5.8~6.7
6.0~7.0
7.2~8.5
A、西瓜 B、甘草 C、小麦 D、油菜10. 科学实验必须按规范进行操作,下列实验操作中规范的是( )A、 取少量氯化钠
B、
取少量氯化钠
B、 闻药品气味
C、
闻药品气味
C、 滴加液体
D、
滴加液体
D、 稀释浓硫酸
11. 我国是世界上发现、利用金属锑(Sb)较早的国家之一,目前锑的产量位居世界第一。冶炼金属锑的过程中,发生的反应为:2Sb2O3+3C=4Sb+3CO2↑。该反应的类型为 ( )A、置换反应 B、化合反应 C、复分解反应 D、分解反应12. 利用下列各组物质间的反应,能够验证铁、铜、银三种金属活动性顺序的是( )A、氯化亚铁溶液、铜、银 B、铁、氯化铜溶液、银 C、氯化亚铁溶液、氯化铜溶液、银 D、氯化铜溶液、铁、硝酸银溶液13. 分别把下列各组中的物质加入水中,最终可能得到无色澄清溶液的是 ( )A、AgNO3 KCl HNO3 B、Fe(NO3)3 K2SO4 HCl C、KOH CuSO4 H2SO4 D、MgCl2 NaOH H2SO414. 除去下表物质中含有的杂质,所选试剂不正确的是( )
稀释浓硫酸
11. 我国是世界上发现、利用金属锑(Sb)较早的国家之一,目前锑的产量位居世界第一。冶炼金属锑的过程中,发生的反应为:2Sb2O3+3C=4Sb+3CO2↑。该反应的类型为 ( )A、置换反应 B、化合反应 C、复分解反应 D、分解反应12. 利用下列各组物质间的反应,能够验证铁、铜、银三种金属活动性顺序的是( )A、氯化亚铁溶液、铜、银 B、铁、氯化铜溶液、银 C、氯化亚铁溶液、氯化铜溶液、银 D、氯化铜溶液、铁、硝酸银溶液13. 分别把下列各组中的物质加入水中,最终可能得到无色澄清溶液的是 ( )A、AgNO3 KCl HNO3 B、Fe(NO3)3 K2SO4 HCl C、KOH CuSO4 H2SO4 D、MgCl2 NaOH H2SO414. 除去下表物质中含有的杂质,所选试剂不正确的是( )选项
物质
杂质
除去杂质所选试剂
A
铜粉
铁
硫酸铜溶液
B
生石灰
碳酸钙
稀盐酸
C
氧气
二氧化碳
氢氧化钠溶液
D
稀硝酸
硫酸
硝酸钡溶液
A、A B、B C、C D、D15. 往一定量的稀硫酸溶液中加入过量的锌粒,如图是反应过程中某物质的质量随加入锌粒的质量变化关系,则这种物质不可能是( ) A、参加反应的稀硫酸 B、生成的氢气 C、生成的硫酸锌 D、溶液的质量
A、参加反应的稀硫酸 B、生成的氢气 C、生成的硫酸锌 D、溶液的质量二、简答题
-
16. 世界是物质的,物质是由各种化学元素组成的。请从以下物质中选择:食盐、盐酸、熟石灰、氧气、碳酸钾、碳酸钙并写出下列物质的化学式:(1)、用于腌制食品的是:;(2)、既可用来消毒杀菌,又可用来改良酸性土壤的碱是;(3)、难溶于水的固体是 。17. 人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属。
 (1)、根据上图金属应用实例推断,金属具有的物理性质有(1条):(2)、日常使用的金属材料多数属于合金,下表列出了一些常见合金的主要成分和性能。
(1)、根据上图金属应用实例推断,金属具有的物理性质有(1条):(2)、日常使用的金属材料多数属于合金,下表列出了一些常见合金的主要成分和性能。合金
合金的主要性能
主要成分及纯金属的性能
焊锡
熔点183 ℃
锡:熔点232 ℃;铅:熔点327 ℃
硬铝
强度和硬度好
铝、铜、镁等。硬度小,质软
不锈钢
抗腐蚀性好
铁、铬、镍等。纯铁抗腐蚀性能不如不锈钢
由上表推断,与组成合金的纯金属相比,合金的优点一般有(填序号多选)
①强度更低 ②硬度更高 ③熔点更高 ④抗腐蚀性更好
18. 中国科学家屠呦呦因发现治疗疟疾的药物“青蒿素(C15H22O5)”而获得2015年世界诺贝尔医学奖。青蒿素由种元素组成,在组成分类上属于有机物,是由于.19. 小明同学在实验室中测定碳酸钠溶液的pH,他的实验操作如下:先用蒸馏水将pH试纸润湿,然后用玻璃棒蘸取待测试液于pH试纸上进行测定,你认为小明同学这样测量错误之处是,测得的结果与该溶液的实际pH比较(填“偏大”、“偏小”或“不变”)20. 小科发现暖水瓶中有一层淡黄色的水垢.据悉,该地区的水垢中除了碳酸钙外,无其它盐类.他想探究水垢中碳酸钙的质量分数,于是他收集水垢后经低温烘干进行下列实验: (1)、取10g水垢按图甲中的A装置高温加热充分反应(已知CaCO3=CaO+CO2↑,产生的气体依次通过B、C装置,实验后发现C装置中氢氧化钠溶液增加了3.52g.
(1)、取10g水垢按图甲中的A装置高温加热充分反应(已知CaCO3=CaO+CO2↑,产生的气体依次通过B、C装置,实验后发现C装置中氢氧化钠溶液增加了3.52g.①C装置中增加了3.52g是 与氢氧化钠反应的质量。
②甲中B装置的作用 . 如果把B、C位置对换会产生后果是
③仪器a的名称是
(2)、按图乙所示的方法来实验,结果发现澄清石灰水没有变浑浊,原因是浓盐酸具有性,出来的氯化氢和二氧化碳进入石灰水中,氯化氢溶于水形成盐酸,盐酸能和氢氧化钙反应,也能够和生成的碳酸钙反应,所以不能产生沉淀,该反应后E中溶质一定有21. 小刚在复习物质的化学性质时,列出了以下物质:C、H2、O2、Fe、CO、CO2、CuO、CaCO3、稀盐酸、NaOH溶液、CuSO4溶液、BaCl2溶液.他发现上述物质中,有些物质能与其他三种或三种以上的物质在一定条件下发生反应。例如:CuO与C、H2、CO、稀盐酸都能反应。请你仿照示例填写表内空格。编号
示例
⑴
⑵
⑶
物质
CuO
CuSO4溶液
稀盐酸
能与其反应的所有物质
C、H2、CO
稀盐酸
CO2、稀盐酸、CuSO4溶液
22. 每年冬季,暴风雪袭击了我国很多地区,在抗击暴风雪的战斗中,融雪剂发挥了—定的作用。某公司生产的融雪剂的成分是由氯化钠、氯化镁、硫酸铜、硝酸钠中的两种或两种以上的物质组成。某兴趣小组为探究其成分设计并完成了以下实验:根据上述实验推断该融雪剂组成肯定没有 , 肯定有.
三、科学探究题
-
23. 在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸,反应中溶液的温度与加入盐酸的体积变化如下:
加入盐酸的体积V/mL
2
4
6
8
10
12
14
16
18
20
测得溶液温度t/℃
15.2
19.6
22.0
26.0
28.2
26.7
25.7
24.7
23.7
22.9
(1)、试绘出溶液的温度与加入盐酸的体积之间的变化关系曲线。 (2)、根据曲线讨论溶液温度变化的原因。
(2)、根据曲线讨论溶液温度变化的原因。①根据酸碱反应的表格数据描述温度随着稀盐酸量增加的关系
②猜想温度变化的原因并加以解释
(3)、反思若某同学提出“将氢氧化钠固体直接与10%盐酸反应,以探究酸碱反应是否放热”,此提议是否合理?为什么?
24. 小丽午餐时买了一份清炒菠菜和一份豆腐肉片汤,但同学告诉她菠菜不能与豆腐同食。[发现问题]菠菜为什么不能与豆腐同食?
[查阅资料]a.制作豆腐需加入石膏(主要成分:CaSO4);b.菠菜中含有可溶性草酸、草酸盐、碳酸盐等成分;c.草酸钙是一种既不溶于水也不溶于醋酸的白色固体,碳酸钙是溶于醋酸的白色固体,两者都是诱发人体结石的物质。
[提出猜想]菠菜与豆腐同食可能会产生人体不能吸收的沉淀物。
(1)、[设计实验]实验步骤
实验现象
实验结论
①菠菜在少量开水中煮沸2~3min,充分过滤,取1~2mL滤液于试管中,并滴加少量硝酸钙溶液
产生白色沉淀
该沉淀可能是
②在步骤①的沉淀物中加入过量醋酸
沉淀部分溶解,且产生气泡
被不溶解的沉淀一定是
(2)、[发现新问题]被溶解的沉淀是什么?产生的气体又是什么?于是她又设计如下实验进一步探究:
实验步骤
实验现象
实验结论
③将步骤②产生的气体
通入 澄清石灰水 中
产生的气体是二氧化碳;步骤②被溶解的沉淀是
(3)、[反思与应用]家庭中常常将菠菜放在开水中煮沸2~3min捞出后再烹饪,其目的是.25. 请你参与某学习小组的探究活动,并回答相关问题:[发现问题]小丽发现生活中盛水的铁锅在与水面接触的部位最易生锈;
小茜发现自己的铜制眼框表面出现了绿色的铜锈;
小玲发现苹果切开不久,果肉上会产生一层咖啡色物质,好象生了“锈”一般。
[提出问题]这三种物质“生锈”的原因是什么?
[收集证据] ⑴根据生活经验:铁生锈的跟水与空气有关。
⑵查阅有关资料:“铜锈”主要成分是Cu2(OH)2CO3(俗称铜绿);苹果“生锈”是果肉里的物质(酚和酶)与空气中的氧气发生了一系列的反应,生成咖啡色的物质。
⑶实验探究:在老师指导下,将四小块铜片分别按下图所示设置实验放置一个月,观察现象如下:
实验
装置
①

②

③

④

实验
现象
铜片不生锈
铜片不生锈
铜片不生锈
铜片生锈且水面附近锈蚀最严重
科学实验很多设计上都要有对照组,上述实验的对照组是
[得出结论]经过实验和交流讨论,三位同学认为 铜生锈跟有关
[反思与应用]利用所得结论填空:写出一种防铜金属制品生锈的具体方法;(写出一种即可)
四、分析计算题
-
26. 胃液主要成分是盐酸,在消化食物的同时,也对胃壁有一定的损害作用,即造成一些细胞的死亡。胃壁覆盖着一层厚厚的,被称为胃粘膜的上皮细胞。它与胃液直接接触,使带有腐蚀性的胃液不能渗入到胃的内壁。我们知道,如果胃内产生过多的酸液,就会导致胃溃疡。由于胃粘膜具有特殊的保护作用,所以可免遭或只受到轻度的酸液侵蚀。如果胃摄入重金属会引起中毒。
人体胃出毛病了,检查胃毛病,需要导入对人体服用无害的造影剂(如医用硫酸钡),人为地提高X光显示对比度,才能达到理想的检查效果.这种检查方法临床上叫做X线造影检查,但造影剂不能是碳酸钡。根据我们学过知识加以解释造影剂是硫酸钡而不是碳酸钡的原因
27. 2015年8月12日天津港发生爆炸事件,在这次事件中疑似化学药品电石(CaC2)起重大作用,是因为电石遇水可产生乙炔气体,反应的化学方程式为CaC2+2H2O=Ca(OH)2+______↑。某桶电石标签的部分内容如图所示。 (1)、补充完成上述化学方程式中的化学式(2)、在电石标签的部分内容中注意保存方法应该注明密封保存外,还要注意。(3)、在CaC2中,Ca的化合价为+2价,C的化合价为(4)、在该桶电石中,纯CaC2的质量为kg。28. 柑桔是我市主要的农产品之一,但一些地方由于化肥施用不合理,对柑桔品质、土壤结构等造成不良影响,因此要提倡科学施肥,多用农家肥料,如草木灰(其有效成分是K2CO3)等.某兴趣小组为了测定草木灰中K2CO3的含量,利用K2CO3与足量的稀盐酸反应进行实验反应式为:K2CO3+2HCl═2KCl+H2O+CO 2↑有关数据如下表:
(1)、补充完成上述化学方程式中的化学式(2)、在电石标签的部分内容中注意保存方法应该注明密封保存外,还要注意。(3)、在CaC2中,Ca的化合价为+2价,C的化合价为(4)、在该桶电石中,纯CaC2的质量为kg。28. 柑桔是我市主要的农产品之一,但一些地方由于化肥施用不合理,对柑桔品质、土壤结构等造成不良影响,因此要提倡科学施肥,多用农家肥料,如草木灰(其有效成分是K2CO3)等.某兴趣小组为了测定草木灰中K2CO3的含量,利用K2CO3与足量的稀盐酸反应进行实验反应式为:K2CO3+2HCl═2KCl+H2O+CO 2↑有关数据如下表:称取草木灰样品的质量(克)
稀盐酸中HCl的质量分数
收集的CO2质量(克)
100
20%
4.4
假设草木灰中除K2CO3外,其它物质均不含K元素,也不与稀盐酸反应;CO2的损失不计.试计算:
(1)、草木灰在化肥中属于肥(2)、反应时实际消耗稀盐酸的质量是克.(3)、该草木灰中含K2CO3的质量分数是.29. 在一烧杯中盛有22.3g Na2CO3和NaCl组成的固体混合物,加足量水溶解,制成溶液。向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示:(Na2CO3+2HCl=2NaCl+H2O+CO2↑)
请根据题意回答问题:
(1)、当滴加了73g稀盐酸时,放出气体的总质量为 g。(2)、当滴加稀盐酸至图中B点时,烧杯中溶液里的溶质是(写化学式)。(3)、根据化学方程计算固体混合物中NaCl的质量分数30. 某同学用一定质量分数的Na2CO3 溶液做“Na2CO3 + CaCl2 == 2NaCl + CaCO3↓”的实验。其五次实验结果如下表所示:根据实验结果回答下列问题:
实验次数
氯化钙质量/g
碳酸钠溶液的质量/g
碳酸钙的质量/g
1
5.55
200
5
2
11.1
200
10
3
22.2
200
X
4
33.3
200
25
5
33.3
400
30
(1)、哪几次反应碳酸钠有剩余(填序号)(2)、表中X的值是。(3)、试计算碳酸钠溶液中溶质的质量分数。31. 为了测定某含杂质7%的黄铜(锌和铜合金)样品中铜的质量分数(杂质不溶于水,不与其它物质反应,受热也不分解),某化学小组进行了如下实验: (1)、配制上述质量分数为14.6%的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是;(2)、生成氢气的质量为(3)、该黄铜样品中铜的质量分数是;(4)、向过滤后所得滤液中加入87.4g水,则最终所得溶液中溶质的质量分数是;
(1)、配制上述质量分数为14.6%的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是;(2)、生成氢气的质量为(3)、该黄铜样品中铜的质量分数是;(4)、向过滤后所得滤液中加入87.4g水,则最终所得溶液中溶质的质量分数是;