山东省枣庄市2017-2018学年中考化学二模考试试卷
试卷更新日期:2018-12-25 类型:中考模拟
一、单选题
-
1. 化学已经渗透到社会发展的各个方面,在①环境保护;②能源开发利用;③新材料研制;④生命过程探索等领域中,与化学科学发展密切相关的是( )A、只有①②③ B、只有②③④ C、只有①②④ D、①②③④2. 对下列实验方法的理解,错误的是( )A、过滤与筛选的原理是类似的,都是把颗粒大小不同的物质分离开 B、蒸发就是使溶液中的溶剂分子在外界条件的影响下逸出液面 C、蒸馏就是使液体中的分子在外界条件的影响下逸出液面再重新凝结为液体 D、结晶就是把溶液中的溶质转化为难溶的沉淀析出3. 农业上常用饱和食盐水进行选种.饱和食盐水露置在空气中一段时间后,有少量固体析出(设温度保持不变).下列推测正确的是( )A、氯化钠溶解度变小 B、食盐水在空气中变质而不能继续使用 C、溶液依然饱和,溶质的质量分数不变 D、水分蒸发,溶质的质量分数变大4. 陶瓷、玻璃、水泥到电子芯片,硅元素的用途非常广泛。工业制取高纯硅的部分反应原理的微观示意图如下,有关说法错误的是( )
 A、该反应为置换反应 B、反应后硅元素的化合价升高 C、X的化学式是HCl D、图甲所示物质中硅、氯元素的质量比是14:715. 如图所示实验能达到目的的是( )。
A、该反应为置换反应 B、反应后硅元素的化合价升高 C、X的化学式是HCl D、图甲所示物质中硅、氯元素的质量比是14:715. 如图所示实验能达到目的的是( )。 A、探究溶剂种类对物质溶解性的影响 B、 测定空气中+
A、探究溶剂种类对物质溶解性的影响 B、 测定空气中+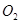 的含量
C、 鉴别
的含量
C、 鉴别  溶液和
溶液和  溶液
D、 探究
溶液
D、 探究  的催化作用
6. (镧)是一种活动性比锌强的金属元素,其氧化物为 ,对应的碱 ,难溶于水,而 、 都易溶于水,下列各组物质中,不能直接反应生成 的是( )。A、
的催化作用
6. (镧)是一种活动性比锌强的金属元素,其氧化物为 ,对应的碱 ,难溶于水,而 、 都易溶于水,下列各组物质中,不能直接反应生成 的是( )。A、 B、
B、 C、
C、 D、
D、 7. 向一定量的铁粉中逐滴加入稀硫酸至过量,该图是反应过程中某种物质的质量Y随加入稀硫酸的质量变化的关系,则Y不可能表示( )。
7. 向一定量的铁粉中逐滴加入稀硫酸至过量,该图是反应过程中某种物质的质量Y随加入稀硫酸的质量变化的关系,则Y不可能表示( )。 A、消耗铁粉的质量 B、生成硫酸亚铁的质量 C、溶液的总质量 D、生成氢气的质量
A、消耗铁粉的质量 B、生成硫酸亚铁的质量 C、溶液的总质量 D、生成氢气的质量二、填空题
-
8. 化学就在我们身边,与我们的生活息息相关.请回答以下生活中的问题:(1)、“沙里淘金”说明黄金在自然界中能够以(填“单质”或“化合物”)形式存在.(2)、葡萄表皮上因喷洒“波尔多液”而呈现的蓝色斑点,可以用厨房调料洗净.(3)、刘大爷种的小麦出现倒伏现象,你会建议他使用化肥中的肥.(4)、通常所说的煤气中毒是指由(填物质化学式)引起的中毒.9. 已知,在水溶液中,乙醇(C2H5OH)不发生电离;溴化氢(HBr)电离产生氢离子(H+)和溴离子(Br-);氢氧化钠电离产生钠离子和氢氧根离子.请回答下列问题:(1)、根据这三种溶液的组成推断,医用酒精(含乙醇75%的水溶液)显性,溴化氢的水溶液显性.(2)、写出上述物质之间发生中和反应的化学方程式(3)、氢氧化钠溶液中存在的微粒有(用化学符号表示) .
三、流程题
-
10. 我国每年报废的手机超过1亿部。废旧手机的电路板中含有铝、铁、铜、银、金等多种金属,随意丢弃既会造成资源浪费,也会污染土壤和水体。化学兴趣小组为回收其中的铜,设计并进行了如下实验。

已知:Cu+H2O2+H2SO4=CuSO4+2H2O;不考虑金、银发生类似反应。
(1)、将电路板粉碎成粉末的目的是。(2)、步骤①所得滤液中的溶质除硫酸外,还有。(用化学式填空)(3)、步骤②中的实验现象是:固体部分溶解,。(4)、步骤④中反应的化学方程式是。四、科学探究题
-
11. 同学们在实验室用块状大理石和5%的稀盐酸反应制取CO2 , 观察不到气泡产生时,发现固体还有剩余,对此进行探究(杂质不溶于水且不与酸反应)。
(提出问题)不再产生气泡的原因是什么?
(猜想假设)
猜想一:盐酸已经完全反应
猜想二:剩余固体中无碳酸钙
猜想三:生成物或杂质附着在大理石表面,阻碍反应继续进行
(实验探究一)反应后溶液中是否有盐酸。
(1)、小亮取上述反应后的清液,测得溶液pH=2,说明溶液显性,由此得出猜想一不成立的结论。(2)、小慧认为此结论不够严谨,还应考虑生成物对溶液酸碱度的影响,补充了如下实验。①取洁净的烧杯,另配制溶液,测得溶液pH=7。
②取洁净的试管,加入适量水和紫色石蕊溶液,持续通入CO2 , 发现溶液变为色。
但小亮认为实验②不能说明CO2对溶液酸碱度的影响,他重新改进了实验。
③另取洁净的试管,加入适量水,持续通入CO2至饱和,测得溶液pH=5.6。
由以上实验可知,该反应的生成物对溶液酸碱度影响不大,猜想一不成立,反应后的溶液中有盐酸。
(实验探究二)剩余固体中是否有碳酸钙。
小亮先振荡反应容器,使剩余固体和液体充分接触,观察到仍无气泡产生。再向容器中滴加少量5%的稀盐酸,又有气泡产生。一段时间后,不再产生气泡,仍有固体剩余。产生气泡的化学方程式是。
由以上实验可知,猜想二和猜想三不成立。
(得出结论)根据以上实验探究,可得出影响反应能否进行的因素之一是。
(反思交流)小慧又提出,也可能是反应太慢,无法观察到气泡产生。她设计了如下对比实验:取出(实验探究二)所得的部分清液,放置一段时间后,测得pH为X,同时测得
(实验探究二)容器中剩余清液的pH为Y,若XY(填“>”“=”或“<”),则她的猜想成立。
五、推断题
-

