2017年科学中考复习专题:常见的化学反应及其应用
试卷更新日期:2017-04-01 类型:二轮复习
一、单选题
-
1. 科研人员研发出一种能将二氧化碳转化为甲烷的新技术,该技术以纳米镍粒子为催化剂,将二氧化碳和氢气混合加热发生反应,生成甲烷等物质,从而减少碳排放.该反应前后发生变化的是( )A、元素的种类 B、碳原子的数目 C、氢元素的化合价 D、纳米镍粒子的化学性质2. 工程技术人员通常利用铝热剂燃烧释放大量的热来焊接铁轨.点燃铝热剂反应的化学方程式为:2Al+Fe2O3
 2Fe+Al2O3 , 下列叙述错误的是( ) A、该反应是置换反应 B、该反应中铝发生的是氧化反应 C、生成物中的铁的化合价为+3价 D、焊接过程中既有物理变化又有化学变化3. 我国是世界上发现、利用金属锑(Sb)较早的国家之一,目前锑的产量位居世界第一.冶炼金属锑的过程中,发生的反应为:2Sb2O3+3C 4Sb+3CO2↑,此反应中,表现出还原性的物质是( )A、Sb2O3 B、C C、Sb D、CO24. 下列说法中正确的是( )A、红磷在氧气中能燃烧,在空气中不能燃烧 B、硫在氧气中燃烧后生成有刺激性气味的气体 C、镁条在氧气中燃烧时,火星四射,生成黑色固体 D、木炭伸入盛有氧气的集气瓶中剧烈燃烧,发出白光5. 下列反应中,反应前后元素的化合价没有发生变化的是( )A、Fe+CuSO4=FeSO4+Cu B、 C、MgCl2+2NaOH=Mg(OH)2↓+2NaCl D、6. 下列化学方程式符合题意且书写正确的是( )A、不能用铁制容器配制波尔多液:2Fe+3CuSO4═Fe2(SO4)3+3Cu B、证明铜的活动性比银强:Cu+2AgCl═CuCl2+2Ag C、医疗上用氢氧化镁中和胃酸过多:Mg(OH)2+H2SO4═MgSO4+2H2O D、炼铁时用一氧化碳还原氧化铁:Fe2O3+3CO 2Fe+3CO27. 在天平两边的托盘上各放一个质量相等的烧杯,并分别加入等质量、等质量分数的足量的稀盐酸,天平平衡。若向左盘烧杯中加入100 g碳酸钙,充分反应后,要想使天平重新平衡,应向右盘烧杯中加入的物质可能是( )
2Fe+Al2O3 , 下列叙述错误的是( ) A、该反应是置换反应 B、该反应中铝发生的是氧化反应 C、生成物中的铁的化合价为+3价 D、焊接过程中既有物理变化又有化学变化3. 我国是世界上发现、利用金属锑(Sb)较早的国家之一,目前锑的产量位居世界第一.冶炼金属锑的过程中,发生的反应为:2Sb2O3+3C 4Sb+3CO2↑,此反应中,表现出还原性的物质是( )A、Sb2O3 B、C C、Sb D、CO24. 下列说法中正确的是( )A、红磷在氧气中能燃烧,在空气中不能燃烧 B、硫在氧气中燃烧后生成有刺激性气味的气体 C、镁条在氧气中燃烧时,火星四射,生成黑色固体 D、木炭伸入盛有氧气的集气瓶中剧烈燃烧,发出白光5. 下列反应中,反应前后元素的化合价没有发生变化的是( )A、Fe+CuSO4=FeSO4+Cu B、 C、MgCl2+2NaOH=Mg(OH)2↓+2NaCl D、6. 下列化学方程式符合题意且书写正确的是( )A、不能用铁制容器配制波尔多液:2Fe+3CuSO4═Fe2(SO4)3+3Cu B、证明铜的活动性比银强:Cu+2AgCl═CuCl2+2Ag C、医疗上用氢氧化镁中和胃酸过多:Mg(OH)2+H2SO4═MgSO4+2H2O D、炼铁时用一氧化碳还原氧化铁:Fe2O3+3CO 2Fe+3CO27. 在天平两边的托盘上各放一个质量相等的烧杯,并分别加入等质量、等质量分数的足量的稀盐酸,天平平衡。若向左盘烧杯中加入100 g碳酸钙,充分反应后,要想使天平重新平衡,应向右盘烧杯中加入的物质可能是( )①56 g Zn和Fe2O3的混合物 ②100 g MgCO3和Al的混合物 ③84g Mg和Fe的混合物 ④100 g BaCO3和Cu的混合物
A、①③ B、② C、②④ D、③④8. 比较、推理是化学学习常用的方法,以下是根据一些反应事实推导出的影响化学反应的因素,其中推理不合理的是( )序号
化学反应事实
影响反应的因素
A
铁丝在空气中很难燃烧,而在氧气中能剧烈燃烧
反应物浓度
B
碳常温下不与氧气发生反应,而在点燃时能与氧气反应
反应温度
C
双氧水在常温下较难分解,而加入二氧化锰后迅速分解
催化剂
D
铜片在空气中很难燃烧,铜粉在空气中较易燃烧
反应物的种类
A、A B、B C、C D、D9.图中甲、乙、丙三个椭圆分别代表某个概念、某种属性或某类物质,能构成图示关系的是( )
 A、甲是杠杆、乙是滑轮、丙是简单机械 B、甲是群落、乙是种群、丙是生态系统 C、甲是地月系、乙是太阳系、丙是银河系 D、甲是化合反应、乙是分解反应、丙是置换反应10. 一定条件下,甲、乙、丙、丁四种物质在密闭容器中反应,测得反应前后各物质的质量分数如图所示,下列说法正确的是( )
A、甲是杠杆、乙是滑轮、丙是简单机械 B、甲是群落、乙是种群、丙是生态系统 C、甲是地月系、乙是太阳系、丙是银河系 D、甲是化合反应、乙是分解反应、丙是置换反应10. 一定条件下,甲、乙、丙、丁四种物质在密闭容器中反应,测得反应前后各物质的质量分数如图所示,下列说法正确的是( )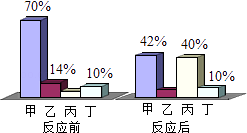 A、丁是该反应的催化剂 B、参与反应的乙、丙质量比为3:17 C、该反应的基本类型是分解反应 D、参与反应的甲、丙质量比为7:1011.
A、丁是该反应的催化剂 B、参与反应的乙、丙质量比为3:17 C、该反应的基本类型是分解反应 D、参与反应的甲、丙质量比为7:1011.如图所示,把同样大小的滤纸碎片和乒乓球碎片分开放在一块薄铜片的两侧,加热铜片的中部,下列实验现象或结论错误的是( )
 A、实验中使用铜片,是利用了铜的导热性 B、实验说明燃烧的条件之一是物质必须是可燃物 C、铜片受热的一面变黑,是因为产生了CuO D、实验过程中乒乓球碎片先燃烧,滤纸碎片后燃烧12.
A、实验中使用铜片,是利用了铜的导热性 B、实验说明燃烧的条件之一是物质必须是可燃物 C、铜片受热的一面变黑,是因为产生了CuO D、实验过程中乒乓球碎片先燃烧,滤纸碎片后燃烧12.如图,甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列有关说法正确的是( )
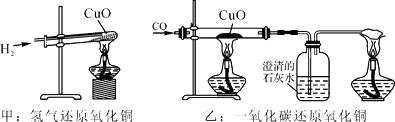 A、甲实验试管口向下倾斜可防止生成的水倒流,也有利于将试管内的空气完全排出 B、乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生 C、甲、乙两实验中,都应先使试管、玻璃管均匀受热,再通入气体,以防止发生爆炸 D、甲、乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生了置换反应13. 在试管甲中放入15g氯酸钾,试管乙中放入15g氯酸钾和一定量MnO2 , 分别加热并充分反应。下图对该实验产生气体的质量与反应时间的关系,合理的是( )A、
A、甲实验试管口向下倾斜可防止生成的水倒流,也有利于将试管内的空气完全排出 B、乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生 C、甲、乙两实验中,都应先使试管、玻璃管均匀受热,再通入气体,以防止发生爆炸 D、甲、乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生了置换反应13. 在试管甲中放入15g氯酸钾,试管乙中放入15g氯酸钾和一定量MnO2 , 分别加热并充分反应。下图对该实验产生气体的质量与反应时间的关系,合理的是( )A、 B、
B、 C、
C、 D、
D、 14.
14.甲、乙两烧杯内盛有等质量、等质量分数的盐酸.将镁逐渐加入甲烧杯,铁逐渐加入乙烧杯,测量加入的金属质量m和相应的烧杯内物质质量变化量△m,画出△M﹣m曲线oac和obc的示意图,如图所示.根据图中信息,下列说法错误的是( )
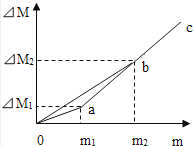 A、m1:m2=3:7 B、m1﹣△M1<m2﹣△M2 C、曲线oac表示的是甲烧杯中△M与m的变化关系 D、当乙烧杯内加入铁的质量为m1时,溶液中溶质不止一种
A、m1:m2=3:7 B、m1﹣△M1<m2﹣△M2 C、曲线oac表示的是甲烧杯中△M与m的变化关系 D、当乙烧杯内加入铁的质量为m1时,溶液中溶质不止一种二、填空题
-
15. 为适应火车提速,铁路上原有的短轨已全部连接为超长轨,工程技术人员常用铝粉和氧化铁粉在高温条件使之反应,产生成铁和氧化铝,生成红热的铁水来填充缝隙,请写出该反应的化学方程式: , 推测该反应在一定条件下能进行的理由 .16.
中国科研人员首次在自然界中发现金属铀.金属铀和二氧化铀按要求制成一定尺寸和形状的燃料棒或燃料块,就可以投入核反应堆使用.此反应堆活动核能的途径是(选填“裂化”或“聚变”).目前工业上的金属铀可用四氟化铀(UF4)和镁通过热还原法来制备,化学方程式为UF4+2Mg
 U+2MgF2 , 此反应属于基本反应类型中的反应.17. 某化学兴趣小组的同学为了测定某厂生产的纯碱是否属于优等品(国家规定:优等品中碳酸钠的质量分数不低于99.2%),设计如下两种实验方案:
U+2MgF2 , 此反应属于基本反应类型中的反应.17. 某化学兴趣小组的同学为了测定某厂生产的纯碱是否属于优等品(国家规定:优等品中碳酸钠的质量分数不低于99.2%),设计如下两种实验方案:方案一:称取样品10.65g,加水完全溶解,向其中加入足量的氯化钡溶液,充分反应后,过滤、洗涤、干燥得固体19.70g.通过计算(写出计算过程)判断该厂的产品是否属于优等品.(杂质可溶于水且不与氯化钡反应)
方案二:用如图所示的装置,通过准确测量排出水的体积,也可计算样品的纯度.该装置中仪器A的名称是 , 但实验后同学们发现所测的碳酸钠的纯度偏低,造成此结果的原因可能是 . (装置气密性良好)
 18. 推理是学习化学的一种重要方法,但不合理的推理会得出错误的结论,请写出下列错误观点的否定例证(用化学式或化学方程式表示)
18. 推理是学习化学的一种重要方法,但不合理的推理会得出错误的结论,请写出下列错误观点的否定例证(用化学式或化学方程式表示)错误观点
否定例证
例
有单质和化合物生成的反应一定是置换反应
CO+CuOCu+CO2
①
金属单质都具有银白色金属光泽
②
含氧元素的化合物一定是氧化物
③
有氧气参加的反应一定是化合反应
三、探究题
-
19. 以下是俄国化学家罗蒙诺索夫曾开展的实验:
①先用天平称取质量为m1的金属锡粉.
②将这些锡粉放在密闭容器里进行完全燃烧,生成了白色固体物质,称量容器的总质量为m2 .
③打开容器,听到了空气进入容器发出的“丝丝的声响”,称量所得白色物质的质量为m3 .
④把白色物质放回原容器里(容器中空气的组成恢复到初始状态),重新称量容器的总质量为m4
(1)、根据所学知识判断,锡的燃烧是变化.(2)、罗蒙诺索夫分析数据后发现,生成白色物质的质量m3= , 于是提出了“参加反应的物质的总质量,等于反应后产物的总质量”的观点.(3)、后经多位科学家的共同努力,最终确立了质量守恒定律,请从微观角度解释该定律: .20.小黄用如图装置测定铜锌合金中锌的质量分数和锌的相对原子质量。主要实验步骤如下(必要的固定装置已略去)。

①连接装置并检查装置气密性;
②加入药品和水;
③记录C中液面刻度(C为带有刻度的玻璃管);
④由A向B中滴加试剂至过量;
⑤待B中不再有气体产生并恢复至室温后,记录C中液面刻度,计算得到气体的体积为V mL(该气体密度为ρg/L;
⑥将B中剩余固体过滤、洗涤、干燥并称重,称得剩余固体质量为W g
根据题意完成下列问题。
(1)、B中发生反应的化学方程式为(2)、如何检验该装置的气密性(3)、小黄发现实验中由于缺少某一步骤导致数据缺乏而无法计算,该步骤是四、综合题
-
21. 央视《每周质量报告》报道的“毒胶囊”中含有重铬酸钾(K2Cr2O7),重铬酸钾是有毒且致癌的强氧化剂,其中铬(Cr)是有毒的重金属元素。请回答:(1)、Cr2O72-离子中铬元素的化合价为 。(2)、取一铬的薄片,用砂纸打磨光亮,放入稀硫酸中,发生了类似铁和稀硫酸的反应,可观察到铬片表面缓慢地产生气泡,溶液变蓝;铬与稀硫酸反应生成硫酸亚铬(CrSO4),硫酸亚铬溶于水呈蓝色。请写出铬片与稀硫酸反应的化学方程式。22.
如图所示,R是滑动变阻器,它的金属滑片垂直固定在等臂金属杠杆的中央且可以随杠杆左右移动。杠杆两端分别悬挂等质量、等体积的金属锌球,此时杠杆平衡。再将铁球同时分别浸没到密度相同的稀硫酸和硫酸铜溶液中。反应一段时间后会观察到:
 (1)、杠杆右端的锌球表面有色物质生成。(2)、此时的杠杆平衡情况为 , 灯泡L的亮暗情况为。23.
(1)、杠杆右端的锌球表面有色物质生成。(2)、此时的杠杆平衡情况为 , 灯泡L的亮暗情况为。23.小金为了探究温度对H2O2分解反应速率的影响,借助如图所示实验装置(夹持装置略去),进行了两次实验,两次实验的部分设计如表所示:
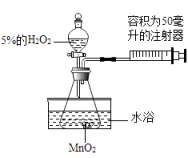
实验1
实验2
MnO2的质量/克
0.5
0.5
5%的H2O2的体积/毫升
40
待填
水浴温度/℃
20
80
(1)、实验2中应加入5%H2O2毫升;(2)、在两次实验中,可通过来比较H2O2分解反应速率的大小;(3)、实验2中水浴温度控制在80℃时,测定的反应速率会比真实值偏大,其原因除锥形瓶内气体受热膨胀外,还有;(4)、实验结束后若要将MnO2从混合物汇总分离出来,可采取的方法是 .24. 《奔跑吧 兄弟》是一档热播的娱乐节目,其中蕴含着许多化学知识。(1)、节目最刺激的游戏是“撕名牌”。“名牌”是贴在队员衣服后面,标有自己姓名的标牌,制作材料有棉布、塑料等。塑料属于(填“有机化合物”或“无机化合物”);鉴别棉布和涤纶布的方法是;(2)、其中一期节目,队员用水枪将酚酞溶液喷射到对方的“名牌”上,立即变红色。事先浸泡“名牌”的溶液可能是___________;A、白酒 B、柠檬酸 C、食盐溶液 D、纯碱溶液(3)、另一期节目,蓝色的“污水”中注入“神秘水”后立即变得澄清透明。“污水”是单宁酸和硫酸亚铁溶液混合后发生一系列化学反应形成的,加入无色的“神秘水”草酸后,污水变澄清。其中的一个反应为2C76H49O46Fe+H2C2O4
 2C76H50O46Fe+2X,则X的化学式为;草酸(H2C2O4)中碳元素的化合价为。25. 利用所学知识完成下面两个小题:(1)、化学中把物质与水发生的复分解反应称为水解反应。例如:Al2S3+6H2O=2Al(OH)3+3H2S↑。 利用上述信息,写出以下反应的化学方程式:
2C76H50O46Fe+2X,则X的化学式为;草酸(H2C2O4)中碳元素的化合价为。25. 利用所学知识完成下面两个小题:(1)、化学中把物质与水发生的复分解反应称为水解反应。例如:Al2S3+6H2O=2Al(OH)3+3H2S↑。 利用上述信息,写出以下反应的化学方程式:Mg3N2固体与水反应:
Al4C3与稀硫酸反应:
(2)、化学上认为反应前后元素化合价有变化的反应叫氧化还原反应,把元素化合价升高的反应物叫还原剂,把元素化合价降低的反应物叫氧化剂,例如反应:CuSO4+Fe=Cu+FeSO4 , 其中Fe作还原剂,CuSO4作氧化剂。过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。现有下列反应:A.Na2O2+2HCl=2NaCl+H2O2 B.Cl2+H2O2=O2+2HCl
C.2H2O2=2H2O+O2↑ D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
上述反应中,H2O2只作氧化剂的反应是(填代号,下同) , H2O2既作氧化剂又作还原剂的反应是。