2015-2016学年云南省保山市腾冲八中高一下学期期中化学试卷(理科)
试卷更新日期:2017-04-01 类型:期中考试
一、选择题
-
1. 下列关于环境问题的说法正确的是( )A、pH在5.6~7.0之间的降水通常称为酸雨 B、臭氧的体积分数超过10﹣4%的空气有利于人体健康 C、燃煤时加入适量的石灰石,可减少废气中SO2的量 D、含磷合成洗涤剂易于被细菌分解,故不会导致水体污染2. 下列反应既是氧化还原反应,又是放热反应的是( )A、铝与稀盐酸的反应 B、Ba(OH)2•8H2O与NH4Cl的反应 C、灼热的碳与二氧化碳的反应 D、NaOH与HCl的反应3. 下列元素属于过度元素的是( )A、钾 B、镓 C、铁 D、钋4. 用NA表示阿伏加德罗常数,下列叙述正确的是( )A、标准状况下,22.4LH2O含有的分子数为1 NA B、常温常压下,10.6g Na2CO3含有的Na+离子数为0.2 NA C、通常状况下,1 NA 个CO2分子占有的体积为22.4L D、物质的量浓度为0.5mol•/L的MgCl2溶液中,含有Cl﹣ 个数为1 NA5. 除去蛋白质溶液中混入的少量氯化钠,采用的方法是( )A、过滤 B、电泳 C、渗析 D、分液6. 下列化合物中能量最低的是( )A、HF B、H2O C、H2S D、CH47. 在一定温度下,下列叙述是可逆反应A(g)+3B(g)⇌2C(g)达到平衡的标志的是( )A、正反应速率与逆反应速率相等且为零 B、A,B,C的浓度不再变化 C、A,B,C的物质的量相等 D、A,B,C的分子数目比为1:3:28. 某金属能与盐酸反应产生氢气,该金属与锌组成的原电池中,锌为负极.该金属为( )A、铝 B、铜 C、铁 D、镁9. 下列离子方程式中正确的是( )A、铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ B、碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ C、醋酸跟氢氧化钾溶液反应:CH3COOH+OH﹣=CH3COO﹣+H2O D、碳酸镁跟稀硫酸反应:CO32﹣+2H+=Mg2++H2O+CO2↑10. 某元素最高正价氧化物对应的水化物的化学式是H2XO4 , 这种元素的气态氢化物的化学式为( )A、HX B、H2X C、XH3 D、XH411. 下列说法正确的是( )A、Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 B、H2O2、Na2O2、SO2都具有漂白性且漂白原理相同 C、饱和Na2CO3溶液中通入CO2溶液会变浑浊 D、可用石灰水吸收尾气中的SO2气体12. 下列各组元素性质或原子结构的递变,叙述不正确的是( )A、Na、Mg、Al原子最外层电子数依次增多 B、P、S、Cl元素最高正化合价依次增大 C、Li、Na、K的电子层数依次增多 D、N、O、F得电子能力依次减弱13. 已知气体的摩尔质量越小,扩散速度越快.如图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环.下列关于甲、乙的判断正确的是( )
 A、甲是浓氨水,乙是浓硫酸 B、甲是浓盐酸,乙是浓氨水 C、甲是浓氨水,乙是浓盐酸 D、甲是浓硝酸,乙是浓氨水14. 在碱性溶液中能大量共存且溶液为无色透明的离子组是( )A、K+、MnO4﹣、Na+、Cl﹣ B、K+、Na+、NO3﹣、CO32﹣ C、Na+、H+、NO3﹣、SO42﹣ D、Fe3+、Na+、Cl﹣、SO42﹣15. 下列有关物质的性质与应用相对应的是( )A、Cl2具有漂白性,可用作自来水的消毒 B、SiO2具有高沸点,可用作制备光导纤维 C、NH3具有还原性,可用作制冷剂 D、Na2O2能与CO2反应,可用作潜水艇内的供氧剂16. 在下列溶液中通入CO2至过量,原溶液一直保持澄清的是( )A、硅酸钠溶液 B、氯化钡溶液 C、石灰水 D、漂白粉溶液17. 在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质.下列实验现象和结论一致且正确的是( )A、加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在 B、溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在 C、先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl﹣存在 D、加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在18. 下列反应中,能证明SiO2是酸性氧化物的是( )A、SiO2+2C═Si+2CO↑ B、SiO2+2NaOH═Na2SiO3+H2O C、SiO2+4HF═SiF4↑+2H2O D、SiO2+CaCO3═CaSiO3+CO2↑19. 只用一种试剂就可将AgNO3、KSCN和H2SO4、NaOH四种无色溶液区分,这种试剂是( )A、Fe(NO3)3溶液 B、FeCl2溶液 C、BaCl2溶液 D、FeCl3溶液20. 下列物质能由两种单质直接化合得到的是( )A、FeCl2 B、CuS C、NO2 D、SO221. 下列说法正确的是( )A、常温下可用铁制容器来盛装浓硫酸、说明常温下铁与浓硫酸不反应 B、同一元素的各种同位素的物理性质不同、化学性质相同 C、金属元素的原子只有还原性,离子只有氧化性 D、取碘水于试管中,加入汽油振荡后静置,其现象为下层呈紫红色22. 随着人们生活节奏的加快,方便的小包装食品已被广泛接受.为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是( )A、无水硫酸铜、蔗糖 B、硅胶(具有吸湿性)、硫酸亚铁 C、食盐、硫酸亚铁 D、生石灰、食盐23. 有关电解质的说法正确的是( )A、纯水不导电,所以水不是电解质 B、SO3水溶液的导电性很强,所以SO3是电解质 C、液态的铜导电性很好,所以铜是电解质 D、Na2O液态时能导电,所以Na2O是电解质24. 稀硫酸中插一块铜片,加入下列物质后,可使铜片迅速发生反应的是( )A、稀盐酸 B、硫酸钠晶体 C、硝酸钾晶体 D、氯化钠晶体25. 在2A+B⇌3C+4D反应中,表示该反应速率最快的是( )A、v(A)=0.5 mol•L﹣1•s﹣1 B、v(B)=0.3 mol•L﹣1•s﹣1 C、v(C)=0.8 mol•L﹣1•s﹣1 D、v(D)=1 mol•L﹣1•s﹣1
A、甲是浓氨水,乙是浓硫酸 B、甲是浓盐酸,乙是浓氨水 C、甲是浓氨水,乙是浓盐酸 D、甲是浓硝酸,乙是浓氨水14. 在碱性溶液中能大量共存且溶液为无色透明的离子组是( )A、K+、MnO4﹣、Na+、Cl﹣ B、K+、Na+、NO3﹣、CO32﹣ C、Na+、H+、NO3﹣、SO42﹣ D、Fe3+、Na+、Cl﹣、SO42﹣15. 下列有关物质的性质与应用相对应的是( )A、Cl2具有漂白性,可用作自来水的消毒 B、SiO2具有高沸点,可用作制备光导纤维 C、NH3具有还原性,可用作制冷剂 D、Na2O2能与CO2反应,可用作潜水艇内的供氧剂16. 在下列溶液中通入CO2至过量,原溶液一直保持澄清的是( )A、硅酸钠溶液 B、氯化钡溶液 C、石灰水 D、漂白粉溶液17. 在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质.下列实验现象和结论一致且正确的是( )A、加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在 B、溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在 C、先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl﹣存在 D、加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在18. 下列反应中,能证明SiO2是酸性氧化物的是( )A、SiO2+2C═Si+2CO↑ B、SiO2+2NaOH═Na2SiO3+H2O C、SiO2+4HF═SiF4↑+2H2O D、SiO2+CaCO3═CaSiO3+CO2↑19. 只用一种试剂就可将AgNO3、KSCN和H2SO4、NaOH四种无色溶液区分,这种试剂是( )A、Fe(NO3)3溶液 B、FeCl2溶液 C、BaCl2溶液 D、FeCl3溶液20. 下列物质能由两种单质直接化合得到的是( )A、FeCl2 B、CuS C、NO2 D、SO221. 下列说法正确的是( )A、常温下可用铁制容器来盛装浓硫酸、说明常温下铁与浓硫酸不反应 B、同一元素的各种同位素的物理性质不同、化学性质相同 C、金属元素的原子只有还原性,离子只有氧化性 D、取碘水于试管中,加入汽油振荡后静置,其现象为下层呈紫红色22. 随着人们生活节奏的加快,方便的小包装食品已被广泛接受.为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是( )A、无水硫酸铜、蔗糖 B、硅胶(具有吸湿性)、硫酸亚铁 C、食盐、硫酸亚铁 D、生石灰、食盐23. 有关电解质的说法正确的是( )A、纯水不导电,所以水不是电解质 B、SO3水溶液的导电性很强,所以SO3是电解质 C、液态的铜导电性很好,所以铜是电解质 D、Na2O液态时能导电,所以Na2O是电解质24. 稀硫酸中插一块铜片,加入下列物质后,可使铜片迅速发生反应的是( )A、稀盐酸 B、硫酸钠晶体 C、硝酸钾晶体 D、氯化钠晶体25. 在2A+B⇌3C+4D反应中,表示该反应速率最快的是( )A、v(A)=0.5 mol•L﹣1•s﹣1 B、v(B)=0.3 mol•L﹣1•s﹣1 C、v(C)=0.8 mol•L﹣1•s﹣1 D、v(D)=1 mol•L﹣1•s﹣1二、解答题
-
26. A、B、C、D是四种短周期元素,A元素所在的周期数、主族序数和原子序数均相等;B原子的最外层电子数是次外层电子数的3倍;C是第三周期原子半径最大的元素;D的单质工业上用于制漂白粉,也用于自来水的消毒.用元素符号或化学式回答下列问题:(1)、C元素在周期表中的位置 , D的单质与水反应的离子方程式为 .(2)、C的离子结构示意图为 , A、B、C形成的化合物的电子式为 .(3)、B、C形成的化合物可用作供氧剂,写出供氧时发生的化学方程式: .27. 现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相,甲、乙两元素相比较,金属性较强的是(填名称),可以验证该结论的实验是 .
A、将在空气中放置已久的这两种元素的块状单质分别放入热水中
B、将这两种元素的单质粉末分别和同浓度的盐酸反应
C、将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
D、比较这两种元素的气态氢化物的稳定性.
28. 按要求回答下列问题: (1)、若电流表的指针偏向B,则A为极,B为极(2)、若电流表G发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液.则A、B、C分别为A、A是Zn,B是Cu,C是稀硫酸 B、A是Cu,B是Zn,C是稀硫酸 C、A是Fe,B是Ag,C是稀AgNO3溶液 D、A是Ag,B是Fe,C是稀AgNO3溶液(3)、若电解质溶液是稀硫酸,按此图组装后,观察到A极不断的溶解,B极有气泡冒出,则A,B的金属性强弱为(4)、任何一个自发的氧化还原反应都可以设计为原电池,若该电池中发生的反应为:Fe+2FeCl3═3FeCl2 , A电极为铁,则B电极为 .29. 如图为氢氧燃料电池原理示意图,按照此图的提示,回答下列问题
(1)、若电流表的指针偏向B,则A为极,B为极(2)、若电流表G发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液.则A、B、C分别为A、A是Zn,B是Cu,C是稀硫酸 B、A是Cu,B是Zn,C是稀硫酸 C、A是Fe,B是Ag,C是稀AgNO3溶液 D、A是Ag,B是Fe,C是稀AgNO3溶液(3)、若电解质溶液是稀硫酸,按此图组装后,观察到A极不断的溶解,B极有气泡冒出,则A,B的金属性强弱为(4)、任何一个自发的氧化还原反应都可以设计为原电池,若该电池中发生的反应为:Fe+2FeCl3═3FeCl2 , A电极为铁,则B电极为 .29. 如图为氢氧燃料电池原理示意图,按照此图的提示,回答下列问题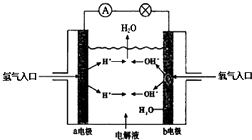 (1)、a电极为极,b电极为极(2)、写出该电池的电极反应:负极:正极:30. 根据反应Br+H2⇌HBr+H的能量对反应历程的示意图甲进行判断,该反应为反应(填“吸热”或“放热”)
(1)、a电极为极,b电极为极(2)、写出该电池的电极反应:负极:正极:30. 根据反应Br+H2⇌HBr+H的能量对反应历程的示意图甲进行判断,该反应为反应(填“吸热”或“放热”) 31. 为除去粗盐中的Ca2+、Mg2+、SO42﹣以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
31. 为除去粗盐中的Ca2+、Mg2+、SO42﹣以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)称取粗盐 滤液 粗盐 第①步的操作是 , 第⑤步的操作是 .
32.在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.请回答该实验中的问题.

写出该反应的反应方程式;并指明该氧化还原反应的还原产物是 , 氧化产物是 .
33. 为了验证木炭可被浓H2SO4氧化成CO2 , 选用下图所示仪器(内含物质)组装成实验装置: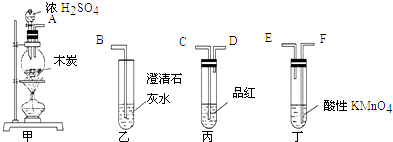 (1)、如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):接 , 接 , 接;(2)、仪器乙、丙应有怎样的实验现象才表明已检验出CO2?乙中 , 丙中;(3)、丁中酸性KMnO4溶液的作用是;(4)、写出甲中反应的化学方程式 .
(1)、如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):接 , 接 , 接;(2)、仪器乙、丙应有怎样的实验现象才表明已检验出CO2?乙中 , 丙中;(3)、丁中酸性KMnO4溶液的作用是;(4)、写出甲中反应的化学方程式 .