2015-2016学年山东省德州市武城二中高一下学期期中化学试卷
试卷更新日期:2017-03-31 类型:期中考试
一、选择题
-
1. 下列各组元素中,属于同一周期的是( )A、H、Na B、Al、P C、O、Cl D、Mg、F2. 下列设备工作时,将化学能转化为热能的是( )A、
 硅太阳能电池
B、
硅太阳能电池
B、 锂离子电池
C、
锂离子电池
C、 太阳能集热器
D、
太阳能集热器
D、 燃气灶
3. 下列关于反应速率的说法中,错误的是( )A、反应速率用于衡量化学反应的快慢 B、决定反应速率的主要因素是反应物的性质 C、可逆反应达到化学平衡时,正、逆反应速率都为零 D、化学反应中,纯液体物质不能计算其速率4. X元素原子的质量数为m,核内中子数为n,则wgx+含有电子的物质的量是( )A、(m﹣n)w/m mol B、(m﹣n﹣1)w/m mol C、(m+n)w/m mol D、(m﹣n+1)w/m mol5. 下列各项比较错误的是( )A、微粒半径:r(Na+)>r(Mg2+)>r(Al3+) B、酸性强弱:HClO>H2SO3>H3PO4 C、稳定性:HF>H2O>H2S D、碱性强弱:Pb(OH)4>Sn(OH)4>Ge(OH)46. 将0.1mol N2和0.3mol H2置于密闭容器中发生反应N2+3H2⇌2NH3下列关于该反应的说法中正确的是( )A、反应物所具有的总能量等于生成物所具有的总能量 B、最终可生成0.2 mol NH3 C、反应达平衡后,使用催化剂,不能使平衡向右移动 D、当n(N2):n(H2)=1:3时,一定达化学平衡7. 下列哪一组元素的原子间反应容易形成离子键( )
燃气灶
3. 下列关于反应速率的说法中,错误的是( )A、反应速率用于衡量化学反应的快慢 B、决定反应速率的主要因素是反应物的性质 C、可逆反应达到化学平衡时,正、逆反应速率都为零 D、化学反应中,纯液体物质不能计算其速率4. X元素原子的质量数为m,核内中子数为n,则wgx+含有电子的物质的量是( )A、(m﹣n)w/m mol B、(m﹣n﹣1)w/m mol C、(m+n)w/m mol D、(m﹣n+1)w/m mol5. 下列各项比较错误的是( )A、微粒半径:r(Na+)>r(Mg2+)>r(Al3+) B、酸性强弱:HClO>H2SO3>H3PO4 C、稳定性:HF>H2O>H2S D、碱性强弱:Pb(OH)4>Sn(OH)4>Ge(OH)46. 将0.1mol N2和0.3mol H2置于密闭容器中发生反应N2+3H2⇌2NH3下列关于该反应的说法中正确的是( )A、反应物所具有的总能量等于生成物所具有的总能量 B、最终可生成0.2 mol NH3 C、反应达平衡后,使用催化剂,不能使平衡向右移动 D、当n(N2):n(H2)=1:3时,一定达化学平衡7. 下列哪一组元素的原子间反应容易形成离子键( )原子
a
b
c
d
e
f
g
M层电子数
1
2
3
4
5
6
7
A、a和c B、a和f C、d和g D、e和g8. 在如图所示的原电池中,下列说法正确的是( ) A、铜极上发生氧化反应 B、正极反应为:Cu﹣2e﹣=Cu2+ C、电子由铜片通过导线流向锌片 D、反应一段时间后,溶液的酸性减弱9. 某粒子的结构示意图为
A、铜极上发生氧化反应 B、正极反应为:Cu﹣2e﹣=Cu2+ C、电子由铜片通过导线流向锌片 D、反应一段时间后,溶液的酸性减弱9. 某粒子的结构示意图为 ,关于该粒子的说法正确的是( ) A、核电荷数为18 B、核外有3个电子层 C、属于非金属元素的原子 D、在化学反应中易得2个电子10. 下列说法正确的是( )A、离子键就是使阴、阳离子结合成化合物的静电引力 B、在化合物Na2O2中,阴、阳离子的个数比为1:1 C、在化合物CaCl2中,两个氯离子之间存在共价键 D、液态HCl不能导电,属于共价化合物11. 结合元素周期表和周期律的相关知识,判断下列说法正确的是( )A、短周期主族元素原子的最外层电子数都等于元素的最高化合价 B、多电子原子中,在离核较近的区域内运动的电子能量较高 C、同周期第ⅡA族与第ⅢA族的元素原子序数之差不一定为1 D、元素周期表中位于金属和非金属分界线附近的元素属于过渡元素12. 下列化学用语表示不正确的是( )A、钠离子的结构示意图:
,关于该粒子的说法正确的是( ) A、核电荷数为18 B、核外有3个电子层 C、属于非金属元素的原子 D、在化学反应中易得2个电子10. 下列说法正确的是( )A、离子键就是使阴、阳离子结合成化合物的静电引力 B、在化合物Na2O2中,阴、阳离子的个数比为1:1 C、在化合物CaCl2中,两个氯离子之间存在共价键 D、液态HCl不能导电,属于共价化合物11. 结合元素周期表和周期律的相关知识,判断下列说法正确的是( )A、短周期主族元素原子的最外层电子数都等于元素的最高化合价 B、多电子原子中,在离核较近的区域内运动的电子能量较高 C、同周期第ⅡA族与第ⅢA族的元素原子序数之差不一定为1 D、元素周期表中位于金属和非金属分界线附近的元素属于过渡元素12. 下列化学用语表示不正确的是( )A、钠离子的结构示意图: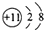 B、氢氧根离子的电子式:
B、氢氧根离子的电子式:  C、原子核内有20个中子的氯原子: Cl
D、Na2O与Na2O2中阳离子与阴离子个数比分别为2:1和1:1
13. 可以将反应E+B2+=E2++B设计成原电池,下列4个电极反应:
C、原子核内有20个中子的氯原子: Cl
D、Na2O与Na2O2中阳离子与阴离子个数比分别为2:1和1:1
13. 可以将反应E+B2+=E2++B设计成原电池,下列4个电极反应:①B﹣2e﹣=B2+
②E﹣2e﹣=E2+
③B2++2e﹣=B
④E2++2e﹣=E
其中表示负极反应和正极反应的分别是( )
A、②和③ B、②和① C、③和① D、④和①14. 4A(s)+3B(g)═2C(g)+D(g),经2min后B的浓度减少0.6mol•L﹣1 . 对此反应速率的表示正确的是( )A、用A表示的反应速率是0.4mol•L﹣1•min﹣1 B、分别用B,C,D表示反应速率,其比值是3:2:1 C、在2min末的反应速率,用B表示是0.3mol•L﹣1•min﹣1 D、在2min内的反应速率,用C表示是0.3mol•L﹣1•min﹣115. 下列能说明氯元素原子得电子能力比硫强的是( )①HCl的溶解度比H2S大
②HCl溶液的酸性比H2S溶液强
③HCl的稳定性比H2S强
④还原性:Cl﹣<S2﹣
⑤HClO的酸性比H2SO4强
⑥Cl2能与H2S反应生成S
⑦Cl2与铁反应生成FeCl3 , 而S与铁反应生成FeS.
A、①③④⑤ B、②④⑥⑦ C、③④⑥⑦ D、全部16. 如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是( )M
N
P
A
锌
铜
稀硫酸溶液
B
铜
铁
稀盐酸溶液
C
银
锌
硝酸银溶液
D
锌
铁
硝酸铁溶液
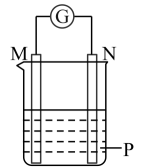 A、A B、B C、C D、D17. 有以下四种微粒14N、15N、N2、N4(结构为
A、A B、B C、C D、D17. 有以下四种微粒14N、15N、N2、N4(结构为 ),已知断裂1mol N﹣N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( ) A、14N2与15N2互为同位素,N4与N2互为同素异形体 B、N4属于一种新型的化合物 C、14N与15N化学性质不相同 D、1mol N4气体完全转变为N2将放出882kJ热量18. 短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是( )
),已知断裂1mol N﹣N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( ) A、14N2与15N2互为同位素,N4与N2互为同素异形体 B、N4属于一种新型的化合物 C、14N与15N化学性质不相同 D、1mol N4气体完全转变为N2将放出882kJ热量18. 短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是( )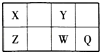 A、钠与W可能形成Na2W2化合物 B、由Z与Y组成的物质在熔融时能导电 C、W得电子能力比Q强 D、X有多种同素异形体,而Y不存在同素异形体19. 在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)⇌2Z(g),此反应达到平衡的标志是( )A、容器内气体密度不随时间变化 B、v(X):v(Y)=1:2 C、容器内X、Y、Z的浓度不随时间变化 D、单位时间消耗0.1molX同时生成0.2molZ20. 表为几种短周期元素的性质,有关说法正确的是( )
A、钠与W可能形成Na2W2化合物 B、由Z与Y组成的物质在熔融时能导电 C、W得电子能力比Q强 D、X有多种同素异形体,而Y不存在同素异形体19. 在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)⇌2Z(g),此反应达到平衡的标志是( )A、容器内气体密度不随时间变化 B、v(X):v(Y)=1:2 C、容器内X、Y、Z的浓度不随时间变化 D、单位时间消耗0.1molX同时生成0.2molZ20. 表为几种短周期元素的性质,有关说法正确的是( )元素编号
①
②
③
④
⑤
⑥
⑦
⑧
原子半径(10﹣1nm)
0.74
1.60
1.52
1.10
0.99
1.86
0.75
0.82
最高化合价
+2
+1
+5
+7
+1
+5
+3
最低化合价
﹣2
﹣3
﹣1
﹣3
A、上述八种元素中,最高价氧化物对应水化物的酸性最强的是元素⑤ B、③④处于同一周期 C、元素⑤的氢化物沸点高于元素①的氢化物 D、⑧号元素位于周期表中第三周期第ⅢA族21. 下列微粒中:①13Al3+②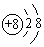 ③
③ 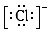 ④F﹣ , 其核外电子数相同的是( ) A、①②③ B、②③④ C、①②④ D、①③④22. 已知A,B,C,D,E是短周期中原子序数一次增大5种主族元素,其中元素A,E的单 质常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料,下列说法正确的是( )A、原子半径:A<B<C<D<E B、化合物AE与CE含有相同类型的化学键 C、金属性:D>C D、D单质能够溶解于C的最高价氧化物对应的水化物
④F﹣ , 其核外电子数相同的是( ) A、①②③ B、②③④ C、①②④ D、①③④22. 已知A,B,C,D,E是短周期中原子序数一次增大5种主族元素,其中元素A,E的单 质常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料,下列说法正确的是( )A、原子半径:A<B<C<D<E B、化合物AE与CE含有相同类型的化学键 C、金属性:D>C D、D单质能够溶解于C的最高价氧化物对应的水化物二、非选择题
-
23. 元素周期表的一部分如图,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
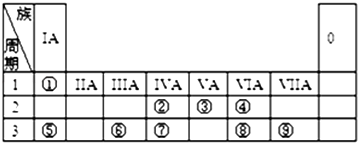 (1)、已知②的一种核素中子数为8,则其气态氢化物的摩尔质量为(2)、①②⑤⑥的原子半径由大到小的顺序为(填元素符号);⑦⑧⑨的最高价含氧酸的酸性由强到弱的顺序是(填化学式): .(3)、⑥的最高价氧化物可以与⑤的最高价氧化物对应水化物的溶液能发生反应,该反应的化学方程式为:(4)、X、Y是中学化学中的常见物质,X、Y分别由元素④、⑤和②、④组成,X与Y的反应是潜水艇和呼吸面具中氧气的来源.X的电子式是 , Y中含有的化学键类型是 .(5)、某研究性学习小组设计了一组实验来探究元素周期律.甲同学设计了如图装置来一次性完成的②、⑦非金属性强弱比较的实验研究.
(1)、已知②的一种核素中子数为8,则其气态氢化物的摩尔质量为(2)、①②⑤⑥的原子半径由大到小的顺序为(填元素符号);⑦⑧⑨的最高价含氧酸的酸性由强到弱的顺序是(填化学式): .(3)、⑥的最高价氧化物可以与⑤的最高价氧化物对应水化物的溶液能发生反应,该反应的化学方程式为:(4)、X、Y是中学化学中的常见物质,X、Y分别由元素④、⑤和②、④组成,X与Y的反应是潜水艇和呼吸面具中氧气的来源.X的电子式是 , Y中含有的化学键类型是 .(5)、某研究性学习小组设计了一组实验来探究元素周期律.甲同学设计了如图装置来一次性完成的②、⑦非金属性强弱比较的实验研究.
甲同学设计实验的依据是;其中装置B中所盛试剂的作用为;C中反应的离子方程式为 .
24. 实验填空题:实验室现要制取一瓶纯净干燥的氯气.现有如图仪器和药品可供使用: (1)、实验室制取氯气的原理:;其中HCl所表现的性质是 .(2)、连接上述仪器的正确顺序是(填各接口处的字母)接 , 接 , 接 , 接 .(3)、在以上装置中,分别盛装了一些溶液,试说明所装溶液的作用.饱和食盐水的作用是;浓硫酸的作用是;氢氧化钠的作用是 .(4)、盛装NaOH溶液的试剂瓶中发生的化学反应为: .25. 从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O.(1)、为了加快反应速率,不可以采取的措施有 (填序号,下同).
(1)、实验室制取氯气的原理:;其中HCl所表现的性质是 .(2)、连接上述仪器的正确顺序是(填各接口处的字母)接 , 接 , 接 , 接 .(3)、在以上装置中,分别盛装了一些溶液,试说明所装溶液的作用.饱和食盐水的作用是;浓硫酸的作用是;氢氧化钠的作用是 .(4)、盛装NaOH溶液的试剂瓶中发生的化学反应为: .25. 从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O.(1)、为了加快反应速率,不可以采取的措施有 (填序号,下同).A.使用催化剂 B.提高氧气的浓度
C.提高反应的温度 D.降低反应的温度
(2)、已知该反应为放热反应,如图能正确表示该反应中能量变化的是
 (3)、从断键和成键的角度分析上述反应中能量的变化.已知化学键的键能如表:
(3)、从断键和成键的角度分析上述反应中能量的变化.已知化学键的键能如表:化学键
H﹣H
O=O
H﹣O
键能kJ•mol﹣1
436
496
463
由此计算2mol H2在氧气中燃烧生成气态水放出的热量 .
26. 已知:某原电池的总反应为:2Fe3++Cu═2Fe2++Cu2+ . 则:①该原电池的正极材料可以选用(填材料名称): , 该电极的电极反应式是: ,
②若负极质量减少1.28克,那么电路中转移的电子数为: .