人教版化学高一必修一第四章第一节无机非金属材料的主角--硅同步练习
试卷更新日期:2015-09-22 类型:同步测试
一、选择题
-
1. 下列关于硅酸的叙述,错误的是( )A、硅酸是一种很弱的酸 B、硅酸可由二氧化硅与水反应制得 C、硅酸不稳定,加热脱水会生成二氧化硅 D、硅酸可以由可溶性硅酸盐与盐酸反应制得2. 下列叙述正确的是( )A、CO2和SiO2都是酸性氧化物,所以两者物理性质相似 B、因为CaCO3+SiO2=CaSiO3+CO2↑,所以硅酸的酸性比碳酸强 C、CO2和SiO2都能与碳反应,且都作氧化剂 D、SiO2晶体熔、沸点高,硬度大,故可用于制做光导纤维3. 下列关于硅酸的说法正确的是( )A、硅酸可以通过SiO2和水的化合反应直接制得 B、用反应Na2SiO3+2HCl===2NaCl+H2SiO3↓制取硅酸是利用了可溶性酸制难溶性酸的性质 C、因为硅酸难溶于水,所以它不能与NaOH溶液反应 D、硅胶可用作袋装食品的干燥剂4. 下列关于SiO2和CO2的说法中正确的是( )A、CO2、SiO2都是酸性氧化物 B、CO2和SiO2与水反应分别生成相应的酸 C、CO2是酸性氧化物,SiO2是两性氧化物 D、CO2和SiO2都是由 相应的分子组成的5. 下列说法不正确的是( )A、因SiO2不溶于水,故SiO2不是酸性氧化物 B、在反应SiO2+2C=Si+2CO↑中SiO2作氧化剂 C、SiO2是一种空间立体网状结构的晶体,熔点高、硬度大 D、氢氟酸能够刻蚀玻璃,故不能用玻璃瓶来盛装氢氟酸6. 碳酸的酸性比硅酸强,某化学课外小组搜集了大量的证据证明硅酸的酸性弱于碳酸酸性。其中能证明硅酸的酸性弱于碳酸酸性的实验事实是( )A、CO2溶于水形成碳酸,SiO2难溶于水 B、CO2通入可溶性硅酸盐中析出硅酸沉淀 C、高温下SiO2与碳酸钙、碳酸钠等固体反应生成CO2 D、氯化氢通入可溶性碳酸盐溶液中放出气体,通入可溶性硅酸盐溶液中生成沉淀7. 关于二氧化硅,下列叙述不正确的是( )A、水晶的主要成分是二氧化硅 B、二氧化硅和二氧化碳在物理性质上有很大差别 C、二氧化硅不溶于水,也不能跟水起反应生成酸 D、二氧化硅是一种酸性氧化物,它不跟任何酸起反应8. 下列离子方程式,正确的是( )A、澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2===CaCO3↓+H2O B、碳酸钠溶液中加入二氧化硅:CO32-+SiO2===SiO32-+CO2↑ C、二氧化硅与烧碱溶液反应:SiO2+2OH-===SiO32-+H2↑ D、硅酸与烧碱溶液中和:H2SiO3+2OH-===SiO32-+2H2O9. 在一定条件下,下列物质不能和SiO2反应的是( )
①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸 ⑤硝酸 ⑥氢氧化钾 ⑦氧化钙 ⑧氟气
A、③⑤⑦⑧ B、⑤⑦⑧ C、⑤⑧ D、⑤10. 下列物质中,不含有硅酸盐的是( )A、水玻璃 B、硅芯片 C、黏土 D、普通水泥11. 下列说法错误的是( )A、硅是制造太阳能电池的常用材料 B、二氧化硅是制造光导纤维的材料 C、常温下硅性质活泼,可以与氯气、强酸、强碱溶液等起反应 D、水玻璃可用作木材防火剂12. 下列有关硅及其化合物的说法正确的是( )A、晶体硅具有金属光泽,可以导电,属于金属材料 B、常温下,硅的化学性质稳定,所以自然界中的硅大部分以游离态存在 C、SiO2是一种酸性氧化物,能够与水反应生成相应的酸 D、除去SiO2中混有的CaCO3可加入适量的稀盐酸13. 由下列实验事实得出的结论正确的是( )A、由SiO2不能与水反应生成H2SiO3 , 可知SiO2不是酸性氧化物 B、由SiO2+2C=Si+2CO↑,可知碳的非金属性大于硅 C、CO2通入Na2SiO3溶液产生白色沉淀,可知酸性H2CO3>H2SiO3 D、SiO2可与NaOH溶液反应,也可与氢氟酸反应,可知SiO2为两性氧化物14. 单晶硅是制作电子集成电路的基础材料。科学家预计,到2011年一个电脑芯片上将会集成10亿个晶体管,其功能远比我们想象的要大得多,这对硅的纯度要求很高。用化学方法可制得高纯度硅,其化学方程式为:①SiO2+2C===Si+2CO↑ ②Si+2Cl2===SiCl4③SiCl4+2H2===Si+4HCl。下列对上述三个反应的叙述中,不正确的是( )
A、①③为置换反应 B、②为化合反应 C、①②③均为氧化还原反应 D、三个反应的反应物中硅元素均被还原15. 下列关于水玻璃的性质和用途的叙述中不正确的是( )A、这是一种矿物胶,既不燃烧也不受腐蚀 B、在建筑工业上可以作黏合剂、耐酸水泥掺料 C、木材、织物浸过 水玻璃后具有防腐性能且不易燃烧 D、水玻璃的化学性质稳定,在空气中不易变质16. 下列关于硅单质及其化合物的说法正确的是( )①硅是构成一些岩石和矿物的基本元素 ②水泥、玻璃、水晶饰物都是硅酸盐制品 ③高纯度的硅单质广泛用于制作光导纤维 ④陶瓷是人类应用很早的硅酸盐材料
A、①② B、②③ C、①④ D、③④17. 二氧化碳通入下列溶液中,不可能产生沉淀的是( )A、氯化钙溶液 B、石灰水 C、饱和碳酸钠溶液 D、硅酸钠溶液18. 用二氧化硅和金属氧化物的形式表示硅酸盐的组成,其中不正确的是( )A、钙沸石Ca(Al2Si3O10)·3H2O表示为CaO·Al2O3·3SiO2·3H2O B、镁橄榄石Mg2SiO4表示为2MgO·3SiO2 C、正长石KAlSi3O8表示为K2O·Al2O3·6SiO2 D、高岭石Al2(Si2O5)(OH)4表示为Al2O3·2SiO2·2H2O19. 世界著名的科技史专家、英国剑桥大学的李约瑟博士考证说:“中国至少在距今3 000年以前,就已经使用玻璃了。”下列有关普通玻璃的说法不正确的是( )A、制普通玻璃的原料主要是纯碱、石灰石和石英 B、玻璃在加热熔化时有固定的熔点 C、普通玻璃的成分主要是硅酸钠、硅酸钙和二氧化硅 D、盛放烧碱溶液的试剂瓶不能用玻璃塞,是为了防止烧碱跟二氧化硅反应生成硅酸钠而使瓶塞与瓶口粘在一起20. 下列关于硅的说法不正确的是( )A、硅是非金属元素,它的单质是灰黑色有金属光泽的固体 B、硅的导电性能介于导体和绝缘体之间,是良好的半导体材料 C、硅的化学性质不活泼,常温下不与任何物质发生反应 D、加热到一定温度时,硅能与氯气、氧气等非金属反应二、填空题
-
21.
为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。请据此回答:
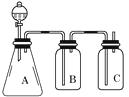
①锥形瓶中装某可溶性正盐溶液,分液漏斗所盛试剂应为。
②装置B所盛的试剂是 , 其作用是。
③装置C所盛试剂是 ,
C中反应的离子方程式是。
④由此可得出的结论是:酸性>>。
22. 指出下列反应中SiO2所表现的化学性质或作用,在A~E选项中选择正确答案填入括号内。①SiO2+2NaOH===Na2SiO3+H2O
②SiO2+2C===Si+2CO↑
③SiO2+3C===SiC+2CO↑
④SiO2+4HF===SiF4↑+2H2O
a.作为玻璃的成分被消耗而使玻璃被腐蚀
b.氧化性
c.酸性氧化物的通性
d.未参加氧化还原反应
三、综合题
-
23. 氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定,工业上曾普遍采用高纯硅与纯氮气在1 300 ℃时反应获得。(1)、根据 性质,推测氮化硅陶瓷的用途是(填字母)。
a.制汽轮机叶片 b.制有色玻璃
c.制永久性模具 d.制造柴油机
(2)、画出N的原子结构示意图 , 已知得电子能力N>Si,请写出氮化硅的化学式:。
(3)、氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应。试推测该陶瓷被氢氟酸腐蚀的化学方程式:。24.如图中的每一方格表示相关的一种反应物或生成物。其中B是一种单质,其余物质也都是有B元素的化合物。C是一种钠盐,E是C对应的酸,B的结构类似金刚石,D为B的氧化物(其他不含B元素的反应产物以及各步反应添加的必要试剂和反应条件已被略去),请填写空白:
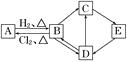 (1)、A、D、E的化学式分别为、、。(2)、A和B的互相转化在工业上有什么实际意义?
(1)、A、D、E的化学式分别为、、。(2)、A和B的互相转化在工业上有什么实际意义?。
(3)、写出D→C反应的化学方程式:。
(4)、写出E→D反应的化学方程式:。25.根据下图A、B、D、E的转化关系,回答下列问题:
 (1)、写出A、D的名称:A , D。(2)、写出B→A的化学方程式:。(3)、写出下列反应的离子方程式:A→E:;E→D:。
(1)、写出A、D的名称:A , D。(2)、写出B→A的化学方程式:。(3)、写出下列反应的离子方程式:A→E:;E→D:。