江苏省扬州市江都区2018-2019学年九年级上学期化学期中考试试卷
试卷更新日期:2018-12-05 类型:期中考试
一、单选题
-
1. 扬州荣获2021年世界园艺博览会承办权。为了办好这项活动,下列做法错误的是( )A、为减少“白色污染”,使用新型可降解塑料 B、治理露天烧烤 C、推广将秸秆露天焚烧 D、置换新能源公交车2. 华为在Mate20中首次正式应用“石墨烯”材料,做了一块石墨烯薄片液冷散热系统,这是利用了石墨烯的( )A、透光性好 B、硬度大 C、导热性好 D、导电性强3. 下列实验操作符合规范的是( )A、
 B、
B、 C、
C、 D、
D、 4. 下面属于“禁止烟火”标志的是( )A、
4. 下面属于“禁止烟火”标志的是( )A、 B、
B、 C、
C、 D、
D、 5. 下列做法正确的是( )A、厨房煤气管道漏气,马上打开抽风机 B、冬天关闭门窗用煤炉取暖 C、实验桌上少量酒精着火,迅速用湿布盖灭 D、炒菜时油锅着火,立即浇水灭火6. 下列属于人体必需微量元素的是( )A、Mn B、C C、Ca D、H7. 人体吸入的O2有2%转化为活性氧,它能加速人体衰老,被称为“夺命杀手”,我国科学家尝试用Na2SeO3清除人体内的活性氧,Na2SeO3中Se元素的化合价是( )A、+2 B、+4 C、+6 D、﹣28. 误差分析是定量实验的一个重要内容,下列分析正确的是( )A、用量筒量取10mL水,仰视读数,会导致水的实际体积偏小 B、用托盘天平称取10.5g氯化钠,药品和砝码放反,会导致氯化钠偏多 C、粗盐提纯时,若溶解时加水量不足,会导致得到的精盐质量偏低 D、电解水时,氧气比氢气更易溶于水,会导致负极与正极的气体体积比小于2:19. 氢气是最理想的能源。如图是水分解成氢气和氧气的微观示意图,按它们在变化过程中出现的先后顺序,其中排列正确的是( )
5. 下列做法正确的是( )A、厨房煤气管道漏气,马上打开抽风机 B、冬天关闭门窗用煤炉取暖 C、实验桌上少量酒精着火,迅速用湿布盖灭 D、炒菜时油锅着火,立即浇水灭火6. 下列属于人体必需微量元素的是( )A、Mn B、C C、Ca D、H7. 人体吸入的O2有2%转化为活性氧,它能加速人体衰老,被称为“夺命杀手”,我国科学家尝试用Na2SeO3清除人体内的活性氧,Na2SeO3中Se元素的化合价是( )A、+2 B、+4 C、+6 D、﹣28. 误差分析是定量实验的一个重要内容,下列分析正确的是( )A、用量筒量取10mL水,仰视读数,会导致水的实际体积偏小 B、用托盘天平称取10.5g氯化钠,药品和砝码放反,会导致氯化钠偏多 C、粗盐提纯时,若溶解时加水量不足,会导致得到的精盐质量偏低 D、电解水时,氧气比氢气更易溶于水,会导致负极与正极的气体体积比小于2:19. 氢气是最理想的能源。如图是水分解成氢气和氧气的微观示意图,按它们在变化过程中出现的先后顺序,其中排列正确的是( ) A、甲、乙、丙 B、丙、甲、乙 C、乙、甲、丙 D、丙、乙、甲10. 下列有关现象错误的是( )A、细铁丝在空气中剧烈燃烧,火星四射 B、镁带在空气中燃烧时发出耀眼的白光 C、纯净的氢气在空气中安静地燃烧,产生淡蓝色火焰 D、加热碱式碳酸铜时,固体由绿色逐渐变为黑色11. 二氧化氮气体通入水中发生如下反应:3NO2+H2O=2HNO3+X,X的化学式为( )A、N2O B、NO C、N2O2 D、N2O512. 如图是五种粒子的结构示意图,下列说法正确的是( )
A、甲、乙、丙 B、丙、甲、乙 C、乙、甲、丙 D、丙、乙、甲10. 下列有关现象错误的是( )A、细铁丝在空气中剧烈燃烧,火星四射 B、镁带在空气中燃烧时发出耀眼的白光 C、纯净的氢气在空气中安静地燃烧,产生淡蓝色火焰 D、加热碱式碳酸铜时,固体由绿色逐渐变为黑色11. 二氧化氮气体通入水中发生如下反应:3NO2+H2O=2HNO3+X,X的化学式为( )A、N2O B、NO C、N2O2 D、N2O512. 如图是五种粒子的结构示意图,下列说法正确的是( ) A、ab属于同种元素 B、bd在化学反应中易失电子 C、bcd均表示离子 D、be 构成的化合物是MgCl213. 下表所给出的各组概念中,符合如图所示从属关系的是( )
A、ab属于同种元素 B、bd在化学反应中易失电子 C、bcd均表示离子 D、be 构成的化合物是MgCl213. 下表所给出的各组概念中,符合如图所示从属关系的是( ) A、A B、B C、C D、D14. 某气体由CH4、C2H2、C2H4中的一种或几种组成,取该气体样品在氧气中完全燃烧,测得生成的二氧化碳和水的质量比为22:9,下列对该气体组成判断正确的是( )A、该气体中一定含有C2H4 B、该气体中一定没有CH4 C、该气体中可能含有C2H2 D、该气体不可能同时含有CH4、C2H2、C2H415. 如图为改良版的“验证二氧化碳化学性质”的实验装置。用一根铁丝穿4片紫色石蕊试纸,按图示将稀硫酸和水滴加到相应的试纸上,下列说法错误的是( )
A、A B、B C、C D、D14. 某气体由CH4、C2H2、C2H4中的一种或几种组成,取该气体样品在氧气中完全燃烧,测得生成的二氧化碳和水的质量比为22:9,下列对该气体组成判断正确的是( )A、该气体中一定含有C2H4 B、该气体中一定没有CH4 C、该气体中可能含有C2H2 D、该气体不可能同时含有CH4、C2H2、C2H415. 如图为改良版的“验证二氧化碳化学性质”的实验装置。用一根铁丝穿4片紫色石蕊试纸,按图示将稀硫酸和水滴加到相应的试纸上,下列说法错误的是( ) A、图中1、3变为红色,2、4不变色 B、若将稀硫酸换成稀醋酸也可以得到符合题意的实验结果 C、该实验证明二氧化碳能与石蕊发生反应生成红色物质 D、该实验的优点是将四个实验改成一个实验,对比性强16. 如图是某个化学反应的微观示意图,从示意图中获取的信息错误的是( )
A、图中1、3变为红色,2、4不变色 B、若将稀硫酸换成稀醋酸也可以得到符合题意的实验结果 C、该实验证明二氧化碳能与石蕊发生反应生成红色物质 D、该实验的优点是将四个实验改成一个实验,对比性强16. 如图是某个化学反应的微观示意图,从示意图中获取的信息错误的是( )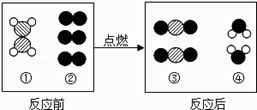 A、图①分子中两种原子的个数比为1:2 B、图②对应的物质是单质 C、参加反应的分子个数比为2:3 D、反应后生成的物质都是化合物17. 加热氯酸钾和二氧化锰的混合物制取氧气,下列图像正确的是( )A、
A、图①分子中两种原子的个数比为1:2 B、图②对应的物质是单质 C、参加反应的分子个数比为2:3 D、反应后生成的物质都是化合物17. 加热氯酸钾和二氧化锰的混合物制取氧气,下列图像正确的是( )A、 B、
B、 C、
C、 D、
D、
二、多选题
-
18. 通过下列图示实验得出的结论中正确的是( )
 A、图1所示实验既说明甲烷具有可燃性,又说明甲烷中含有碳、氢两种元素 B、图2所示实验既说明二氧化碳密度比空气大又说明二氧化碳不能燃烧也不支持燃烧 C、图3所示实验既说明电解水生成氢气和氧气,又说明水是由氢气和氧气组成的 D、图4所示实验探究要使可燃物燃烧既要与氧气接触,还要使温度达到着火点19. 甲、乙、丙、丁种种物质在反应前后的质量关系如图所示,下列有关说法错误的是( )
A、图1所示实验既说明甲烷具有可燃性,又说明甲烷中含有碳、氢两种元素 B、图2所示实验既说明二氧化碳密度比空气大又说明二氧化碳不能燃烧也不支持燃烧 C、图3所示实验既说明电解水生成氢气和氧气,又说明水是由氢气和氧气组成的 D、图4所示实验探究要使可燃物燃烧既要与氧气接触,还要使温度达到着火点19. 甲、乙、丙、丁种种物质在反应前后的质量关系如图所示,下列有关说法错误的是( ) A、丙一定是该反应的催化剂 B、参加反应的甲和乙质量比为2:7 C、x的值是7 D、丁一定是化合物
A、丙一定是该反应的催化剂 B、参加反应的甲和乙质量比为2:7 C、x的值是7 D、丁一定是化合物三、流程题
-
20. 空气是宝贵的自然资源,图1是以空气和其他必要的原料合成氮肥(NH4HCO3)的流程,图2是某化肥碳酸氢铵包装袋上的部分说明。请按要求回答下列问题。
 (1)、空气属于(填“纯净物”或“混合物”),步骤①中 “其他气体”中主要成分是 , 其化学性质(填“活泼”或“稳定”)。(2)、图中分离空气的过程属于变化(填“物理”或“化学”)。(3)、用化学用语表示:
(1)、空气属于(填“纯净物”或“混合物”),步骤①中 “其他气体”中主要成分是 , 其化学性质(填“活泼”或“稳定”)。(2)、图中分离空气的过程属于变化(填“物理”或“化学”)。(3)、用化学用语表示:两个氮分子氖气
步骤②的反应中没有改变的微粒是
铵根离子
标出NH3中氮元素的化合价;
步骤②反应的化学方程式是。
步骤③反应的化学方程式是。
(4)、由图2可知碳酸氢铵具有的化学性质是。(5)、图2所示的化肥中碳酸氢铵的质量分数为(计算结果精确到0.1%)。(6)、天然气(主要成分是甲烷,化学式为CH4)燃烧也可生成CO2。若将3.2g甲烷在一定量的氧气中燃烧,测得反应前后各物质的质量如下表所示:物质
甲烷
氧气
水
二氧化碳
X
反应前质量/g
3.2
11.2
0
0
0
反应后质量/g
0
0
6.3
4.4
m
①表中m的值为。
②X中含有的元素有。
四、实验题
-
21. 水是生命之源。请回答下列问题:
 (1)、图1是用100mL的量筒等仪器组装成的电解水的简易装置,从图中可以看出,a连接电源的极,(填“甲”或“乙”)量筒内产生的气体能使带火星木条复燃,乙量筒内气体的体积约为mL,该实验的结论是;水是由组成的。从能量转化角度分析,电解水将能转化为能。(2)、下列各种水中,属于纯净物的是____(填字母)。A、汽水 B、矿泉水 C、蒸馏水 D、经过净化处理的自来水(3)、净水时,为了使水中悬浮的小颗粒沉降,可以向水中加入(填物质名称)。(4)、硬水会给生产、生活带来很多问题,生活中可用 区分硬水和软水,可采用的方法降低水的硬度。(5)、图2是小刚用身边的物品(饮料瓶、膨松棉、活性炭、细沙、小卵石等)制作的一个简易净水器。图2中的②处是(填上述物质名称)。其中小卵石、石英沙等作用是。其中活性炭的主要作用是。(6)、自来水厂常用二氧化氯进行投药消毒,二氧化氯的化学式为。(7)、图3是过滤操作,该操作中玻璃棒的作用是。22. 某探究小组为测定空气中氧气的含量做如下实验:
(1)、图1是用100mL的量筒等仪器组装成的电解水的简易装置,从图中可以看出,a连接电源的极,(填“甲”或“乙”)量筒内产生的气体能使带火星木条复燃,乙量筒内气体的体积约为mL,该实验的结论是;水是由组成的。从能量转化角度分析,电解水将能转化为能。(2)、下列各种水中,属于纯净物的是____(填字母)。A、汽水 B、矿泉水 C、蒸馏水 D、经过净化处理的自来水(3)、净水时,为了使水中悬浮的小颗粒沉降,可以向水中加入(填物质名称)。(4)、硬水会给生产、生活带来很多问题,生活中可用 区分硬水和软水,可采用的方法降低水的硬度。(5)、图2是小刚用身边的物品(饮料瓶、膨松棉、活性炭、细沙、小卵石等)制作的一个简易净水器。图2中的②处是(填上述物质名称)。其中小卵石、石英沙等作用是。其中活性炭的主要作用是。(6)、自来水厂常用二氧化氯进行投药消毒,二氧化氯的化学式为。(7)、图3是过滤操作,该操作中玻璃棒的作用是。22. 某探究小组为测定空气中氧气的含量做如下实验:
图1是利用气压传感器测定红磷燃烧时集气瓶内气压变化的实验装置。
图2是集气瓶内气压的变化情况。
图3是利用铜粉与氧气加热后反应生成氧化铜的原理,测定空气中氧气含量的实验装置。
(1)、图1实验:点燃燃烧匙内的红磷后,立即伸入集气瓶中并把橡皮塞塞紧。待红磷熄灭并冷却后,打开止水夹。下列有关图2的分析错误的是________。A、BC段气压增大的主要原因是燃烧放热 B、CD段气压减小的主要原因是集气瓶内氧气不断被消耗且瓶内温度逐渐冷却。 C、DE段气压增大的主要原因是烧杯中的水进入集气瓶 D、若用木炭代替红磷完成此实验,集气瓶内气压变化趋势与图2基本一致(2)、图3实验的主要实验步骤如下:①组装装置,检查装置的气密性;
②向试管中加入足量的铜粉,铜粉要足量的原因是;
③点燃酒精灯,不停地抽拉注射器的活塞,充分反应后停止加热。
试管中发生的化学反应方程式为。实验前,该注射器中空气的体积至少为mL,才能顺利的完成实验。用酒精灯在铜粉部位加热时,若实验过程中没有不断推拉注射器,则可能导致测定的空气中氧气的体积分数(填“偏大”、“偏小”、“不变”)。
23. 化学是一门以实验为基础的学科,气体的制备是其中一种重要的实验。现有如下仪器供选。
(实验一)用大理石(或石灰石)和稀盐酸制取CO2。
(1)、仪器A的名称是 , 仪器F的名称是。(2)、组装整套装置时,可选用图中的A、B、C、I、J、L、P和。(3)、组装的装置在加入药品前要检查气密性,方法有多种,下列方法和现象能说明该装置不漏气的是___________(填字母序号填空)。A、用弹簧夹夹紧橡胶管,向长颈漏斗中加水,长颈漏斗内形成稳定的水柱; B、向长颈漏斗中注水使下端形成液封,在右侧导管口连接注射器,缓缓拉注射器活塞,长颈漏斗下端冒气泡; C、向长颈漏斗中注水使下端形成液封,在右侧导管口连接注射器,缓缓推注射器活塞,长颈漏斗中液面上升; D、将导管浸入水中,双手捂住锥形瓶外壁,观察到导管口没有气泡;(4)、实验室制取CO2气体的化学方程式为 , 用向上排空法收集CO2气体验满的操作是。(5)、选择气体的制取装置时,需要考虑反应物的状态、和气体的性质。(6)、(实验二)实验室制取O2并进行一系列探究。〖探究1〗用氯酸钾、二氧化锰为原料制取并收集氧气
该方法制取氧气的化学方程式为;能用排水法收集氧气是因为氧气;选用排水集气法,组装整套装置时,伸入集气瓶口的导管应选择上图中的。
(7)、某同学组装了发生装置如图1所示,错误是 , 若要改正错误,需要操作的旋钮是(填字母)。 (8)、某小组经实验测定,排水法收集的氧气平均浓度为89.7%,向上排空气法收集的氧气平均浓度为79.7%,对比排水法和向上排空气法,法收集的氧气更纯净,用向上排空气法收集到的氧气浓度只有80%左右的原因有(填字母编号)。
(8)、某小组经实验测定,排水法收集的氧气平均浓度为89.7%,向上排空气法收集的氧气平均浓度为79.7%,对比排水法和向上排空气法,法收集的氧气更纯净,用向上排空气法收集到的氧气浓度只有80%左右的原因有(填字母编号)。A.氧气的密度略大于空气的密度
B.加热氯酸钾和二氧化锰固体产生氧气的浓度只有80%左右
C.当观察到带火星木条复燃时,集气瓶内还有空气
D.当氧气进入集气瓶时,瓶内空气与进入的氧气相互扩散
(9)、某同学在实验室用氯酸钾和二氧化锰制氧气,加热一段时间后停止实验(氯酸钾未完全分解),他测得剩余物质中两种金属元素的质量分数分别为:锰元素质量分数11.0%,钾元素的质量分数39.0%,请问剩余物质中氧元素的质量分数为______。A、4% B、14.5% C、25.5% D、50%(10)、〖探究2〗对H2O2分解的各种催化剂的催化效果进行定量对比探究(小资料)海藻酸钠是一种天然高分子物质,在本实验中性质稳定。实验方案如下:
I.用MnO2、CuO、Fe2O3、Cr2O3四种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小相同的海藻酸钠微球,备用。
II.取30粒含MnO2的海藻酸钠微球,采用左下图装置进行实验。改用其他三种微球,分别重复上述实验,得到如图的锥形瓶内压强随时间变化的曲线图。

用双氧水、二氧化锰为原料制取氧气的化学方程式为 , 该反应属于反应(填基本反应类型)。
(11)、每次实验时,海藻酸钠微球数应相同的原因。(12)、用含MnO2的海藻酸钠微球进行实验,60s左右时压强瞬间回落,其原因是。(13)、从实验曲线看,催化效果较好、反应温和的催化剂是。五、简答题
-
24. 下图是某反应的微观示意图。

请回答:
(1)、反应前框内单质的名称是。(2)、该反应的化学方程式为。(3)、反应后框内化合物和单质的分子个数比为 , 质量比为 , 框内碳、氧元素的质量比为。
-