2015-2016学年河北省邯郸市大名县、永年县、磁县、邯郸县四县高二下学期期中化学试卷
试卷更新日期:2017-03-27 类型:期中考试
一、单选题
-
1. 化学在生产和日常生活中有着重要的作用.下列有关说法正确的是( )A、“地沟油”经过加工处理后,可以用来制肥皂 B、二氧化硫有漂白性,常用作棉、麻、纸张和食品的漂白 C、汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 D、含磷污水是很好的肥料,可灌溉庄稼,可直接排放到自然界水体中2. 设NA 为阿伏加德罗常数的值.下列说法正确的是( )A、常温常压下,6.4 g O2和O3的混合气体中含有的分子数为0.4NA B、0.1 mol Fe与少量氯气反应生成FeCl2 , 转移电子数为0.2 NA C、1.4 g由乙烯和环丙烷组成的混合物中含有原子的数目为 0.3 NA D、0.1 mol•L﹣1碳酸钠溶液中含有CO32﹣离子数目小于0.1 NA3. 下列有关化学用语表示正确的是( )A、过氧化钠的电子式:
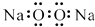 B、次氯酸的结构式:H﹣Cl﹣O
C、硫原子的结构示意图:
B、次氯酸的结构式:H﹣Cl﹣O
C、硫原子的结构示意图: 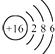 D、NH4Cl的电子式:
D、NH4Cl的电子式: 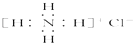 4. 下列表示对应化学反应的离子方程式正确的是( )A、MnO2 与浓盐酸反应制Cl2:MnO2+4HCl Mn2++2Cl﹣+Cl2↑+2H2O B、明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+ C、Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH﹣+O2↑ D、Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3﹣+Ca2++OH﹣═CaCO3↓+H2O5. 一未完成的离子方程式:( )+XO3﹣+6H+═3X2+3H2O,据此判断下列说法正确的是( )A、X原子最外层有5个电子 B、当有1mol X2生成时,共有2mol电子转移 C、氧化产物和还原产物的物质的量之比为5:1 D、“( )”所填的微粒和XO3﹣在任何环境下都不能共存6. 利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示.下列说法不正确的是( )
4. 下列表示对应化学反应的离子方程式正确的是( )A、MnO2 与浓盐酸反应制Cl2:MnO2+4HCl Mn2++2Cl﹣+Cl2↑+2H2O B、明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+ C、Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH﹣+O2↑ D、Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3﹣+Ca2++OH﹣═CaCO3↓+H2O5. 一未完成的离子方程式:( )+XO3﹣+6H+═3X2+3H2O,据此判断下列说法正确的是( )A、X原子最外层有5个电子 B、当有1mol X2生成时,共有2mol电子转移 C、氧化产物和还原产物的物质的量之比为5:1 D、“( )”所填的微粒和XO3﹣在任何环境下都不能共存6. 利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示.下列说法不正确的是( )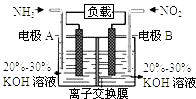 A、电流从右侧电极经过负载后流向左侧电极 B、A电极上发生氧化反应,B为正极 C、电极A极反应式为2NH3﹣6e﹣=N2+6H+ D、当有2.24LNO2(标准状况) 被处理时,转移电子为0.4mol7. 下列关于电解质溶液的叙述正确的是( )A、常温下,在pH=7的醋酸钠和醋酸混合溶液中:c(CH3COO﹣)>c(Na+) B、1 mol•L﹣1的硫化钠溶液中,c(H+)+c(Na+)=c(OH﹣)+c(HS﹣)+c(S2﹣) C、稀释醋酸溶液,溶液中所有离子的浓度均降低 D、pH=5的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(Cl﹣)8. 满足分子式为C4H8ClBr的有机物共有( )A、11种 B、12种 C、13种 D、14种9. 一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌xC(g)+2D(s).2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L.下列判断正确的是( )A、该条件下此反应的化学平衡常数约为0.91 B、A的平均反应速率为0.3mol/(L•s) C、B的转化率为60% D、若混合气体的密度不再改变时,该反应不一定达到平衡状态10. 下列有关热化学方程式的叙述正确的是( )A、2H2(g)+O2(g)=2H2O(g),△H=﹣483.6kJ•mol﹣1 , 则氢气的燃烧热为241.8kJ•mol﹣1 B、已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 C、含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则该反应中和热的热化学方程式为:NaOH+HCl=NaCl+H2O,△H=﹣57.4kJ•mol﹣1 D、已知2C(s)+2O2(g)=2CO2(g)△H1 , 2C(s)+O2(g)=2CO(g)△H2 则△H1<△H211. 下列实验中,所使用的装置(夹持装置略)、试剂和操作方法都正确的是( )A、
A、电流从右侧电极经过负载后流向左侧电极 B、A电极上发生氧化反应,B为正极 C、电极A极反应式为2NH3﹣6e﹣=N2+6H+ D、当有2.24LNO2(标准状况) 被处理时,转移电子为0.4mol7. 下列关于电解质溶液的叙述正确的是( )A、常温下,在pH=7的醋酸钠和醋酸混合溶液中:c(CH3COO﹣)>c(Na+) B、1 mol•L﹣1的硫化钠溶液中,c(H+)+c(Na+)=c(OH﹣)+c(HS﹣)+c(S2﹣) C、稀释醋酸溶液,溶液中所有离子的浓度均降低 D、pH=5的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(Cl﹣)8. 满足分子式为C4H8ClBr的有机物共有( )A、11种 B、12种 C、13种 D、14种9. 一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌xC(g)+2D(s).2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L.下列判断正确的是( )A、该条件下此反应的化学平衡常数约为0.91 B、A的平均反应速率为0.3mol/(L•s) C、B的转化率为60% D、若混合气体的密度不再改变时,该反应不一定达到平衡状态10. 下列有关热化学方程式的叙述正确的是( )A、2H2(g)+O2(g)=2H2O(g),△H=﹣483.6kJ•mol﹣1 , 则氢气的燃烧热为241.8kJ•mol﹣1 B、已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 C、含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则该反应中和热的热化学方程式为:NaOH+HCl=NaCl+H2O,△H=﹣57.4kJ•mol﹣1 D、已知2C(s)+2O2(g)=2CO2(g)△H1 , 2C(s)+O2(g)=2CO(g)△H2 则△H1<△H211. 下列实验中,所使用的装置(夹持装置略)、试剂和操作方法都正确的是( )A、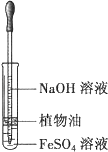 观察Fe(OH)2的生成
B、
观察Fe(OH)2的生成
B、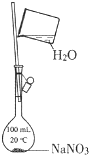 配制一定物质的量浓度的NaNO3溶液
C、
配制一定物质的量浓度的NaNO3溶液
C、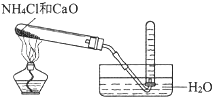 实验室制取氨
D、
实验室制取氨
D、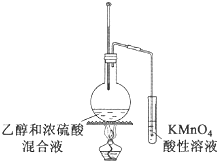 验证乙烯的生成
12. 下列与含氯物质有关的说法正确的是( )A、氯水要现用现制,并保存在盖有橡胶塞的棕色瓶子中,置于冷暗处 B、HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 C、向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 D、电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数)13. O、Si、Al是地壳中含量最多的三种元素,Na、Mg、Cl是海水中的重要元素.下列说法正确的是( )A、普通玻璃、水泥成分中都含有O、Si、Al三种元素 B、从海水中制备Na、Mg、Al三种元素单质的反应都是氧化还原反应 C、电解熔融状态的SiO2、Al2O3可以制得Si、Al,且都有氧气生成 D、加热蒸干NaCl、MgCl2溶液时可以得到晶体NaCl、MgCl214. X、Y、Z、M为原子序数依次增大的4种短周期元素.已知X、Y、Z是同周期的相邻元素,M原子的核外电子数是Z原子最外层电子数的2倍,Y与其同主族的短周期元素可形成一种常见的气体.下列说法正确的是( )A、原子半径:M>X>Y>Z B、对应氢化物的沸点:M>Z>Y>X C、对应氢化物的稳定性:Z>X>Y>M D、XY2与MY2溶于水都能得到对应的酸15. 下列说法中正确的是( )A、难溶电解质的Ksp越小,溶解度就一定越小 B、向含AgCl沉淀的悬浊液中加入NaCl饱和溶液,AgCl的溶解度变小,溶度积常数变小 C、用饱和Na2CO3溶液可以将BaSO4转化为BaCO3 , 说明Ksp(BaCO3)小于Ksp(BaSO4) D、一般认为沉淀离子浓度小于1.0×10﹣5 mol/L时,离子就已沉淀完全16. 下列与有机物结构、性质相关的叙述错误的是( )A、乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2 B、甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同 C、蛋白质和油脂都属于高分子化合物,一定条件下都能水解 D、苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键17. 向一定量的FeO和Fe2O3的混合物中加入120mL 4mol•L﹣1的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现.若用足量的氢气在加热条件下还原相同质量的混合物,能得到铁的物质的量为( )A、0.24 mol B、0.21 mol C、0.16 mol D、0.14 mol
验证乙烯的生成
12. 下列与含氯物质有关的说法正确的是( )A、氯水要现用现制,并保存在盖有橡胶塞的棕色瓶子中,置于冷暗处 B、HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 C、向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 D、电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数)13. O、Si、Al是地壳中含量最多的三种元素,Na、Mg、Cl是海水中的重要元素.下列说法正确的是( )A、普通玻璃、水泥成分中都含有O、Si、Al三种元素 B、从海水中制备Na、Mg、Al三种元素单质的反应都是氧化还原反应 C、电解熔融状态的SiO2、Al2O3可以制得Si、Al,且都有氧气生成 D、加热蒸干NaCl、MgCl2溶液时可以得到晶体NaCl、MgCl214. X、Y、Z、M为原子序数依次增大的4种短周期元素.已知X、Y、Z是同周期的相邻元素,M原子的核外电子数是Z原子最外层电子数的2倍,Y与其同主族的短周期元素可形成一种常见的气体.下列说法正确的是( )A、原子半径:M>X>Y>Z B、对应氢化物的沸点:M>Z>Y>X C、对应氢化物的稳定性:Z>X>Y>M D、XY2与MY2溶于水都能得到对应的酸15. 下列说法中正确的是( )A、难溶电解质的Ksp越小,溶解度就一定越小 B、向含AgCl沉淀的悬浊液中加入NaCl饱和溶液,AgCl的溶解度变小,溶度积常数变小 C、用饱和Na2CO3溶液可以将BaSO4转化为BaCO3 , 说明Ksp(BaCO3)小于Ksp(BaSO4) D、一般认为沉淀离子浓度小于1.0×10﹣5 mol/L时,离子就已沉淀完全16. 下列与有机物结构、性质相关的叙述错误的是( )A、乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2 B、甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同 C、蛋白质和油脂都属于高分子化合物,一定条件下都能水解 D、苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键17. 向一定量的FeO和Fe2O3的混合物中加入120mL 4mol•L﹣1的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现.若用足量的氢气在加热条件下还原相同质量的混合物,能得到铁的物质的量为( )A、0.24 mol B、0.21 mol C、0.16 mol D、0.14 mol二、非选择题
-
18. 下面列出了几组物质,请选择合适物质的序号填在空格上.
同位素;同系物;同分异构体 .
①金刚石和石墨 ②CH3CH2CH2CH3和(CH3)2CHCH3
③ He和 He ④CH3CH3 和CH3CH2CH2CH3
⑤
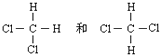 ⑥CH2=CHCH3和CH2=CH2;
⑥CH2=CHCH3和CH2=CH2;⑦D与T ⑧甲酸乙酯和乙酸甲酯.
19. 如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题: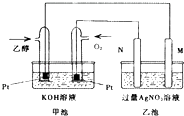 (1)、M电极的材料是 , 电极名称是 ,
(1)、M电极的材料是 , 电极名称是 ,加入乙醇的铂电极的电极反应式为 .
(2)、在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为 mL(标准状况下).(3)、若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量表示该反应的热化学方程式为 .20. 如图是在实验室进行二氧化硫制备与验证性质实验的组合装置,部分固定装置未画出.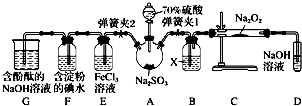 (1)、装置B中试剂X是 , 装置D中盛放NaOH溶液的作用是 .(2)、关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体,检验SO2与Na2O2反应是否有氧气生成的操作及现象是 .(3)、关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F、G中,能说明I﹣还原性弱于SO2的现象为;发生反应的离子方程式是 .(4)、为了验证E中SO2与FeCl3发生了氧化还原反应,设计了如下实验:
(1)、装置B中试剂X是 , 装置D中盛放NaOH溶液的作用是 .(2)、关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体,检验SO2与Na2O2反应是否有氧气生成的操作及现象是 .(3)、关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F、G中,能说明I﹣还原性弱于SO2的现象为;发生反应的离子方程式是 .(4)、为了验证E中SO2与FeCl3发生了氧化还原反应,设计了如下实验:取E中的溶液,往溶液中加入用稀硝酸酸化的BaCl2溶液,产生白色沉淀,说明SO2与FeCl3发生了氧化还原反应.上述方案是否合理?(填“合理”或“不合理”),原因是 .
21. 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:
CO(g)+2H2(g)⇌CH3OH(g)
①下列情形不能说明该反应已达到平衡状态的是(填序号).
A.每消耗1mol CO的同时生成2molH2B.混合气体总物质的量不变
C.CH3OH、CO、H2的浓度都不再发生变化D.生成CH3OH的速率与消耗CO的速率相等
②CO的平衡转化率(α)与温度、压强的关系如图所示.A、B两点的平衡常数K(A) K(B)(填“>”、“=”或“<”).
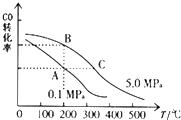
③某温度下,将2.0mol CO和6.0molH2充入2L的密闭容器中,达到平衡时测得c(CO)=0.25mol/L,CO的转化率= , 此温度下的平衡常数K=(保留两位有效数字).
三、选做题
-
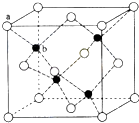
22. CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.(1)、Cu2+基态的电子排布式可表示为;(2)、SO42﹣的空间构型为(用文字描述);中心原子采用的轨道杂化方式是;写出一种与SO42﹣互为等电子体的分子的化学式:;(3)、向CuSO4 溶液中加入过量NaOH溶液可生成[Cu (OH)4]2﹣ . 不考虑空间构型,[Cu(OH)4]2﹣的结构可用示意图表示为;(4)、资料显示ZnS为难溶物,在活化过程中,CuSO4能转化为CuS的原因是 .(5)、CuS比CuO的熔点(填高或低),原因是 .(6)、闪锌矿的主要成分ZnS,晶体结构如图所示,其晶胞边长为540.0pm,密度为(列式并计算),a位置S2﹣离子与b位置Zn2+离化学﹣选修5:有机化学基础子之间的距离为 pm(列式表示).
 23. 人工合成有机化合物H的路线可简单表示如下:
23. 人工合成有机化合物H的路线可简单表示如下: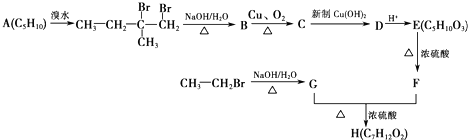
已知:F的核磁共振氢谱有四个峰,峰的面积比为1:1:3:3.
请回答下列问题:
(1)、A的名称(系统命名)为;C中官能团的结构简式为 .(2)、G+F﹣→H的反应类型为;H的结构简式为 .(3)、C→D的离子方程式为 .(4)、E在一定条件下生成的高分子化合物的结构简式为 .(5)、X是F的同分异构体,它同时符合下列3个条件:①能发生水解反应;
②不含甲基;
③能发生银镜反应.
则X可能的结构简式为 .