2018-2019学年高一上学期12月月考 化学试题
试卷更新日期:2018-12-03 类型:月考试卷
一、选择题 每题只有一个选项符合题意
-
1. 化学与生活,社会发展息息相关,下列有关说法错误的是( )A、“霾尘积聚难见路人”。雾霾所形成的气溶胶有丁达尔效应 B、“曾青(硫酸铜)涂铁,铁赤色如铜”过程中发生了置换反应 C、为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 D、用菜籽油浸泡辣椒涉及萃取知识2. 化学与社会、生活密切相关。对下列现象或事实的解释正确的是( )
现象或事实 解释 A 二氧化硅是生产光纤的原料 二氧化硅熔点高、硬度大、具有半导性 B 氧化铝是一种较好的耐火材料 氧化铝是一种难熔物质 C 食品的包装盒内常有小袋包装的硅胶或生石灰 其作用为防止富脂食品被氧化 D 铜制器皿表面生成铜绿 Cu与CO2、H2O反应生成碱式碳酸铜 A、A B、B C、C D、D3. 有些科学家提出硅是“21世纪的能源”,下列有关硅及其化合物的说法正确的是A、硅在自然界中以游离态和化合态两种形式存在( ) B、硅晶体是良好的半导体,可用于制造光导纤维 C、SiO2是酸性氧化物,不与任何酸发生反应 D、木材浸过水玻璃后,不易着火4. 中华传统文化博大精深,其中涉及到很多的化学知识。下列有关说法不正确的是( )A、中国的圆珠笔头一直需要进口笔尖钢,经过5 年数不清的失败,2016年9月,中国太钢集团利用家常和面原理在钢水中加入添加剂试验成功,造出圆珠笔头,可完全替代进口,由此信息可知笔尖钢为合金,且具有良好的切削性。 B、工业生产玻璃、水泥、漂白粉,均需要用石灰石为原料 C、《天工开物》中有“至于矾现五色之形,硫为群石之将,皆变化于烈火”,其中的矾指的是金属硫化物 D、中国蓝是古代人工合成的蓝色化合物,其化学式为BaCuSi4O10 , 可改写成BaO·CuO·4SiO25. 下列有关铁及其化合物的说法中正确的是( )A、赤铁矿的主要成分是Fe3O4 B、铁与水蒸气在高温下的反应产物为Fe2O3和H2 C、除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤 D、Fe3+与KSCN产生血红色沉淀6. 下列物质转化在一定条件下不能实现的是( )A、Al2O3→Al(OH)3→Al B、Cu→CuO→CuSO4 C、Na→NaOH→Na2CO3 D、Fe(OH)3→Fe2O3→Fe3+7. 为了检验某氯化亚铁溶液是否变质,最好向溶液中加入( )A、NaOH 溶液 B、铁片 C、KSCN 溶液 D、石蕊试液8. 在FeCl2和AlCl3的混合溶液中加入过量的氨水,直至溶液中沉淀的量不再改变为止。经过滤、洗涤、干燥、在空气中灼烧,最终剩余固体的成分是 ( )A、Fe2O3、Al2O3 B、Fe2O3 C、Fe (OH)2、Al(OH)3 D、Fe(OH)3、Al(OH)39. 下列实验现象的描述正确的是( ) A、图1中铝箔熔化有液滴落下 B、图2中新切开的钠块表面很快变成黄色 C、图3中火焰呈苍白色,瓶口有白雾产生 D、图4中烧瓶内的溶液变成红色10. 下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
A、图1中铝箔熔化有液滴落下 B、图2中新切开的钠块表面很快变成黄色 C、图3中火焰呈苍白色,瓶口有白雾产生 D、图4中烧瓶内的溶液变成红色10. 下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )选项
陈述Ⅰ
陈述Ⅱ
A
Na2O2能与二氧化碳、水反应放出O2
Na2O2可用作呼吸面具的供氧剂
B
铝比铁活泼
铝比铁更容易被腐蚀
C
钠与水反应是放热反应
与水反应时,钠浮在水面上
D
晶体硅熔点高硬度大
可用于制作半导体材料
A、A B、B C、C D、D11. 下列有关说法正确的是( )A、分别向Na2CO3和NaHCO3溶液中逐滴加入稀盐酸至过量,产生的现象相同 B、分别向AlCl3溶液中逐滴加入NaOH溶液和氨水至过量,产生的现象相同 C、分别将FeO和Fe2O3溶于稀硝酸中,再加入KSCN溶液,溶液的颜色相同 D、分别向FeCl2和MgCl2溶液中,加入NaOH溶液至过量,沉淀的颜色相同12. 在硫酸铁溶液中,加入铜粉至完全溶解后,又加入一定量铁粉,充分反应后有残余固体,则下列判断正确的是( )A、残余固体可能为铁、铜混合物 B、最后得到的溶液中含有Fe3+ C、最后得到的溶液中只含Cu2+ D、残余固体一定全部是铜13. 金属及其化合物的转化关系是化学学习的重要内容之一。下列各组物质的转化关系,不全是可通过一步反应完成的是( )A、Na→NaOH→Na2CO3→NaCl B、Al→Al2O3→Al(OH)3→AlCl3 C、Mg→MgCl2→Mg(OH)2→MgSO4 D、Fe→FeCl2→Fe(OH)2→Fe(OH)314. 下列物质中,既能跟盐酸反应,又能跟NaOH溶液反应的化合物是( )①Al ②Al2O3 ③Al(OH)3 ④NaHCO3 ⑤Fe(OH)3 ⑥Fe2O3
A、①②③④ B、②③④ C、①③④⑤ D、①②④⑥15. 铝、氧化铝、氢氧化铝和可溶性铝盐与过量强碱溶液的反应,其生成物有一定的规律,下列说法中正确的是( )A、都有H2O生成 B、都有H2生成 C、都有AlO2-生成 D、都有Al3+生成16. 向物质的量浓度均为1 mol·L-1的AlCl3和盐酸的混合溶液中逐滴滴入NaOH溶液,下图[n表示Al(OH)3的物质的量、V表示NaOH溶液的体积]能正确表示这个反应过程的是( )A、 B、
B、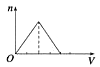 C、
C、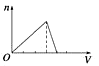 D、
D、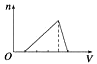 17. 下列各图中能较长时间看到Fe(OH)2白色沉淀的是( )
17. 下列各图中能较长时间看到Fe(OH)2白色沉淀的是( ) A、①②④ B、①②③ C、①③④ D、②③④18. 甲、乙两烧杯中各盛有100mL 3 mol/L的盐酸和氢氧化钠溶液,向两烧杯中加入等质量的铝粉,反应结束后生成气体的体积比为甲:乙 = 1:2,则加入铝粉的质量为( )A、5.4g B、3.6g C、2.7g D、1.8g19. 为了验证Fe3+的性质,某化学兴趣小组设计了下图所示的一组实验,其中实验方案设计错误的是 ( )
A、①②④ B、①②③ C、①③④ D、②③④18. 甲、乙两烧杯中各盛有100mL 3 mol/L的盐酸和氢氧化钠溶液,向两烧杯中加入等质量的铝粉,反应结束后生成气体的体积比为甲:乙 = 1:2,则加入铝粉的质量为( )A、5.4g B、3.6g C、2.7g D、1.8g19. 为了验证Fe3+的性质,某化学兴趣小组设计了下图所示的一组实验,其中实验方案设计错误的是 ( ) A、② B、③ C、③④ D、①②③④⑤20. 下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是( )
A、② B、③ C、③④ D、①②③④⑤20. 下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是( )①金属钠在纯氧中燃烧②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间
③FeCl3溶液中滴入KSCN溶液④无水硫酸铜放入医用酒精中
A、②③①④ B、①②③④ C、③①②④ D、③②①④21. a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种,已知:① a、c都能与稀硫酸反应放出氢气;② b和d的硝酸盐反应,置换出单质d;③ c与强碱反应放出气体;④ c、e在冷浓硫酸中发生钝化。由此可判断a、b、c、d、e依次是 ( )A、Fe Cu Al Ag Mg B、Al Cu Mg Ag Fe C、Mg Cu Al Ag Fe D、Mg Ag Al Cu Fe22. 将一定质量的镁铝合金投入100mL稀硝酸中完全溶解,反应过程中无气体放出。向反应后的溶液中,逐滴加入1.00 mol/L NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量关系如图所示,则下列说法错误的是( ) A、合金中镁铝的物质的量之比为1:2 B、合金完全溶解转移电子的物质的量为0. 032mol C、原稀硝酸的物质的量浓度为0. 45 mol/L D、F点溶液中,溶质仅为Na[Al(OH)4]23. 某黑色固体粉末可能是 Fe、FeO、CuO、C 中一种或几种。为了探究其成分,小明同学按照下 图所示流程进行了实验。
A、合金中镁铝的物质的量之比为1:2 B、合金完全溶解转移电子的物质的量为0. 032mol C、原稀硝酸的物质的量浓度为0. 45 mol/L D、F点溶液中,溶质仅为Na[Al(OH)4]23. 某黑色固体粉末可能是 Fe、FeO、CuO、C 中一种或几种。为了探究其成分,小明同学按照下 图所示流程进行了实验。
关于该实验有以下说法:
①若溶液甲呈浅绿色,则原黑色固体粉末中一定含有 Fe;
②若步骤Ⅱ中无明显现象,则固体乙中最多只能 有四种物质;
③若步骤Ⅱ中 有气泡产生,则原固体可能是纯净物也可能是混合物;
④若步骤Ⅱ中有红色固体析出,则固体乙中一定无 CuO;
⑤固 体乙呈红色,则原固体中一定含有 Fe 和 CuO。 以上说法中符合题意的个数是( )
A、1 个 B、2 个 C、3 个 D、4 个二、填空题
-
24. 有下列原料:①海水 ②石灰石 ③赤铁矿 ④铝土矿 ⑤焦炭 ⑥氧化汞
工业冶炼用 方法制Al,其原料主要是(填序号)。
工业冶炼用方法制Fe,其原料主要是(填序号)。
工业冶炼用方法制Hg,其原料主要是(填序号)。25. 用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成.①Al与NaOH溶液反应的离子方程式为 .
②焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是
③经处理后的熔渣36.0g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0g固体;滤液中加入过量NaOH溶液,分离得到21.4g固体;则此熔渣中Al2O3的质量分数为 .
26. 我国材料科学家师昌绪在合金钢、高温合金及材料强度的研究领域作出了杰出贡献,荣获2010年度国家最高科学技术奖.①合金是生活中常见的材料.某合金具有密度小、强度高的优良性能,常用于制造门窗框架.该合金中含量最高的金属元素的原子结构示意图为 .
②铁锈的主要成分是(填化学式),它是钢铁在潮湿的空气中发生腐蚀的结果.
③玻璃是一种常用的硅酸盐材料.制备普通玻璃的原料有Na2CO3、和(填化学式).
三、综合题
-
27. 某无色工业废水中可能含有Na+、Mg2+、Al3+、Cl-、SO42-中的几种离子。
a.取少许该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,产生白色沉淀,充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生。
b.另取10mL该废水于试管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解。生成沉淀的物质的量随加入NaOH的物质的量关系如下图所示。
根据上述实验和图中数据:(1)、该废水中一定不含有的离子有(填离子符号);(2)、写出A→B 过程中发生反应的离子方程式:;(3)、该废水中,c(Al3+)=;(4)、①实验室配制100mL2mol/L的NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要(填仪器名称)。②下列操作使所配溶液浓度偏大的是(填写字母)。
A.称量用了生锈的砝码
B.将NaOH放在纸张上称量
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶转移时,有少量液体贱出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液