辽宁省锦州市滨海新区2019高考化学模拟卷
试卷更新日期:2018-12-03 类型:高考模拟
一、单选题
-
1.
古丝绸之路贸易中的下列商品,主要成分属于无机物的是( )




A.瓷器
B.丝绸
C.茶叶
D.中草药
A、A B、B C、C D、D2. 化学与生产生活密切相关,下列说法错误的是( )A、Na2O2可与CO2反应放出氧气,可用于制作呼吸面具 B、SiO2具有导电性,可用于制作光导纤维和光电池 C、聚四氟乙烯耐酸碱腐蚀,可用作化工反应器的内壁涂层 D、氯水具有较强的氧化性,可用于漂白纸张、织物等3. 下列说法正确的是( )A、氢氧燃料电池放电时化学能全部转化为电能 B、反应4Fe(s)+3O2(g)=2Fe2O3(s)常温下可自发进行,该反应为吸热反应 C、3 mol H2与1 mol N2混合反应生成NH3 , 转移电子的数目小于6×6.02×1023 D、在酶催化淀粉水解反应中,温度越高淀粉水解速率越快4. 下列说法正确的是( )A、光照下,1 mol CH4最多能与4 mol Cl2发生取代反应,产物中物质的量最多的是CCl4 B、苯与浓硝酸和浓硫酸的混合液在一定条件下能发生取代反应 C、甲烷与乙烯混合物可通过溴的四氯化碳溶液分离 D、乙烯和苯分子中均含独立的碳碳双键,都能与H2发生加成反应5. 根据下列实验操作和现象所得出的结论正确的是( )选项
实验操作和现象
结论
A
向苯酚浊液中滴加Na2CO3溶液,浊液变清
苯酚的酸性强于H2CO3的酸性
B
向碘水中加入等体积CCl4 , 振荡后静置,上层接近无色,下层显紫红色
I2在CCl4中的溶解度大于在水中的溶解度
C
向CuSO4溶液中加入铁粉,有红色固体析出
Fe2+的氧化性强于Cu2+的氧化性
D
向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成
Ksp(AgCl) >Ksp(AgI)
A、A B、B C、C D、D6.汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用.下列有关汉黄芩素的叙述正确的是( )
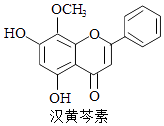 A、汉黄芩素的分子式为C16H13O5 B、该物质遇FeCl3溶液显色 C、1 mol该物质与溴水反应,最多消耗1mol Br2 D、与足量H2发生加成反应后,该分子中官能团的种类减少1种7. 在常温下,向10 mL浓度均为0.1 mol·Lˉ1的NaOH和Na2CO3混合溶液中滴加0.1 mol·Lˉ1的盐酸,溶液pH随盐酸加入体积的变化如图所示。 下列说法正确的是( )
A、汉黄芩素的分子式为C16H13O5 B、该物质遇FeCl3溶液显色 C、1 mol该物质与溴水反应,最多消耗1mol Br2 D、与足量H2发生加成反应后,该分子中官能团的种类减少1种7. 在常温下,向10 mL浓度均为0.1 mol·Lˉ1的NaOH和Na2CO3混合溶液中滴加0.1 mol·Lˉ1的盐酸,溶液pH随盐酸加入体积的变化如图所示。 下列说法正确的是( )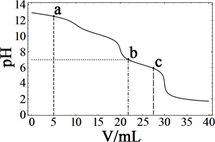 A、在a点的溶液中,c(Na+)>c(CO32-)>c(Clˉ)>c(OH‾)>c(H+) B、在b点的溶液中,2n(CO32-)+n(HCO3-)<0.001 mol C、在c点的溶液pH<7,是因为此时HCO的电离能力大于其水解能力 D、若将0.1 mol·Lˉ1的盐酸换成同浓度的醋酸,当滴至溶液的pH=7时:c(Na+)=c(CH3COOˉ)
A、在a点的溶液中,c(Na+)>c(CO32-)>c(Clˉ)>c(OH‾)>c(H+) B、在b点的溶液中,2n(CO32-)+n(HCO3-)<0.001 mol C、在c点的溶液pH<7,是因为此时HCO的电离能力大于其水解能力 D、若将0.1 mol·Lˉ1的盐酸换成同浓度的醋酸,当滴至溶液的pH=7时:c(Na+)=c(CH3COOˉ)二、综合题
-
8. 水合肼(N2H4·H2O) 是一种强还原剂,沸点118.5℃,熔点-40℃,常温下为无色透明的油状液体,属于二元弱碱,在空气中可吸收CO2而产生烟雾。水合肼的制备装置如图。
 (1)、装置A的名称为。向三颈烧瓶中加入溶液之前,应先从右侧导管中通入氮气,目的是。(2)、水合肼可用含NaOH 的NaClO溶液氧化尿素[CO(NH2)2]溶液制得,反应的化学方程式为。(3)、制备水合肼时,分液漏斗应盛装(填标号)。理由是。
(1)、装置A的名称为。向三颈烧瓶中加入溶液之前,应先从右侧导管中通入氮气,目的是。(2)、水合肼可用含NaOH 的NaClO溶液氧化尿素[CO(NH2)2]溶液制得,反应的化学方程式为。(3)、制备水合肼时,分液漏斗应盛装(填标号)。理由是。a.NaOH 和NaClO 混合溶液
b.CO(NH2)2 溶液
(4)、弱酸性条件下水合肼可处理电镀废水,将Cr2O72-还原为Cr(OH)3沉淀而除去,水合肼被氧化为N2 , 该反应的离子方程式为。常温下Ksp[Cr(OH)3]= 10-32 , 且当溶液中离子浓度小于10-5mol/L时可视作沉淀完全。则Cr3+沉淀完全时,溶液的pH=。(5)、有同学认为该实验收集装置有缺陷。请你写出改进措施:。9. 硝酸锶可用于制造烟火及信号弹等。工业级硝酸锶[含Ca(NO3)2、Ba(NO3)2等杂质] 的提纯流程如下。(已知: 硝酸锶、硝酸钡不溶于浓硝酸) (1)、要加快“酸浸”速率所采取的措施是(写一条即可)。(2)、操作1的名称是 , 洗涤所用的洗涤剂是 .(3)、“滤液2”中过量的H2CrO4被N2H4还原为Cr3+ , 同时放出无污染的气体,写出发生反应的离子方程式;氧化产物与还原产物的物质的量之比为 。(4)、已知Cr(OH)3不溶于水,还原后调节pH=8 的目的是 。(5)、为了测定“残渣2”中Cr元素的质量分数,进行以下实验。(已知: I2+2S2O32-=2I-+S4O62-)
(1)、要加快“酸浸”速率所采取的措施是(写一条即可)。(2)、操作1的名称是 , 洗涤所用的洗涤剂是 .(3)、“滤液2”中过量的H2CrO4被N2H4还原为Cr3+ , 同时放出无污染的气体,写出发生反应的离子方程式;氧化产物与还原产物的物质的量之比为 。(4)、已知Cr(OH)3不溶于水,还原后调节pH=8 的目的是 。(5)、为了测定“残渣2”中Cr元素的质量分数,进行以下实验。(已知: I2+2S2O32-=2I-+S4O62-)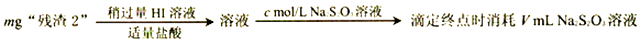
①“残渣2”中Cr元素的质量分数为(用代数式表示)。
②若加入的HI溶液过量太多,测定结果会是(填“偏高”、“偏低”或“无影响”),其原因是。
10. 氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化。(1)、研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)
2NO(g)+Cl2(g) 2ClNO(g) K2 ΔH2<0 (Ⅱ)
则4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g) ΔH =(用ΔH1、ΔH2表示);平衡常数K=(用K1、K2表示)
(2)、为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2 , 10min时反应(Ⅱ)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1 , NO的转化率α1=。其他条件保持不变,若反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2α1(填“>”、“<”或“=”)。(3)、汽车使用乙醇汽油可减少石油的消耗,并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。NO2尾气常用NaOH溶液吸收,生成NaNO3和 NaNO2 ,已知常温下NO2-的水解常数Kh=2×10-11 mol•L-1。 常温下某NaNO2和HNO2混合溶液的pH=5,则混合溶液中c(NO2-)和c(HNO2)的比值为。(4)、利用如图所示装置(电极均为惰性电极)也可吸收SO2 , 并用阴极排出的溶液吸收NO2。阳极的电极反应式为。在碱性条件下,用阴极排出的溶液吸收NO2 , 使其转化为无害气体N2 , 同时有SO42-生成。该应的离子方程式为。 (5)、某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀。查阅资料得知常温下BaSO3的Ksp=5.48×10-7 , 饱和亚硫酸中c(SO32-) =6.3×10-8 mol•L-1。将0.1 mol •L-1的BaCl2溶液滴入饱和亚硫酸中,(填“能”、“不能”)生成BaSO3沉淀,原因是(写出推断过程)。
(5)、某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀。查阅资料得知常温下BaSO3的Ksp=5.48×10-7 , 饱和亚硫酸中c(SO32-) =6.3×10-8 mol•L-1。将0.1 mol •L-1的BaCl2溶液滴入饱和亚硫酸中,(填“能”、“不能”)生成BaSO3沉淀,原因是(写出推断过程)。三、选考题(从下面2道题中任选1道题作答。)
-
11. [化学选修3:物质结构与性质】
翡翠是玉石中的一种,其主要成分为硅酸铝钠-NaAI(Si2O6),常含微量Cr、Ni、Mn、Mg、Fe等元素。回答下列问题:
(1)、基态Cr原子的电子排布式为;Fe位于元素周期表的 区。(2)、翡翠中主要成分硅酸锚钠表示为氧化物的化学式为 , 其中四种元素第一电离能由小到大的顺序是。(3)、钙和铁部是第四周期元素,且原子的最外层电子数相同,为什么铁的熔沸点远大于钙?。(4)、在硅酸盐中存在 结构单元,其中Si原子的杂化轨道类型为。当无限多个(用n表示) 分别以3个顶角氧和其他3个 形成层状结构时(如图所示),其中Si、O原子的数目之比为。若其中有一半的Si被Al替换,其化学式为。
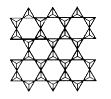 (5)、Cr和Ca可以形成种具有特殊导电性的复合氧化物,晶胞结构如图所示。该晶体的化学式为 , 若Ca与O的核间距离为x nm,则该晶体的密度为 g/cm3。
(5)、Cr和Ca可以形成种具有特殊导电性的复合氧化物,晶胞结构如图所示。该晶体的化学式为 , 若Ca与O的核间距离为x nm,则该晶体的密度为 g/cm3。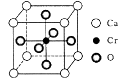 12. [化学一选修5:有机化学基础]
12. [化学一选修5:有机化学基础]聚对苯二甲酸丁二醇酯(PBT)是一种性能优异的热塑性高分子材料。PBT的一种合成路线如图所示:
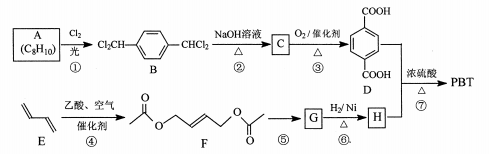
回答下列问题:
(1)、A的结构简式是 , C的化学名称是。(2)、⑤的反应试剂和反应条件分别是。(3)、F的分子式是 , ⑥的反应类型是。(4)、⑦的化学方程式是。(5)、M是H的同分异构体,同时符合_列条件的M可能的结构有种。a.0.1 molM与足量金属钠反应生成氢气2.24 L(标准状况)
b.同一个碳原子上不能连接2个羟基
其中核磁共振氢谱显示3组峰,且峰面积之比为3:1:1的结构简式是。
(6)、以2一甲基-1-3一丁二烯为原料(其它试剂任选),设计制备 的合成路线:
的合成路线: