安徽省濉溪中学2018-2019学年高三化学 电解与电池 单元测试卷
试卷更新日期:2018-12-02 类型:单元试卷
一、单选题
-
1. 化学与生活密切相关。下列说法错误的是A、泡沫灭火器可用于一般的起火,也适用于电器起火 B、疫苗一般应冷藏存放,以避免蛋白质变性 C、家庭装修时用水性漆替代传统的油性漆,有利于健康及环境 D、电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法2. 根据实验目的判断下列实验操作或装置正确的是( )
 A、A B、B C、C D、D3. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、硅晶体中,有NA个Si就有2 NA个Si—Si键 B、常温常压下,等物质的量浓度的Na2CO3与Na2S溶液中Na+数目相等 C、惰性电极电解食盐水,若线路中通过2 NA个电子的电量时,则阳极产生气体22.4 L D、标准状况下,2 mol Na2O2与44.8 L SO2完全反应,转移的电子数目为2 NA4. 下列有关电化学说法错误的是( )A、电池中电流由正极流向负极。锂电池比能量高,锂电池一般不用有机酸、醇、水溶液直接作电解质溶液 B、太阳能电池有的是物理过程,有的还包括一个循环往复的化学反应 C、硅铁合金(一种惰性材料)可做牺牲阳极的阴极保护法的阳极 D、电解时,有时一些阳离子、含氧酸根也可在阳极放电5. 利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。
A、A B、B C、C D、D3. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、硅晶体中,有NA个Si就有2 NA个Si—Si键 B、常温常压下,等物质的量浓度的Na2CO3与Na2S溶液中Na+数目相等 C、惰性电极电解食盐水,若线路中通过2 NA个电子的电量时,则阳极产生气体22.4 L D、标准状况下,2 mol Na2O2与44.8 L SO2完全反应,转移的电子数目为2 NA4. 下列有关电化学说法错误的是( )A、电池中电流由正极流向负极。锂电池比能量高,锂电池一般不用有机酸、醇、水溶液直接作电解质溶液 B、太阳能电池有的是物理过程,有的还包括一个循环往复的化学反应 C、硅铁合金(一种惰性材料)可做牺牲阳极的阴极保护法的阳极 D、电解时,有时一些阳离子、含氧酸根也可在阳极放电5. 利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。
下列说法错误的是( )
A、上述正极反应均为O2+4e-+2H2O=4OH- B、在不同溶液中,Cl是影响吸氧腐蚀速率的主要因素 C、向实验④中加入少量(NH4)2SO4固体,吸氧腐蚀速率加快 D、在300 min内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液6. 《Nature》期刊曾报道一例CH3OH-O2原电池,其工作示意图如下。下列说法错误的是( ) A、电极A是负极,发生氧化反应 B、电解质溶液中H+由A极流向B极 C、电极B的电极反应为:O2+2e-+H+=HO2- D、外电路中通过6mol电子,生成CO2的体积为22.4L7. 下面是电解饱和食盐水的装置,通电一段时间后下列说法错误的是( )
A、电极A是负极,发生氧化反应 B、电解质溶液中H+由A极流向B极 C、电极B的电极反应为:O2+2e-+H+=HO2- D、外电路中通过6mol电子,生成CO2的体积为22.4L7. 下面是电解饱和食盐水的装置,通电一段时间后下列说法错误的是( ) A、阴极附近溶液的pH增大 B、阳极产生的气体可用湿润的淀粉碘化钾试纸检验 C、若阳极最终收集到气体4.48L,则反应中转移电子的物质的量为0.4 mol D、完全电解后充分混合U型管中物质,所得溶液会含有NaClO8. 我国首艘001A型国产航母在大连造船厂建造。下列有关说法正确的是( )A、升降机的Al- Mg合金焊接过程中,可采用N2作保护气 B、为降低舰体钢材料中硅含量,冶炼过程中需使用O2和CaCO3 C、为测定螺旋浆Cu-Al合金中铜元素含量,只需使用氨水 D、为防止舰体在海水中发生电化学腐蚀,可镶嵌铜块9. 某研究小组设计如下装置处理pH为5-6的污水。下列说法正确的是( )
A、阴极附近溶液的pH增大 B、阳极产生的气体可用湿润的淀粉碘化钾试纸检验 C、若阳极最终收集到气体4.48L,则反应中转移电子的物质的量为0.4 mol D、完全电解后充分混合U型管中物质,所得溶液会含有NaClO8. 我国首艘001A型国产航母在大连造船厂建造。下列有关说法正确的是( )A、升降机的Al- Mg合金焊接过程中,可采用N2作保护气 B、为降低舰体钢材料中硅含量,冶炼过程中需使用O2和CaCO3 C、为测定螺旋浆Cu-Al合金中铜元素含量,只需使用氨水 D、为防止舰体在海水中发生电化学腐蚀,可镶嵌铜块9. 某研究小组设计如下装置处理pH为5-6的污水。下列说法正确的是( )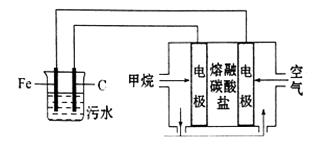 A、阳极的电极反应式为:Fe-3e-=Fe3+ B、正极的电极反应式为:O2+2H2O+4e-=4OH- C、若阴极转移2mol电子,则负极消耗5.6LCH4 D、污水中最终会产生Fe(OH)3 , 吸附污物而形成沉淀10. 十九大报告中提出要“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是( )
A、阳极的电极反应式为:Fe-3e-=Fe3+ B、正极的电极反应式为:O2+2H2O+4e-=4OH- C、若阴极转移2mol电子,则负极消耗5.6LCH4 D、污水中最终会产生Fe(OH)3 , 吸附污物而形成沉淀10. 十九大报告中提出要“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是( ) A、该电池放电时质子从Pt2电极经过内电路流到Pt1电极 B、Pt1电极附近发生的反应为:SO2+2H2O-2e-=H2SO4+2H+ C、Pt2电极附近发生的反应为O2+4e-+2H2O=4OH- D、相同条件下,放电过程中消耗的SO2和O2的体积比为2∶111.
A、该电池放电时质子从Pt2电极经过内电路流到Pt1电极 B、Pt1电极附近发生的反应为:SO2+2H2O-2e-=H2SO4+2H+ C、Pt2电极附近发生的反应为O2+4e-+2H2O=4OH- D、相同条件下,放电过程中消耗的SO2和O2的体积比为2∶111.图1是铜锌原电池示意图.图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
 A、铜棒的质量 B、c(Zn2+) C、c(H+) D、c(SO42﹣)12. 一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是
A、铜棒的质量 B、c(Zn2+) C、c(H+) D、c(SO42﹣)12. 一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是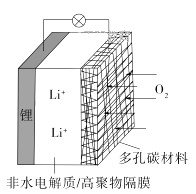 A、放电时,多孔碳材料电极为负极 B、放电时,外电路电子由多孔碳材料电极流向锂电极 C、充电时,电解质溶液中Li+向多孔碳材料区迁移 D、充电时,电池总反应为Li2O2-x=2Li+(1- )O213. 硫酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一,采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:
A、放电时,多孔碳材料电极为负极 B、放电时,外电路电子由多孔碳材料电极流向锂电极 C、充电时,电解质溶液中Li+向多孔碳材料区迁移 D、充电时,电池总反应为Li2O2-x=2Li+(1- )O213. 硫酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一,采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:
下列叙述错误的是( )
A、合理处理废旧电池有利于保护环境和资源再利用 B、从“正极片”中可回收的金属元素有Al、Fe、Li C、“沉淀”反应的金属离子为Fe3+ D、上述流程中可用硫酸钠代替碳酸钠14. 用惰性电极电解一定量的硫酸铜溶液,实验装置如下图甲。电解过程中的实验数据如下图乙,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体 积(标准状况)。则下列说法错误的是( )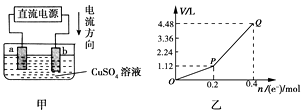 A、电解过程中,a电极表面先有红色物质析出,后有气泡产生 B、b电极上发生反应的方程式为:4OH--4e-=2H2O+O2↑ C、曲线O~P段表示O2的体积变化 D、从开始到Q点时收集到的混合气体的平均摩尔质量为12 g/mol15. 用电渗析法由NaH2PO2制备H3PO2的工作原理如图所示,下列说法正确的是( )
A、电解过程中,a电极表面先有红色物质析出,后有气泡产生 B、b电极上发生反应的方程式为:4OH--4e-=2H2O+O2↑ C、曲线O~P段表示O2的体积变化 D、从开始到Q点时收集到的混合气体的平均摩尔质量为12 g/mol15. 用电渗析法由NaH2PO2制备H3PO2的工作原理如图所示,下列说法正确的是( )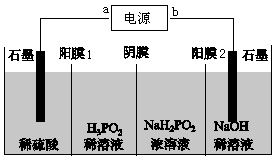 A、电源a极为负极,所连石墨电极上的反应为2H++2e-=H2↑ B、氢氧化钠溶液所在的极室中pH减小 C、H+由左向右穿过阳膜1,H2PO2-由右向左穿过阴膜 D、当导线中转移0.4mole-时,两石墨电极上产生气体体积之和为标准状况下4.48L
A、电源a极为负极,所连石墨电极上的反应为2H++2e-=H2↑ B、氢氧化钠溶液所在的极室中pH减小 C、H+由左向右穿过阳膜1,H2PO2-由右向左穿过阴膜 D、当导线中转移0.4mole-时,两石墨电极上产生气体体积之和为标准状况下4.48L二、综合题
-
16. 按要求对下图中两极进行必要的连接并填空:
 (1)、在A图中,使铜片上冒气泡。请加以必要联接,则联接后的装置叫。电极反应式:锌电极:;铜电极:。(2)、在B图中(a,b都为惰性电极),使a极析出铜,则b析出:。加以必要的联接后,该装置叫。电极反应式: b极: 。经过一段时间后,停止反应并搅均溶液,溶液的pH值(升高、降低、不变)。17. 如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.
(1)、在A图中,使铜片上冒气泡。请加以必要联接,则联接后的装置叫。电极反应式:锌电极:;铜电极:。(2)、在B图中(a,b都为惰性电极),使a极析出铜,则b析出:。加以必要的联接后,该装置叫。电极反应式: b极: 。经过一段时间后,停止反应并搅均溶液,溶液的pH值(升高、降低、不变)。17. 如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.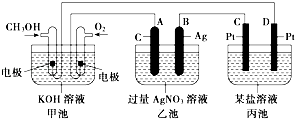 (1)、甲池是装置.(2)、乙池中A(石墨)电极的名称是 .(3)、写出通入CH3OH的电极的电极反应式: .(4)、乙池中反应的化学方程式为 .(5)、当乙池中B(Ag)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况);此时丙池某电极上析出1.60g某金属,则丙池中的某盐溶液可能是(填序号).
(1)、甲池是装置.(2)、乙池中A(石墨)电极的名称是 .(3)、写出通入CH3OH的电极的电极反应式: .(4)、乙池中反应的化学方程式为 .(5)、当乙池中B(Ag)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况);此时丙池某电极上析出1.60g某金属,则丙池中的某盐溶液可能是(填序号).A.MgSO4 B.CuSO4 C.NaCl D.AgNO3 .
18.(1)、丙烷燃烧可以通过以下两种途径:途径I:C3H8(g) + 5O2(g) = 3CO2(g) +4H2O(l) ΔH=-a kJ·mol-1
途径II:C3H8(g) = C3H6(g)+ H2(g) ΔH=+b kJ·mol-1
2C3H6(g)+ 9O2(g) = 6CO2(g) +6H2O(l) ΔH=-c kJ·mol-1
2H2(g)+O2 (g) = 2H2O(l) ΔH=-d kJ·mol-1 (abcd均为正值)
请回答下列问题:
①判断等量的丙烷通过两种途径放出的热量,途径I放出的热量(填“大于”、“等于”或“小于”)途径II放出的热量。
②b 与a、c、d的数学关系式是 。
(2)、甲醇是一种重要的试剂,有着广泛的用途,工业上可利用CO2制备甲醇。用CH4与CO2反应制H2和CO,再利用H2和CO化合制甲醇。已知:① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H1=-1450.0kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
③ 2H2(g)+O2(g)=2H2O(l) △H3=-571.6kJ·mol-1
则H2和CO制液态甲醇的热化学方程式为。
(3)、如图所示,某同学设计一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.
报据要求回答相关问题:
①写出甲中通甲醚一极的电极反应式。
②乙中发生的总反应的离子方程式为。
③将0.2mol AgNO3、0.4mol Cu(NO3)2 、0.6mol KCl溶于水,配成100mL溶液,用惰性电极电解一段时间后,某一电极上析出了0.3mol Cu,此时在另一电极上产生的气体体积(标准状况)为 L,若要使电解质溶液恢复到电解前的状态,需要加入固体的质量为g 。
19. 合成氨在生产中具有重要意义。请按要求回答下列问题。(1)、已知反应N2(g)+3H2(g) 2NH3(g) △H<0。向恒温恒容密闭的反应容器中投料1 mol N2、3 mol H2 , 在不同温度下分别达平衡时,混合气中NH3的物质的量分数随压强变化的曲线如图所示:
①曲线A、B、C对应的温度是由低到高依次是(填代表曲线的字母)。
图中X、Y、Z点的平衡常数大小关系(填“>”“<”或“=”): K(X) K(Y)K(Z).
②既能加快化学反应速率有能提高H2的转化率的措施有。
③Y点对应的H2的转化率是;若仅将起始投料均加倍,其他条件不变,达新平衡时,则H2的转化率将会(填“升高”、“降低”或“不变”) 。
(2)、电解法合成氨因其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。电解法合成氨的两种原理及装置如图甲和图乙所示:
①图甲a电极上的电极反应式为图乙d电极上的电极反应式为。
②若图甲和图乙装置的通电时间相同、电流强度相等,电解效率分别为80%和60%,则两种装置中产生氨气的物质的量之比为。
20. 研究化学反应原理对于生产、生活及环境保护具有重要意义。请回答下列问题:(1)、常温下,物质的量浓度均为0.1mol/L的四种溶液:①NH4I;②CH3COONa;③(NH4)2SO4;④ Na2CO3 , pH从大到小排列顺序为(填序号)。(2)、苯乙烯是工业上合成树脂、离子交换树脂及合成橡胶等的重要单体,工业上可用乙苯催化脱氢方法制备苯乙烯: 。
。①已知乙苯(g)、苯乙烯(g)的燃烧热分别为akJ/mol,bkJ/mol,则氢气的燃烧热为kJ/mol(用含有Q、a、b的表达式表示,其中Q、a、b均大于0)。
②在实际生产中,在恒压条件下常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),此时乙苯的平衡转化率与水蒸气的用量、压强(p)的关系如下图所示。

Ⅰ.加入水蒸气稀释剂能提高乙苯转化率的原因是
Ⅱ.用平衡分压代替平衡浓度计算平衡常数(Kp),其中,分压=总压×物质的量分数,则900K时的平衡常数Kp=.
Ⅲ.改变下列条件,能使乙苯的反应速率和转化率一定增大的是 (填字母)。
A.恒容时加入稀释剂水蒸气
B.压强不变下,温度升至1500K
C.在容积和温度不变下充入Ar
D.选用催化效果更好的催化剂
(3)、利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 2Na2CO3+C。放电时该电池“吸入”CO2 , 其工作原理如图所示:
①放电时,正极的电极反应式为。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2mol 电子时,两极的质量差为g。(假设放电前两电极质量相等)
21. 工业上用废弃固体(含有Cu2S、Al2O3、Fe2O3、SiO2 等)制取粗铜、绿矾(FeSO4·7H2O)和明矾[KAl(SO4)2·12H2O],操作流程如下: (1)、气体a是(写化学式,下同),试剂X是(已知X是一种盐),固体C是。(2)、明矾可以净水,明矾净水的原理是(用离子方程式表示)。(3)、利用反应2Cu+O2+2H2SO4
(1)、气体a是(写化学式,下同),试剂X是(已知X是一种盐),固体C是。(2)、明矾可以净水,明矾净水的原理是(用离子方程式表示)。(3)、利用反应2Cu+O2+2H2SO4 2CuSO4+2H2O可制备CuSO4 , 若将该反应设计成原电池,该电池的正极反应式为。 (4)、取少量产品绿矾,加水溶解后再滴入几滴KSCN溶液,若产品绿矾中不含有Fe3+ , 观察到的现象为;若在产品绿矾的水溶液中滴加酸性高锰酸钾溶液,观察到的现象为 , 原因是 (用离子方程式表示)。(5)、已知绿矾受热分解的化学方程式为2FeSO4·7H2O
2CuSO4+2H2O可制备CuSO4 , 若将该反应设计成原电池,该电池的正极反应式为。 (4)、取少量产品绿矾,加水溶解后再滴入几滴KSCN溶液,若产品绿矾中不含有Fe3+ , 观察到的现象为;若在产品绿矾的水溶液中滴加酸性高锰酸钾溶液,观察到的现象为 , 原因是 (用离子方程式表示)。(5)、已知绿矾受热分解的化学方程式为2FeSO4·7H2O Fe2O3+SO2↑+SO3↑+14H2O。称取3.5g产品绿矾,加热分解至恒重后(杂质受热不分解),将反应所得的气体缓缓通入盛有足量蒸馏水的锥形瓶中,再用0.1000 mol·L-1的酸性KMnO4溶液滴定,滴定到终点时消耗酸性KMnO4溶液的体积为25.00mL,则产品绿矾的纯度为 (保留三位有效数字)。
Fe2O3+SO2↑+SO3↑+14H2O。称取3.5g产品绿矾,加热分解至恒重后(杂质受热不分解),将反应所得的气体缓缓通入盛有足量蒸馏水的锥形瓶中,再用0.1000 mol·L-1的酸性KMnO4溶液滴定,滴定到终点时消耗酸性KMnO4溶液的体积为25.00mL,则产品绿矾的纯度为 (保留三位有效数字)。