第28讲:原子结构与性质
试卷更新日期:2018-11-30 类型:一轮复习
一、单选题
-
1. 原子结构模型经历了五个主要阶段:1803年实心球模型→1897年葡萄干面包式模型→1911年原子核式结构模型→1913 的轨道模型→20 世纪初电子云的原子结构模型。对轨道模型贡献最大的科学家是( )
A、玻尔 B、汤姆生 C、卢瑟福 D、道尔顿2. 与OH﹣具有相同质子数和电子数的微粒是( )A、F2 B、Cl﹣ C、NH3 D、NH2﹣3. 是常规核裂变产物之一,可以通过测定大气或水中 的含量变化来监测核电站是否发生放射性物质泄漏。下列有关 的叙述中错误的是( )A、 的化学性质与 相同 B、 的原子序数为53 C、 的原子核外电子数为78 D、 的原子核内中子数多于质子数4. 下列说法不正确的是( )A、质量数是将原子核内所有的质子和中子的相对质量取整数值之和 B、 表示一种X元素的一种原子,中子数为A-Z C、 中,A为该原子的相对原子质量的近似值 D、原子都是质子和中子、电子组成,原子不带电5. 短周期主族元素A、B、C、D、E的原子序数依次增大,其中A与C同主族,A与其它元素不在同一周期,B与D同主族,常温下D的单质为淡黄色固体。下列推断中正确的是( )
A、原子半径由小到大的顺序:r(C)<r(D)<r(E) B、元素D,E分别与A形成的化合物的热稳定性:E>D C、元素D的最高价氧化物对应水化物的酸性比E的强 D、元素B分别与A,C形成的化合物中化学键的类型完全相同6. 下列各组原子中,彼此化学性质一定相似的是( )A、原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 B、原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子 C、最外层都只有一个电子的X、Y原子 D、2p轨道上有一个空轨道的X原子与3p轨道上有一个空轨道的Y原子7. 下表为元素周期表中短周期的一部分,Y元素最高正价与最低负价的代数和为4,下列叙述正确的是( )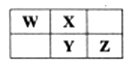 A、原子半径: W B、元素的非金属性:X>Y>Z C、氢化物的热稳定性:W>X D、氧化物对应水化物的酸性: Y8. 下列有关叙述正确的是( )A、元素性质呈周期性变化的根本原因是元素化合价呈周期性变化 B、BF3和CO2分子中所有原子均满足最外层为8电子结构 C、已知114号元素的一种核素的质量数为298,则该元素的相对原子质量为298 D、[14NH3T]+ 中,电子数、质子数、中子数之比为10:11:99. X、Y、Z、M是原子序数依次增大的短周期主族元素,Y的最外层电子数是内层电子数的3倍,Y与Z 形成的化合物Z2Y3中,元素质量比m(Y):m(Z)=8:9;X原子的最外层电子数为M原子和Z原子最外层电子数的和的一半。下列说法正确的是( )A、X的最高价氧化物的水化物一定为强酸 B、气态氢化物的沸点:Y<M C、原子半径Z>M>X>Y D、Z是地壳中含量最多的元素10. 下列说法或有关化学用语的表达错误的是( )A、在基态多电子原子中,p轨道电子能量不一定高于s轨道电子能量 B、核外电子排布由1s22s22p63s1→1s22s22p6 的变化需要吸收能量 C、Ca2+离子基态电子排布式为1s22s22p63s23p6 D、氧元素基态原子的电子排布图为
A、原子半径: W B、元素的非金属性:X>Y>Z C、氢化物的热稳定性:W>X D、氧化物对应水化物的酸性: Y8. 下列有关叙述正确的是( )A、元素性质呈周期性变化的根本原因是元素化合价呈周期性变化 B、BF3和CO2分子中所有原子均满足最外层为8电子结构 C、已知114号元素的一种核素的质量数为298,则该元素的相对原子质量为298 D、[14NH3T]+ 中,电子数、质子数、中子数之比为10:11:99. X、Y、Z、M是原子序数依次增大的短周期主族元素,Y的最外层电子数是内层电子数的3倍,Y与Z 形成的化合物Z2Y3中,元素质量比m(Y):m(Z)=8:9;X原子的最外层电子数为M原子和Z原子最外层电子数的和的一半。下列说法正确的是( )A、X的最高价氧化物的水化物一定为强酸 B、气态氢化物的沸点:Y<M C、原子半径Z>M>X>Y D、Z是地壳中含量最多的元素10. 下列说法或有关化学用语的表达错误的是( )A、在基态多电子原子中,p轨道电子能量不一定高于s轨道电子能量 B、核外电子排布由1s22s22p63s1→1s22s22p6 的变化需要吸收能量 C、Ca2+离子基态电子排布式为1s22s22p63s23p6 D、氧元素基态原子的电子排布图为
二、填空题
-
11. 元素X,Y,Z,M,N均为短周期主族元素,且原子序数依次增大.已知Y原子最外层电子数与核外电子总数之比为3:4;M元素原子的最外层电子数与电子层数之比为4:3;N﹣、Z+、X+的半径逐渐减小;化合物XN常温下为气体.据此回答:
①X为(名称),Y为(元素符号),Z原子结构示意图为 .
②N的最高价氧化物的水化物的化学式为 .
③工业上制取单质M的化学方程式为 .
12. A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和.(1)A为 ,B为 ,C为 .
(2)E的电子式为 .
(3)写出D的最高价氧化物的水化物和A单质反应的化学方程式
13. 锌是一种重要的金属,锌及其化合物有着广泛的应用.①指出锌在周期表中的位置:第周期,第族,基态Zn原子的电子排布式 .
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.葡萄糖分子中碳原子杂化方式有 .
14. 甲醛分子(CH2O)的中心原子(碳原子)的价层电子对数为 , 其孤电子对数为 , 则该分子呈形.甲醛分子的中心原子的杂化类型为 , 分子中共有个σ键,有个π键,其中C﹣H的σ键的类型为 , C﹣O的σ键的类型为 .15.下列原子或离子的电子排布的表示方法中,正确的是 , 违反了能量最低原理的是 , 违反洪特规则的是 .
①Ca2+:1s22s22p63s23p6
②F﹣:1s22s23p6
③

④Cr:1s22s22p63s23p63d44s2
⑤Fe:1s22s22p63s23p63d64s2
⑥Mg2+:1s22s22p6
⑦
 16. (1)下列现象和应用与电子跃迁无关的是 .
16. (1)下列现象和应用与电子跃迁无关的是 .A.激光 B.焰色反应 C.燃烧放热
D.原子光谱 E.霓虹灯 F.石墨导电
(2)A、B、C三种短周期元素,A是原子半径最小的元素,B原子最外层电子数是次外层的两倍,C元素的基态原子L层有两个未成对电子.某直线形分子由A、B两种元素组成且原子个数比为1:1,该分子中含有 个σ键, 个π键.
(3)CO的结构可表示为C≡O,N2的结构可表示为N≡N.下表是两者的键能数据:(单位:kJ/mol)
A﹣B
A=B
A≡B
C≡O
357.7
798.9
1071.9
N≡N
154.8
418.4
941.7
结合数据说明CO比N2活泼的原因:
(4)Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关.
①基态28Ni原子的核外电子排布式为 .
②Fe(CO)5常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型).
三、综合题
-
17. 由B、N及Mg、Ni等元素组成的新型材料有着广泛的用途,回答下列向题:(1)、Ni2+元素基态原子的电子排布式为。(2)、经测定发现,N2O5固体由NO2+和NO3-同种离子组成,该固体中N原子杂化类型为;与NO2+互为等电子体的微粒有(写出一种)。(3)、铵盐大多不稳定。NH4F、NH4I中,较易分解的是 , 原因是。(4)、第二周期中,第一电离能介于B元素和N元素间的元素为(填元素符号)(5)、已知NiO的晶体结构如图所示。
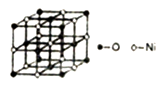
①NiO的晶体结构可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中。则NiO晶体中镍原子填充在氧原子形成的体空隙中。
②已知MgO与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm,则熔点MgONiO(填“>”、“<”或“=”),理由是。
(6)、硼和氮构成的一种氮化硼晶体的结构与石墨晶体结构相类似B、N原子相互交替排列如图左下图,其晶胞结构如右下图所示。设层内B-N核间距为apm,面间距为bpm,则该氮化硼晶体的密度为g/cm3(用含a、b、NA的代数式表示)。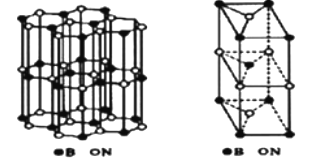 18. [化学选修3:物质结构与性质】
18. [化学选修3:物质结构与性质】翡翠是玉石中的一种,其主要成分为硅酸铝钠-NaAI(Si2O6),常含微量Cr、Ni、Mn、Mg、Fe等元素。回答下列问题:
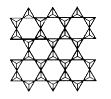
(1)、基态Cr原子的电子排布式为;Fe位于元素周期表的 区。(2)、翡翠中主要成分硅酸锚钠表示为氧化物的化学式为 , 其中四种元素第一电离能由小到大的顺序是。(3)、钙和铁部是第四周期元素,且原子的最外层电子数相同,为什么铁的熔沸点远大于钙?。(4)、在硅酸盐中存在 结构单元,其中Si原子的杂化轨道类型为。当无限多个(用n表示) 分别以3个顶角氧和其他3个 形成层状结构时(如图所示),其中Si、O原子的数目之比为。若其中有一半的Si被Al替换,其化学式为。
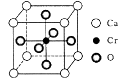
 (5)、Cr和Ca可以形成种具有特殊导电性的复合氧化物,晶胞结构如图所示。该晶体的化学式为 , 若Ca与O的核间距离为x nm,则该晶体的密度为 g/cm3。
(5)、Cr和Ca可以形成种具有特殊导电性的复合氧化物,晶胞结构如图所示。该晶体的化学式为 , 若Ca与O的核间距离为x nm,则该晶体的密度为 g/cm3。