浙教版科学2018-2019学年九年级上学期 第二章物质转化与材料利用 单元试卷
试卷更新日期:2018-11-29 类型:单元试卷
一、选择题
-
1. 下列各种实验仪器中,主要制作材料属于金属材料的是( )A、试管
 B、蒸发皿
B、蒸发皿  C、铁架台
C、铁架台  D、橡胶塞
D、橡胶塞  2. 比较、推理是化学学习常用的方法,以下是根据一些实验事实推理出的影响化学反应的因素,其中推理不合理的是( )
2. 比较、推理是化学学习常用的方法,以下是根据一些实验事实推理出的影响化学反应的因素,其中推理不合理的是( )选项
实验事实
影响化学反应的因素
A
铁丝在空气中很难燃烧,而在氧气中能剧烈燃烧
反应物浓度
B
碳在常温下不与氧气反应,而在点燃时能与氧气反应
反应温度
C
双氧水在常温下缓慢分解,而在加入二氧化锰后迅速分解
有、无催化剂
D
铜片在空气中很难燃烧,铜粉在空气中较易燃烧
反应物的种类
A、A B、B C、C D、D3. 芯片是电脑的核心部件,它是用高纯度硅制成的。下面是生产单质硅过程中的一个重要反应:SiO2+2C Si+2CO↑,该反应的基本类型是( )A、分解反应 B、化合反应 C、置换反应 D、复分解反应4. 如图表示的是纯净物、单质、化合物、含氧化合物、氧化物之间的包含与被包含关系,若整个大圆代表纯净物,则①③所属的类别是( )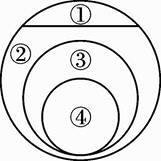 A、①化合物、③氧化物 B、①化合物、③含氧化合物 C、①单质、③氧化物 D、①单质、③含氧化合物5. 在柠檬中插入两种不同的金属可以制得水果电池。相同条件下,水果电池的电压与两种金属的活动性差异大小有关。下列柠檬电池的两种金属,活动性差异最大的是( )A、
A、①化合物、③氧化物 B、①化合物、③含氧化合物 C、①单质、③氧化物 D、①单质、③含氧化合物5. 在柠檬中插入两种不同的金属可以制得水果电池。相同条件下,水果电池的电压与两种金属的活动性差异大小有关。下列柠檬电池的两种金属,活动性差异最大的是( )A、 B、
B、 C、
C、 D、
D、 6. 将混有少量氧化铜粉末的锌粉放入含有稀盐酸的烧杯中,充分反应后,发现烧杯底还有剩余固体,取少量固体滴加稀盐酸,发现会冒气泡,则下列分析正确的是( )A、剩余固体只有铜 B、剩余固体只有锌 C、滤液中的溶质是氯化锌 D、滤液中的溶质是氯化铜、氯化锌7. 为了探究镁、锌、铜三种金属的活动性强弱,将形状、大小相同的三种金属分别放入装有X溶液的试管中,通过观察现象即能得出实验结论。则X溶液是( )A、稀硫酸 B、硝酸银溶液 C、氯化铜溶液 D、氯化镁溶液8. 有如下两个转化均可通过一步反应实现:CO →CO2 , HCl→ZnCl2 , 对于这两个转化过程分析正确的是( )A、都能与非金属单质反应实现 B、都能与金属氧化物反应实现 C、都能通过置换反应实现 D、都能通过复分解反应实现9. 在FeCl2和CuCl2的混合溶液中加入Zn粉,下列说法错误的是( )A、若反应完成后Zn无剩余,溶液中若有CuCl2 , 则一定有FeCl2 B、若反应完成后Zn无剩余,溶液中若无CuCl2 , 则可能有FeCl2 C、若反应完成后Zn有剩余,则溶液中有ZnCl2 , 无CuCl2和FeCl2 D、若反应完成后Zn有剩余,则溶液中有ZnCl2 , 无CuCl2 , 可能有FeCl210. 现有甲、乙、丙三种金属,先将三者分别加入到硫酸亚铁溶液中,只有甲可使溶液中析出铁单质。再将三者加入到硝酸银溶液中,只有乙不能使溶液中析出银单质,则三者的金属活动性从大到小的顺序是( )A、甲>乙>丙 B、乙>甲>丙 C、甲>丙>乙 D、无法判断11. 除去下列物质中的少量杂质,所用试剂和方法正确的是( )
6. 将混有少量氧化铜粉末的锌粉放入含有稀盐酸的烧杯中,充分反应后,发现烧杯底还有剩余固体,取少量固体滴加稀盐酸,发现会冒气泡,则下列分析正确的是( )A、剩余固体只有铜 B、剩余固体只有锌 C、滤液中的溶质是氯化锌 D、滤液中的溶质是氯化铜、氯化锌7. 为了探究镁、锌、铜三种金属的活动性强弱,将形状、大小相同的三种金属分别放入装有X溶液的试管中,通过观察现象即能得出实验结论。则X溶液是( )A、稀硫酸 B、硝酸银溶液 C、氯化铜溶液 D、氯化镁溶液8. 有如下两个转化均可通过一步反应实现:CO →CO2 , HCl→ZnCl2 , 对于这两个转化过程分析正确的是( )A、都能与非金属单质反应实现 B、都能与金属氧化物反应实现 C、都能通过置换反应实现 D、都能通过复分解反应实现9. 在FeCl2和CuCl2的混合溶液中加入Zn粉,下列说法错误的是( )A、若反应完成后Zn无剩余,溶液中若有CuCl2 , 则一定有FeCl2 B、若反应完成后Zn无剩余,溶液中若无CuCl2 , 则可能有FeCl2 C、若反应完成后Zn有剩余,则溶液中有ZnCl2 , 无CuCl2和FeCl2 D、若反应完成后Zn有剩余,则溶液中有ZnCl2 , 无CuCl2 , 可能有FeCl210. 现有甲、乙、丙三种金属,先将三者分别加入到硫酸亚铁溶液中,只有甲可使溶液中析出铁单质。再将三者加入到硝酸银溶液中,只有乙不能使溶液中析出银单质,则三者的金属活动性从大到小的顺序是( )A、甲>乙>丙 B、乙>甲>丙 C、甲>丙>乙 D、无法判断11. 除去下列物质中的少量杂质,所用试剂和方法正确的是( )选项
物质
杂质
试剂和方法
A
NaNO3
Na2CO3
滴入足量稀盐酸至不再产生气泡
B
KCl
K2SO4
滴入适量Ba(NO3)2溶液、过滤
C
CO
CO2
通过灼热的氧化铜粉末
D
H2
HCl
先通过NaOH溶液,再通过浓硫酸
A、A B、B C、C D、D12. 对下列事实的说明中,有错误的是( )A、氢气能还原氧化铜,说明氢气具有还原性 B、常温下氯酸钾能溶于水而难溶于酒精,说明氯酸钾的溶解性跟溶剂有关 C、相同条件下,湿衣服摊开比堆着干得快,说明水蒸发快慢与水的表面积有关 D、铁丝能在氧气中剧烈燃烧,说明氧气和铁丝都具有可燃性13. 下列图像能正确反应其对应操作中各量变化关系的是( ) A、分别向等质量的铝、铁中加入溶质质量分数相等的稀盐酸至过量 B、向稀盐酸中逐渐加入蒸馏水 C、向一定温度下的饱和澄清石灰水中加入少量氧化钙固体 D、向等质量的稀硫酸中加入足量的镁、铁、锌三种金属14. 甲、乙、丙三种物质间只通过一步反应就能实现如箭头所指方向的转化,下列不符合要求的甲、乙、丙依次为( )
A、分别向等质量的铝、铁中加入溶质质量分数相等的稀盐酸至过量 B、向稀盐酸中逐渐加入蒸馏水 C、向一定温度下的饱和澄清石灰水中加入少量氧化钙固体 D、向等质量的稀硫酸中加入足量的镁、铁、锌三种金属14. 甲、乙、丙三种物质间只通过一步反应就能实现如箭头所指方向的转化,下列不符合要求的甲、乙、丙依次为( ) A、O2、CuO、H2O B、Na2CO3、Na2SO4、NaOH C、FeSO4、FeCl2、Fe D、CaCO3、CaCl2、CO215. 某废液中只含有Fe(NO3)2、Cu(NO3)2、Ba(NO3)2三种溶质,为了回收金属、保护环境,小科设计了如图方案(所加试剂均过量),下列判断正确的是( )
A、O2、CuO、H2O B、Na2CO3、Na2SO4、NaOH C、FeSO4、FeCl2、Fe D、CaCO3、CaCl2、CO215. 某废液中只含有Fe(NO3)2、Cu(NO3)2、Ba(NO3)2三种溶质,为了回收金属、保护环境,小科设计了如图方案(所加试剂均过量),下列判断正确的是( ) A、固体a是铜 B、X一定是Na2SO4 C、溶液B中含有的盐有Ba(NO3)2、NaNO3 D、若回收到6.4 克固体a,则加入的铁屑质量为5.6克
A、固体a是铜 B、X一定是Na2SO4 C、溶液B中含有的盐有Ba(NO3)2、NaNO3 D、若回收到6.4 克固体a,则加入的铁屑质量为5.6克二、填空与简答题
-
16. 我国化学家傅鹰教授有一句名言“科学只给我们知识,而历史却给我们智慧”。在科学学习中,了解知识的发展历程,可以促进我们正确理解科学本质。(1)、我国西汉时期就有“曾青得铁则化为铜”的记载,期中蕴涵的湿法冶铜原理为(用化学方程式表示)。(2)、火药起源于唐朝。为使烟火产生耀眼的白光,可在火药中加入(填一种金属名称)。(3)、十八世纪,化学家们研究发现某些金属与酸反应能生成一种气体,该气体被喻为“会制造水的物质”,对上述反应原理的认识加快了推翻燃素学说的进程。该气体在空气中燃烧制造水的化学方程式是。(4)、现代以来,人们对金属的认识不断深入,助推多种新材料的研制与使用。2017年5月5日我国首架试飞成功的大型客机C919使用了多种新材料,其中有锂铝合金,在飞机制造中使用该材料说明其具有的优点有(填序号)。
①硬度大 ②密度小 ③易导电 ④耐腐蚀
17. 通过钝化的方式使锌制品表面形成一层保护膜,可有效防止锌的腐蚀。某锌制品的钝化液含有硝酸银、硝酸铜、重铬酸等,其中重铬酸是一种可溶性的酸。(1)、该钝化液pH7。(填“>”“<”或“=”)(2)、重铬酸(H2Cr2O7)中铬元素的化合价为。(3)、反应过程中会产生含有金属单质的细微颗粒,该颗粒中一定含有的金属是。18. 为验证Zn、Fe、Cu的金属活动性强弱,某同学设计了如下方案:方案一:Zn、Fe、HCl、Cu 方案二:Zn、FeSO4、Cu
方案三:ZnSO4、Fe、CuSO4 方案四:Zn、Fe、CuSO4
(1)、选出一种可行的方案,并对此方案作出评价:。(2)、写出你所选方案中发生的化学反应方程式(写出一个即可)。19. 修建铁路所需大量钢铁是以铁矿石为主要原料冶炼而得。(1)、钢是含0.03%~2%的铁合金;(2)、写出用一氧化碳和赤铁矿炼铁的化学方程式;(3)、雨后的铁轨表面易产生少量的锈迹,这是因为;(4)、实验室可用盐酸除铁锈,其化学方程式为;(5)、铝热剂是修建铁路时常用的焊接材料,其反应原理是铝在一定条件下与氧化铁反应得到熔融的铁与另一种氧化物,该反应基本类型是。20. 某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如下操作方案,结合方案回答下列问题: (1)、固体A中含有和 , 无色气体X为(均填化学式)。(2)、步骤①中反应的化学方程式为。(3)、操作a的名称为 , 在该操作中用到了玻璃棒,其作用为。(4)、理论上所得硫酸亚铁晶体的质量(填“>”“<”或“=”)原废液中硫酸亚铁的质量。21. 某化学兴趣小组利用如图所示装置进行实验,探究工业炼铁的化学原理,试按要求填空:
(1)、固体A中含有和 , 无色气体X为(均填化学式)。(2)、步骤①中反应的化学方程式为。(3)、操作a的名称为 , 在该操作中用到了玻璃棒,其作用为。(4)、理论上所得硫酸亚铁晶体的质量(填“>”“<”或“=”)原废液中硫酸亚铁的质量。21. 某化学兴趣小组利用如图所示装置进行实验,探究工业炼铁的化学原理,试按要求填空: (1)、硬质玻璃管中观察到的现象是 , 写出一氧化碳和氧化铁反应的化学方程式。(2)、实验中先通入一氧化碳的目的是。(3)、装置中导管末端加一点燃的酒精灯的目的是。22. 为了比较甲、乙两种金属的活动性强弱和相对原子质量大小,小吴设计了一套实验装置(如图)。他取两种金属(表面积相同)各m克,分别加入足量的稀硫酸(相同质量和质量分数)进行反应。在相同条件下测定不同时间内收集到的气体体积,实验记录如下表:
(1)、硬质玻璃管中观察到的现象是 , 写出一氧化碳和氧化铁反应的化学方程式。(2)、实验中先通入一氧化碳的目的是。(3)、装置中导管末端加一点燃的酒精灯的目的是。22. 为了比较甲、乙两种金属的活动性强弱和相对原子质量大小,小吴设计了一套实验装置(如图)。他取两种金属(表面积相同)各m克,分别加入足量的稀硫酸(相同质量和质量分数)进行反应。在相同条件下测定不同时间内收集到的气体体积,实验记录如下表:反应时间(秒)
20
40
60
80
100
120
140
收集到的气体
体积(毫升)
甲金属
25
60
95
130
160
170
170
乙金属
30
75
120
150
150
150
150
 (1)、由实验结果可知:金属活动性较强的是。(2)、为使得到的实验数据准确,小吴开始收集气体的时间点应该是____。A、导管口一有气泡冒出时 B、冒出气泡连续且均匀时 C、检验产生的气体纯净时(3)、根据已有实验数据,要比较甲、乙两种金属的相对原子质量大小,还需知道____。A、参加反应的硫酸质量 B、生成物中金属元素的化合价
(1)、由实验结果可知:金属活动性较强的是。(2)、为使得到的实验数据准确,小吴开始收集气体的时间点应该是____。A、导管口一有气泡冒出时 B、冒出气泡连续且均匀时 C、检验产生的气体纯净时(3)、根据已有实验数据,要比较甲、乙两种金属的相对原子质量大小,还需知道____。A、参加反应的硫酸质量 B、生成物中金属元素的化合价三、实验探究题
-
23. 一般不用K、Ca、Na等活泼金属来置换盐溶液中的其他金属元素,这是教科书上的一句话。小科对此进行了思考,并查阅资料,对金属钠和硫酸铜溶液的反应进行探究。
【查阅资料】钠常温下就能与水发生剧烈反应,反应方程式为2Na+2H2O=2NaOH+H2↑。
【提出猜想】猜想一:金属钠和硫酸铜溶液反应会有铜生成。
猜想二:金属钠和硫酸铜溶液反应,生成的沉淀只有氢氧化铜。
【实验及现象】切取不同大小的钠块分别投入到两种不同浓度的硫酸铜溶液中,有关产生沉淀的现象如表所示:
实验编号
钠块大小
硫酸铜溶液
实验中产生沉淀的现象
①
绿豆大小
稀溶液10毫升
产生蓝绿色沉淀
②
绿豆大小
浓溶液10毫升
产生蓝色絮状沉淀
③
豌豆大小
稀溶液10毫升
产生蓝色絮状沉淀
④
豌豆大小
浓溶液10毫升
产生蓝色絮状沉淀,并出现黑色固体
小科咨询老师后得知蓝绿色沉淀为碱式铜盐。
(1)、【实验结论】a.上述实验中均未观察到色固体生成,由此判断猜想一错误。
b.实验①中观察到的沉淀是蓝绿色的,由此判断猜想二也错误。
(2)、【实验反思】a.实验中生成氢氧化铜沉淀的原理是。b.由上述实验可知,导致钠和硫酸铜溶液反应的产物不同的因素有。
c.为了用钠置换硫酸铜中的铜元素,小科设计了如下实验方案:
方案一:把钠块和无水硫酸铜直接混合,在干燥的空气中加热。
方案二:把钠块和无水硫酸铜直接混合,隔绝空气加热。
两个方案中,更合理的方案是 , 理由是。
四、计算题
-
24. 某同学家的下水管道堵塞了,于是他买了一瓶“管道疏通剂”(部分说明如图)。疏通剂是利用铝与氢氧化钠溶液反应时放出大量的热,以加快氢氧化钠与毛发等淤积物的作用,反应的原理为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑。请回答下列有关问题:
 (1)、该管道疏通剂需要密封保存的原因是。(2)、按照使用说明,该同学对“疏通剂”作了进一步研究。先向烧杯中加入206克水,再加入本品200克,当铝粉全部反应后,求:(计算结果保留1位小数)
(1)、该管道疏通剂需要密封保存的原因是。(2)、按照使用说明,该同学对“疏通剂”作了进一步研究。先向烧杯中加入206克水,再加入本品200克,当铝粉全部反应后,求:(计算结果保留1位小数)①生成氢气的体积。(ρ氢气=0.09克/升)
②反应后溶液中氢氧化钠的质量分数。
-