广东省深圳市2019年中考化学模拟试卷
试卷更新日期:2018-11-28 类型:中考模拟
一、单选题
-
1. 下列化学符号中数字“2”表示的意义,正确的是( )A、SO2:表示二氧化硫中含有2个氧原子 B、2Fe:表示2个铁原子 C、 :表示一个镁离子带2个单位正电荷 D、S2﹣:表示硫元素的化合价为﹣2价2. 下列化学家中,发现元素周期律并制出元素周期表的是( )A、道尔顿
 B、拉瓦锡
B、拉瓦锡  C、阿伏加德罗
C、阿伏加德罗  D、门捷列夫
D、门捷列夫  3. “绿水青山就是金山银山”。下列行为符合该理念的是( )
3. “绿水青山就是金山银山”。下列行为符合该理念的是( )
A、塑料制品很便宜,用完就扔 B、大量燃放烟花爆竹,增强节日气氛 C、实验后的废液直接倒入水池中 D、尽量乘公共交通或骑自行车出行4. 硒是人体必需的微量元素,甲图是其原子结构示意图,乙图摘自元素周期表部分信息略去。据此判断下列叙述正确的是( )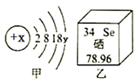 A、硒原子质量为78.96g B、y=4 C、Se是非金属元素 D、硒与氧位于同一周期5. 下列说法错误的是( )
A、硒原子质量为78.96g B、y=4 C、Se是非金属元素 D、硒与氧位于同一周期5. 下列说法错误的是( )
A、元素的种类是有限的,由元素组成的物质种类是无限的 B、氧气在氧化反应中提供氧,具有氧化性,物质与氧气的反应都会发光、发热 C、利用明矾溶于水后生成胶状物对杂质进行吸附,使杂质沉降来达到净水的目的 D、由于原子核内质子所带电荷与核外电子的电荷数量相等、电性相反,因此原子不显电性6. 正确的操作能保证化学实验的顺利进行,下列实验操作正确的是( )
A、读取液体体积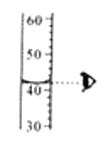 B、滴加试剂
B、滴加试剂  C、过滤
C、过滤  D、称量氢氧化钠
D、称量氢氧化钠  7. 丁烯(C4H8)是一种重要的化工原料,下列有关说法正确的是( )
7. 丁烯(C4H8)是一种重要的化工原料,下列有关说法正确的是( )
A、丁烯中C,H元素的质量比为1:2 B、丁烯中碳元素位于元素周期表第二周期 C、丁烯分子中碳原子的结构示意图为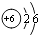 D、丁烯分子中含有4个碳元素和8个氢元素
8. 甲和乙在一定条件下反应生成丙和丁。结合微观示意图分析,下列结论正确的是( )
D、丁烯分子中含有4个碳元素和8个氢元素
8. 甲和乙在一定条件下反应生成丙和丁。结合微观示意图分析,下列结论正确的是( ) A、丙的相对分子质量为32 g B、生成的丙和丁的分子个数比为2∶1 C、发生反应的甲和乙的质量比为22∶3 D、反应前后分子种类不变9. 氯化钾(KCl)和氯酸钾(KClO3)的溶解度随温度变化曲线如右图所示,下列说法正确的是( )
A、丙的相对分子质量为32 g B、生成的丙和丁的分子个数比为2∶1 C、发生反应的甲和乙的质量比为22∶3 D、反应前后分子种类不变9. 氯化钾(KCl)和氯酸钾(KClO3)的溶解度随温度变化曲线如右图所示,下列说法正确的是( )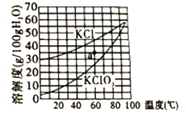 A、30℃时,KCl饱和溶液的溶质质量分数为35% B、60℃时,a点对应KCl溶液恒温加水可变饱和 C、KCl的溶解度随温度变化的趋势比KClO3大 D、90℃150gKClO3饱和溶液降温到10℃可析出45g晶体10. 除去下列物质中的少量杂质,所选试剂和操作都正确的是( )
A、30℃时,KCl饱和溶液的溶质质量分数为35% B、60℃时,a点对应KCl溶液恒温加水可变饱和 C、KCl的溶解度随温度变化的趋势比KClO3大 D、90℃150gKClO3饱和溶液降温到10℃可析出45g晶体10. 除去下列物质中的少量杂质,所选试剂和操作都正确的是( )选项
混合物(括号内为杂质)
除杂所用的试剂和操作
A
CuO(C)
在空气中充分灼烧
B
NaCl溶液(CuCl2)
加入适量的KOH溶液,过滤
C
N2(O2)
将燃着的蜡烛伸入其中
D
KCl(MnO2)
加水溶解、过滤、洗涤、干燥
A、A B、B C、C D、D二、推断题
-
11. 下图为A~G(初中常见物质)的转化关系,其中A是天然气的主要成分。

根据以上信息回答下列问题:
(1)、写出A 的化学式: , 其常见用途为(任写一条)。(2)、反应①的现象为
(3)、写出反应②的化学方程式 ,该反应属于 反应(填基本反应类型)。
(4)、写出反应③的化学方程式
(5)、Na2O与CaO的化学性质相似,下列物质中 (填标号)能与Na2O发生化学反应。
a.Mg
b.N2
c.稀盐酸
d.NaCl固体
三、实验探究题
-
12. 某课外活动小组进行如下实验探究。
 (1)、验证物质的燃烧条件
(1)、验证物质的燃烧条件根据图1进行实验,实验现象如图所示。
①80℃热水的作用是。
②比较现象a、c,得出燃烧的条件是。
(2)、验证锌与铁的金属活动性①相同条件下,取等质量锌粉、铁粉,根据图2进行实验,实验过程中,观察到锌粉表面产生气泡的速率比铁粉快,由此得到的结论是。
②实验结束后,发现∪形管两边的金属粉末均无剩余,则硫酸剩余的情况可能是(填序号)。
A.左、右两边均有剩余
B.左边有剩余,右边无剩余
C.左、右两边均无剩余
D.左边无剩余,右边有剩余
(3)、测定水中氢氧元素的质量比(已知H2+CuO Cu+H2O)根据图3进行实验,反应后测得甲中玻璃管(含药品)质量减少ag,乙中U形管(含药品)质量增加bg。
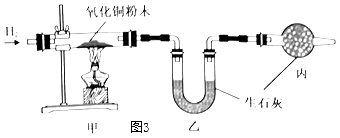
①水中氢、氧元素的质量比是(用含 a、b的式子表示)。
②下列因素中,对测定结果有影响的是(填序号)。
A.CuO粉末不干燥
B.CuO没有完全转化为Cu
C.没有丙装置
四、计算题
-
13. 人类对金属的冶炼和使用经历了漫长的历史。(1)、模拟炼铁的实验装置如图所示,请回答下列问题:

加热氧化铁之前,先通一段时间CO的作用是。加热后,玻璃管中的实验现象为:粉末 ;试管里的澄清石灰水变浑浊,原因是(用化学方程式表示);实验设计的最后一步目的是。
(2)、为测定某赤铁矿石中氧化铁的质量分数,用足量的一氧化碳与20g 赤铁矿石样品充分反应(发生 反应,杂质不参与反应),并将生成的气体用氢氧化钠溶液完全吸收,溶液总质量与反应时间的变化关系如图。
上述反应产生二氧化碳的质量为g。
(3)、计算该赤铁矿石中氧化铁的质量分数。(根据化学方程式写出完整的计算步骤,结果保留一位小数)
-
-