2018-2019学年人教版化学九年级下册第八单元课题3 金属资源的利用和保护 同步训练
试卷更新日期:2018-11-28 类型:同步测试
一、单选题
-
1. 保护金属资源的有效途径,不包括下列的( )A、合理开采矿物 B、寻找金属替代品 C、回收利用金属 D、禁止使用铁制品2. 下列有关高炉炼铁的说法正确的一组是( )
①高炉中焦炭的作用是产生一氧化碳
②高炉中焦炭的作用是供热
③高炉炼铁得到的产品是钢
④高炉炼铁的原料有铁矿石、焦炭、石灰石、空气等.
A、①②③ B、②③④ C、①③④ D、①②④3. 下列矿石中,其主要成分属于氧化物的是( )A、黄铁矿 B、赤铁矿 C、菱铁矿 D、石灰石4. 铁是一种常见的金属.下列有关铁的叙述正确的是( )A、生铁和钢的主要成分是碳 B、铁的冶炼是用一氧化碳将单质铁转化为铁的氧化物 C、焊接铁制品前常用稀盐酸清除表面的铁锈 D、防止铁制品生锈通常采用在其表面抹食盐水、涂油或刷油漆等方法5. 下列说法中,不正确的是( )A、赤铁矿的主要成分是Fe2O3 B、不锈钢是一种混合物 C、铁制品表面刷漆能防锈 D、炼铁时CO发生还原反应6. 在化学反应C+H2O H2+CO中,具有还原性的物质是( )A、C B、H2O C、H2 D、CO7. 对比实验是实验探究的重要方法,下列对比实验设计能实现相应实验目的的是( )选项
实验目的
实验设计
选项
实验目的
实验设计
A
探究温度对分子运动快慢的影响

B
探究水对铁钉锈蚀的影响
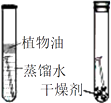
C
探究空气是燃烧的必要条件
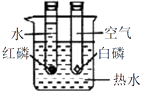
D
探究CO2与水反生反应
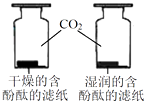 A、A B、B C、C D、D8. 碳、一氧化碳分别与氧化铜反应的实验中,下列有关说法不正确的是( )A、都发生了置换反应 B、黑色物质都变成了红色 C、氧化铜都被还原了 D、若要生成等质量的铜,则需要氧化铜的质量相等9. 某气体可能含有H2、CO2、CO、HCl中的一种或几种,把该气体依次通过澄清石灰水、饱和碳酸氢钠溶液、浓硫酸、灼热的氧化铜、无水硫酸铜、澄清石灰水,观察到的现象是:前面的一瓶澄清石灰水无明显变化,灼热的氧化铜变红色,无水硫酸铜变蓝(无水硫酸铜遇水变蓝),后面的一瓶澄清石灰水变浑浊,下列关于该气体说法错误的是( )
A、A B、B C、C D、D8. 碳、一氧化碳分别与氧化铜反应的实验中,下列有关说法不正确的是( )A、都发生了置换反应 B、黑色物质都变成了红色 C、氧化铜都被还原了 D、若要生成等质量的铜,则需要氧化铜的质量相等9. 某气体可能含有H2、CO2、CO、HCl中的一种或几种,把该气体依次通过澄清石灰水、饱和碳酸氢钠溶液、浓硫酸、灼热的氧化铜、无水硫酸铜、澄清石灰水,观察到的现象是:前面的一瓶澄清石灰水无明显变化,灼热的氧化铜变红色,无水硫酸铜变蓝(无水硫酸铜遇水变蓝),后面的一瓶澄清石灰水变浑浊,下列关于该气体说法错误的是( )
A、一定含有H2 B、一定含有CO C、可能含有HCl D、可能含有CO210. 下列说法不正确的是( )A、铁制品在湖湿的空气中比在干燥的空气中易生锈 B、葡萄糖(C6H12O6)中C,H,O元素的质量比为1:2:1 C、地壳中含量最多的金属元素是Al D、分子都是由原子构成的11. 正确的操作顺序是实验安全和成功的根本保证。下列有关叙述错误的是( )。A、稀释浓硫酸时,先向烧杯中加入浓硫酸,后注入水 B、制备气体时,先检查装置的气密性,后加入药品 C、一氧化碳还原氧化铁实验开始时,先通入一氧化碳,后加热 D、点燃可燃性气体时,先检验气体的纯度,后点燃12. 探究铁的冶炼原理实验装置和炼铁高炉的示意图如下,下列叙述正确的是( )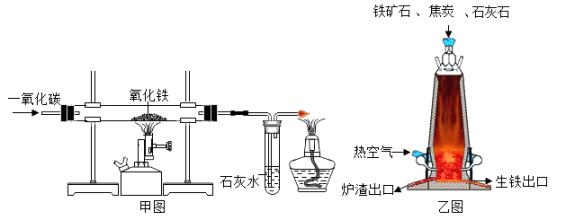 A、甲图中实验结束时,应先停止通一氧化碳再熄灭酒精喷灯 B、乙图中高炉炼铁的原料中焦炭的作用只是利用其燃烧提供热量 C、乙图中为了使焦炭燃烧生成一氧化碳,只需通入少量的热空气 D、完全反应后,甲、乙图中得到产物的区别是甲图得到的是纯净物,乙图得到的是混合物13. 通过下列实验可以得出的结论,其中不合理的是( )
A、甲图中实验结束时,应先停止通一氧化碳再熄灭酒精喷灯 B、乙图中高炉炼铁的原料中焦炭的作用只是利用其燃烧提供热量 C、乙图中为了使焦炭燃烧生成一氧化碳,只需通入少量的热空气 D、完全反应后,甲、乙图中得到产物的区别是甲图得到的是纯净物,乙图得到的是混合物13. 通过下列实验可以得出的结论,其中不合理的是( )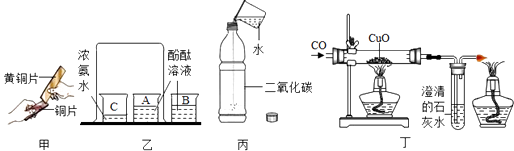 A、甲实验中黄铜片能在铜片上刻画出痕迹可以说明黄铜的硬度比铜片大 B、乙实验可以说明分子在不停的运动着 C、丙实验既可以说明二氧化碳易溶于水,又可以说明二氧化碳具有酸性 D、丁实验既可以说明一氧化碳具有还原性,又可以说明一氧化碳具有可燃性14. 下列图示关系正确的是( )
A、甲实验中黄铜片能在铜片上刻画出痕迹可以说明黄铜的硬度比铜片大 B、乙实验可以说明分子在不停的运动着 C、丙实验既可以说明二氧化碳易溶于水,又可以说明二氧化碳具有酸性 D、丁实验既可以说明一氧化碳具有还原性,又可以说明一氧化碳具有可燃性14. 下列图示关系正确的是( )
A、 加热氯酸钾制取氧气
B、
加热氯酸钾制取氧气
B、 木炭还原氧化铜
C、
木炭还原氧化铜
C、 加热高锰酸钾制取氧气
D、
加热高锰酸钾制取氧气
D、 一氧化碳还原氧化铜
一氧化碳还原氧化铜
二、填空题
-
15. 茶叶包装袋内有一小包铁粉,它可以吸收茶叶包装盒内的 , 以防止茶叶缓慢氧化而变质,同时还吸收 , 以防止茶叶发霉,这包铁粉最终将变成 . 我们可认为铁粉用作双吸剂.16. 地壳中的铁都是以化合物的形式存在的原因是它的化学性质 . 工业上把能提炼金属的矿物叫做 . 填表:
铁矿的名称
主要成分的化学式
磁铁矿
黄铁矿
菱铁矿
以上三种铁矿石,从环境保护的角度,矿石炼铁对环境有害.
三、实验探究题
-
17. 已知木炭粉和氧化铜反应的化学方程为:C+2CuO 2Cu+CO2↑
某同学设计一个实验,证明氧化铜中含有氧元素,并测定氧化铜中氧元素的质量分数,实验装置如图.
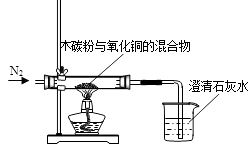 (1)、实验前要先进行的操作是 .(2)、实验中看到盛放澄清石灰水的烧杯中出现的现象是原因是 .(3)、实验中通入的气体是纯净干燥的N2 , 说出不用空气的理由:
(1)、实验前要先进行的操作是 .(2)、实验中看到盛放澄清石灰水的烧杯中出现的现象是原因是 .(3)、实验中通入的气体是纯净干燥的N2 , 说出不用空气的理由:① ;
②;
实验中也不能用潮湿的氮气的原因是: .
(4)、如用4克氧化铜与碳充分反应,测得石灰水增重1.1克,则氧化铜中氧元素的质量分数为 .18. 请根据图所示实验回答问题。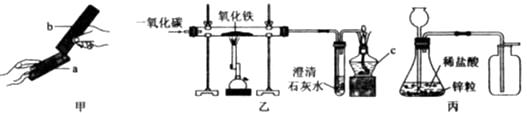 (1)、甲实验中金属片a、b分别是纯铜片和黄铜片的一种,相互刻画后,只有a上留下划痕,则金属片b是(选填“纯铜片”或“黄铜片”)。(2)、乙实验中仪器c的名称是 , 在通入一氧化碳前应先进行操作,以确保实验安全。(3)、丙是实验室制取氢气的装置,有关反应的化学方程式为。图中有一处错误,请指出。19. 某研究小组为探究影响铁制品锈蚀及快慢的因素,设计了如下两个实验,依据实验回答下列问题。(已知:氯化钙可作干燥剂;稀氨水呈碱性)
(1)、甲实验中金属片a、b分别是纯铜片和黄铜片的一种,相互刻画后,只有a上留下划痕,则金属片b是(选填“纯铜片”或“黄铜片”)。(2)、乙实验中仪器c的名称是 , 在通入一氧化碳前应先进行操作,以确保实验安全。(3)、丙是实验室制取氢气的装置,有关反应的化学方程式为。图中有一处错误,请指出。19. 某研究小组为探究影响铁制品锈蚀及快慢的因素,设计了如下两个实验,依据实验回答下列问题。(已知:氯化钙可作干燥剂;稀氨水呈碱性)实验一:探究铁制品生锈的条件
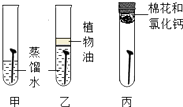
实验二:探究影响铁制品锈蚀快慢的因素(稀氨水和稀醋酸的质量分数相同)

实验序号
①
②
③
④
实验温度/℃
25
25
70
70
试剂
稀氨水
稀醋酸
稀氨水
稀醋酸
出现铁锈
所需时间
1天
未见锈蚀
5分钟
1天
未见锈蚀
1分钟
(1)、实验一的乙中植物油的作用是。(2)、由实验一探究铁制品生锈结果可知铁锈中含有的元素是。(3)、实验②和④可探究因素对铁制品锈蚀快慢的因素;欲探究试剂酸碱性对铁制品锈蚀快慢的影响,应选择的实验是(填实验序号)。(4)、由实验二表中实验现象得出的结论是 。四、综合题
-
20. 金属锰(Mn)及其化合物用途广泛。铁锰合金(锰钢)可用作大型体育场馆的网封架屋顶材料、铁轨、桥梁等。部分锰的化合物的颜色及溶解性见下表,回答下列问题。
物质 KMnO4 MnO2 MnSO4 Mn(OH)2 MnO(OH)2 颜色 暗紫色 黑色 白色 白色 棕色 溶解性 易溶 难溶 易溶 难溶 难溶 (1)、KMnO4读作 , 广泛用作医药杀菌剂和防臭剂。(2)、将适当比例的铁矿石(Fe2O3)、软锰矿(MnO2)、焦炭混合加入高炉,通入热空气熔炼,可得到铁锰合金。用化学方程式表示生成金属锰的过程:① ;②;③。
(3)、已知:①MnSO4+2NaOH=Mn(OH)2↓+Na2SO4;②2Mn(OH)2+O2=2MnO(OH)2若向盛有MnSO4溶液的试管中加入少量NaOH溶液,静置,预测可观察到的现象是。
五、计算题
-
21. 某炼铁厂日产含杂质5%的生铁3000t,试计算:(1)、该3000t生铁中含纯铁t(2)、该炼铁厂每天需含Fe2O3质量分数为85%的赤铁矿石多少吨?(计算结果保留整数)
-