2018-2019学年人教版化学九年级下册第八单元课题2 金属的化学性质 同步训练
试卷更新日期:2018-11-28 类型:同步测试
一、单选题
-
1. 化学兴趣小组的同学用镁条和稀盐酸进行实验,装置如图所示.下列有关现象和结论错误的是 ( )
 A、反应过程中产生大量的气泡,且试管外壁有热感 B、反应过程中气球彭胀,冷却至室温气球恢复原状 C、将气球中收集到的气体点燃,可能会听到爆鸣声 D、将药品换成生石灰和水,观察到气球膨胀。2. 推理是学习化学的一种方法,以下推理合理的是( )A、氧化物含有氧元素,所以含有氧元素的化合物都是氧化物 B、置换反应有单质生成,所以有单质生成的反应一定是置换反应 C、化学反应伴随能量变化,所以金属腐蚀过程中一定有能量变化 D、液态水电解产生氢气和氧气,所以水由氧气和氢气组成3. 某同学为验证铁、铜、银三种金属的活动性顺序,他设计了以下四种实验方案,其中能达到目的是( )A、将Fe、Cu分别加入AgNO3溶液中 B、将Fe、Cu、Ag分别加入稀盐酸中 C、将Fe分别加入CuSO4、AgNO3溶液中 D、将Fe、Ag分别加入CuSO4溶液中4. 下列盐可由金属和盐酸反应直接制得的是( )A、CuCl2 B、AlCl3 C、FeCl3 D、AgCl5. 2017年春季,在张献忠沉银现场,考古安家发现了金币、银币、铜币和银锭,还有铁刀、铁矛等兵器,金币银币光亮如初,铁刀铁矛锈迹斑斑。下列说法错误的是( )A、 金银铜铁都是重要的金属资源 B、金银的化学性质比铜铁更稳定 C、自然界中,金、银、铜、铁主要以単质的形式存在 D、可以用银、铁、硫酸铜溶液验证银、铁、铜三种金属的活动性顺序6. 现有甲、乙、丙三种金属,分别与空气和氧气反应,现象如下表所示:
A、反应过程中产生大量的气泡,且试管外壁有热感 B、反应过程中气球彭胀,冷却至室温气球恢复原状 C、将气球中收集到的气体点燃,可能会听到爆鸣声 D、将药品换成生石灰和水,观察到气球膨胀。2. 推理是学习化学的一种方法,以下推理合理的是( )A、氧化物含有氧元素,所以含有氧元素的化合物都是氧化物 B、置换反应有单质生成,所以有单质生成的反应一定是置换反应 C、化学反应伴随能量变化,所以金属腐蚀过程中一定有能量变化 D、液态水电解产生氢气和氧气,所以水由氧气和氢气组成3. 某同学为验证铁、铜、银三种金属的活动性顺序,他设计了以下四种实验方案,其中能达到目的是( )A、将Fe、Cu分别加入AgNO3溶液中 B、将Fe、Cu、Ag分别加入稀盐酸中 C、将Fe分别加入CuSO4、AgNO3溶液中 D、将Fe、Ag分别加入CuSO4溶液中4. 下列盐可由金属和盐酸反应直接制得的是( )A、CuCl2 B、AlCl3 C、FeCl3 D、AgCl5. 2017年春季,在张献忠沉银现场,考古安家发现了金币、银币、铜币和银锭,还有铁刀、铁矛等兵器,金币银币光亮如初,铁刀铁矛锈迹斑斑。下列说法错误的是( )A、 金银铜铁都是重要的金属资源 B、金银的化学性质比铜铁更稳定 C、自然界中,金、银、铜、铁主要以単质的形式存在 D、可以用银、铁、硫酸铜溶液验证银、铁、铜三种金属的活动性顺序6. 现有甲、乙、丙三种金属,分别与空气和氧气反应,现象如下表所示:甲
乙
丙
空气
剧烈燃烧
变黑
变黑
氧气
更剧烈燃烧
变黑
剧烈燃烧
据以上信息,这三种金属活动性由强到弱的顺序是( )
A、甲>丙>乙 B、甲>乙>丙 C、乙>丙>甲 D、丙>乙>甲7. 有一包金属粉末,可能由Mg、Zn、Fe、Al、Ag等金属中的一种或几种组成,取该样品2.4g,加入100g稀硫酸恰好完全反应,得0.2gH2和无色溶液。下列说法正确的是( )
A、样品中定只含有Mg B、样品中一定不含有Ag,可能含有Fe C、无色溶于中溶质总质量量为12g D、稀硫酸的溶质质量分数为19.6%8. 现有等质量甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中化合价均为+2价)。则下列说法中错误的是( )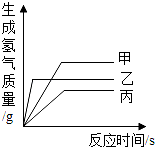 A、金属活动性:乙>甲>丙 B、生成氢气的质量:甲>乙>丙 C、相对原子质量:乙>丙>甲 D、消耗硫酸的质量:甲>乙>丙9. 分别把X、Y、Z三种金属加入稀盐酸中,只有Z表面无现象。Y加入X的硝酸盐溶液中,有X析出。则三种金属的活动性顺序是( )A、Y>X>Z B、X>Y>Z C、X>Z>Y D、Z>Y>X10. 向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入铁粉,反应过程中,测得混合物中溶液的质量与加入铁粉的质量关系如图所示。有关该反应过程中的下列说法正确的是( )
A、金属活动性:乙>甲>丙 B、生成氢气的质量:甲>乙>丙 C、相对原子质量:乙>丙>甲 D、消耗硫酸的质量:甲>乙>丙9. 分别把X、Y、Z三种金属加入稀盐酸中,只有Z表面无现象。Y加入X的硝酸盐溶液中,有X析出。则三种金属的活动性顺序是( )A、Y>X>Z B、X>Y>Z C、X>Z>Y D、Z>Y>X10. 向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入铁粉,反应过程中,测得混合物中溶液的质量与加入铁粉的质量关系如图所示。有关该反应过程中的下列说法正确的是( ) A、a点,向溶液中滴加稀盐酸,无白色沉淀 B、c点,向过滤后得到的固体中滴加稀盐酸,无气泡产生 C、d点,溶液中的溶质为Fe(NO3)2和Cu(NO3)2 D、e点,过滤后得到的固体中只含有2种物质11. 归纳法是学习化学的重要方法之一,下列图示正确的是为( )
A、a点,向溶液中滴加稀盐酸,无白色沉淀 B、c点,向过滤后得到的固体中滴加稀盐酸,无气泡产生 C、d点,溶液中的溶质为Fe(NO3)2和Cu(NO3)2 D、e点,过滤后得到的固体中只含有2种物质11. 归纳法是学习化学的重要方法之一,下列图示正确的是为( )
A.化学反应分类
B. 物质分类
C.地壳中元素含量型
D.金属的化学性质
A、A B、B C、C D、D12. 将一定量的锌粒投入到含溶质为Al(NO3)3、Cu(NO3)2、AgNO3的溶液中,充分反应后过滤,往滤液中滴加稀盐酸,无明显现象,则下列说法正确的是( )A、滤渣中一定有Ag、Cu B、滤渣中可能有Ag、Cu、Al C、滤液中一定没有Cu(NO3)2、AgNO3 D、滤液中一定没有AgNO313. 某兴趣小组进行实验探究,向盛有硝酸亚铁和硝酸银混合液的烧杯中加入一定量的锌粉,反应停止后过滤,向滤渣中加入稀盐酸,有气泡产生下列说法正确的是( )A、滤液中一定含有Zn2+和Fe2+ , 一定没有Ag+ B、滤液中一定含有Zn2+ , 一定没有Fe2+和Ag+ C、滤渣中一定含有银,可能含有锌和铁 D、滤渣中一定含有银和铁,可能含有锌二、填空题
-
14. 根据图示化合物与单质相互转化的关系回答:

若乙的溶液是浅绿色,Y是红色固体,则X是 .
15. 用铝丝、洁净的铜丝、稀盐酸、AgNO3溶液,验证Al、Cu Ag的活动性顺序。(1)、把打磨过的铝丝和洁净的铜丝分别浸入稀盐酸中,观察到铝丝表面有气泡产生,铜丝表面无明显现象,由此判断出Al和Cu的活动性强弱顺序为>(H)>;发生反应的基本反应类型是 ;铝丝使用前需用砂纸打磨的原因是;(2)、为了达到实验目的,除(1)中实验外,还需要进行的实验是。16. 向一定量的硝酸银和硝酸铜的混合溶液中加入锌粉,所得溶液的质量与加入锌粉质量关系如图,请回答下列问题。 (1)、a点时溶液中有哪些溶质?(2)、b~d段发生反应的化学方程式。(3)、充分反应后发现得到固体质量增加的原因是什么?17. 金属材料广泛应用于生产生活中。(1)、下列物质中属于合金的是 __________(填序号)。A、金刚石 B、不锈钢 C、生铁(2)、铁生锈的条件是铁与 同时接触。(3)、在空气中,铝表面生成一层致密的氧化膜,氧化膜的主要成分是 (填化学式) 。(4)、X、Y、Z 三种金属及其化合物间可发生如下化学反应:Y+ZCl2=Z+YCl2; X+ZCl2=Z+XCl2;Y+2HCl=YCl2+H2↑ ;X+HCl 不反应。则 X、Y、Z 三种金属的活动性由强到弱的顺序是 ________A、Z>Y>X B、X>Y>Z C、Y>X>Z D、Y>Z>X(5)、向硝酸铜和硝酸银的混合溶液中加入一定量的铁粉,充分反应后过滤,在滤渣中加入稀盐酸,没有气泡产生,则滤液中一定含有的阳离子是 。(6)、将一定质量的铁粉和氧化铜粉末投入到一定质量的稀硫酸中,充分反应后过滤,得到滤液 M 和滤渣 N,下列有关说法正确的是 _________(填序号)。
(1)、a点时溶液中有哪些溶质?(2)、b~d段发生反应的化学方程式。(3)、充分反应后发现得到固体质量增加的原因是什么?17. 金属材料广泛应用于生产生活中。(1)、下列物质中属于合金的是 __________(填序号)。A、金刚石 B、不锈钢 C、生铁(2)、铁生锈的条件是铁与 同时接触。(3)、在空气中,铝表面生成一层致密的氧化膜,氧化膜的主要成分是 (填化学式) 。(4)、X、Y、Z 三种金属及其化合物间可发生如下化学反应:Y+ZCl2=Z+YCl2; X+ZCl2=Z+XCl2;Y+2HCl=YCl2+H2↑ ;X+HCl 不反应。则 X、Y、Z 三种金属的活动性由强到弱的顺序是 ________A、Z>Y>X B、X>Y>Z C、Y>X>Z D、Y>Z>X(5)、向硝酸铜和硝酸银的混合溶液中加入一定量的铁粉,充分反应后过滤,在滤渣中加入稀盐酸,没有气泡产生,则滤液中一定含有的阳离子是 。(6)、将一定质量的铁粉和氧化铜粉末投入到一定质量的稀硫酸中,充分反应后过滤,得到滤液 M 和滤渣 N,下列有关说法正确的是 _________(填序号)。
A、向滤渣 N 中滴加稀硫酸,可能有气泡产生 B、滤液 M 中一定含有硫酸亚铁,可能含有硫酸和硫酸铜 C、当滤液 M 中含有硫酸铜时,滤渣 N 中一定没有氧化铜 D、在滤液 M 中放入一块刚打磨过的锌片,一定有置换反应发生三、实验探究题
-
18. 化学兴趣小组的同学一起探究金属的化学性质。
(1)、【进行实验】把打磨后的铁丝放入硫酸铜溶液中,铁丝表面有红色固体析出,得出结论:铁和铜的金属活动性顺序是。请写出铁丝放入硫酸铜溶液中的反应方程式。
(2)、【提出问题】小组同学验证本实验时出现了异常现象:有的试管中铁丝表面没有红色固体出现,反而出现了黑色固体。为了探究此现象,小组同学进行了以下实验:
实验序号
①
②
③
实验



观察时间(分钟)
3
3
3
生成固体颜色
黑色
红色
红色
【解释与结论】
a.通过上述实验能得出铁丝表面有黑色固体产生,与温度有关的实验序号是。
b.通过上述实验除了能得出铁丝表面有黑色固体产生与温度有关,还能得出与有关。
(3)、【反思与评价】硫酸铜溶液的溶质质量分数针对此异常现象,你还想探究的问题是。
四、推断题
-
19. A~I为初中化学常见的物质,它们之间的转化关系如图1所示(只略去反应①的部分产物).其中B是紫红色金属,D、F为黑色固体,H是实验室中最常见的无色无味液体.
请回答:
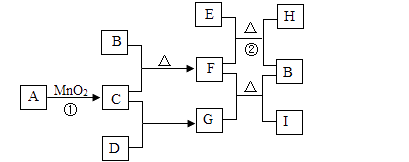 (1)、若A在常温下为液体,则A的化学式为 , 反应①的基本反应类型是 .(2)、在金属活动性顺序中,B位于铁的(填“前面”或“后面”)。(3)、G的化学式为 , 它不具有的性质有(填字母)。
(1)、若A在常温下为液体,则A的化学式为 , 反应①的基本反应类型是 .(2)、在金属活动性顺序中,B位于铁的(填“前面”或“后面”)。(3)、G的化学式为 , 它不具有的性质有(填字母)。A.酸性 B.还原性 C.毒性 D.助燃性
五、计算题
-
20. 我国约在南北朝时就开始冶炼黄铜,黄铜是铜和锌的合金(Cu-Zn),它可用来制造电器零件及日用品。小华利用一瓶稀盐酸和相关的仪器,测定黄铜样品的组成(不考虑黄铜中的其他杂质)。将30mL稀盐酸分三次加入到10g黄铜样品粉末中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
第一次
第二次
第三次
连续加入盐酸的体积/mL
10
10
10
生成氢气的质量/g
0.08
0.08
0.04
(1)、从上表数据分析,小华用10 g合金粉末总共收集到氢气g。(2)、求该合金中铜的质量分数。21. 为研究黄铜(铜锌合金)的组成,某学习小组称取该样品10g,向其中逐滴加稀硫酸至刚好不再产生气体为止.生成的气体与所用硫酸溶液的质量关系如图所示,请计算:10g样品中铜的质量是多少克?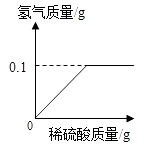
-
-