浙江省慈溪市六校2018-2019学年高一上学期化学期中考试试卷
试卷更新日期:2018-11-28 类型:期中考试
一、选择题
-
1. 下列物质属于碱性氧化物的是( )A、O3 B、ClO2 C、CaO D、NaOH2. 下列仪器名称为“蒸发皿”的是( )A、
 B、
B、 C、
C、 D、
D、 3. 下列过程涉及化学变化的是( )A、氢氧化铁胶体净水 B、四氯化碳加入溴水中萃取溴 C、氯化钠的焰色反应 D、钢铁生锈4. 下列分散系中,分散质粒子直径最小的是( )A、KCl溶液 B、Fe COH) 3胶体 C、牛奶 D、石灰乳5. 下列反应中,水作还原剂的是( )A、Mg+2H2O=Mg(OH)2+H2↑ B、2F2+2H2O=4HF+O2 C、Cl2+H2O=HCl+HClO D、2Na2O2+2H2O=4NaOH+O2↑6. 下列说法不正确的是( )A、AgI可用于人工降雨 B、碘酸钾可用作加碘食盐的添加剂 C、碳酸钠是发酵粉的主要成分 D、次氯酸钙是漂白粉的有效成分7. 下列化学用语正确的是( )A、中子数为20的氯原子: B、H2、D2和T2互为同位素 C、S2-的结构示意图:
3. 下列过程涉及化学变化的是( )A、氢氧化铁胶体净水 B、四氯化碳加入溴水中萃取溴 C、氯化钠的焰色反应 D、钢铁生锈4. 下列分散系中,分散质粒子直径最小的是( )A、KCl溶液 B、Fe COH) 3胶体 C、牛奶 D、石灰乳5. 下列反应中,水作还原剂的是( )A、Mg+2H2O=Mg(OH)2+H2↑ B、2F2+2H2O=4HF+O2 C、Cl2+H2O=HCl+HClO D、2Na2O2+2H2O=4NaOH+O2↑6. 下列说法不正确的是( )A、AgI可用于人工降雨 B、碘酸钾可用作加碘食盐的添加剂 C、碳酸钠是发酵粉的主要成分 D、次氯酸钙是漂白粉的有效成分7. 下列化学用语正确的是( )A、中子数为20的氯原子: B、H2、D2和T2互为同位素 C、S2-的结构示意图: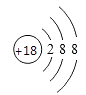 D、氯化钠的分子式:NaCl
8. 下列有关氯气的说法,不正确的是( )A、Cl2是一种黄绿色的有毒气体 B、红热的铁丝在Cl2中燃烧FeCl2 C、新制氯水应避光保存 D、工业上用Cl2和石灰乳制造漂白粉9. 《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结;累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是( )
D、氯化钠的分子式:NaCl
8. 下列有关氯气的说法,不正确的是( )A、Cl2是一种黄绿色的有毒气体 B、红热的铁丝在Cl2中燃烧FeCl2 C、新制氯水应避光保存 D、工业上用Cl2和石灰乳制造漂白粉9. 《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结;累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是( )
A、蒸馏 B、升华 C、干馏 D、萃取10. 下列物质的水溶液不能使红色石蕊试纸变蓝的是( )
A、NH3 B、Na2O C、NaHSO4 D、NaOH11. 下列有关钠和镁的说法中,不正确的是( )A、电解饱和食盐水可以得到氯气 B、金属钠在高温下能将TiCl4中的钛置换出来 C、金属镁燃烧后会发出耀眼的白光,因此常用来制造信号弹和焰火 D、金属镁着火,可用二氧化碳灭火12. 下列说法正确的是( )A、用pH试纸检验某干燥气体的酸碱性时,要先用蒸馏水将试纸润湿 B、容量瓶用蒸馏水洗涤后必须烘干才能进行溶液的配制 C、蒸馏操作时,应使温度计水银球插入到溶液的液面下 D、分液漏斗放液时,先从下口放出下层液体,再从下口继续放出上层液体13. 下列鉴别或除杂方法合理的是( )A、用澄清石灰水可以鉴别碳酸钠和碳酸氢钠溶液 B、Ba(OH)2可以鉴别NH4Cl、(NH4)2SO4、Na2SO4溶液 C、通过饱和碳酸氢钠溶液可以除去Cl2中的HCl D、用淀粉碘化钾试纸鉴别碘水和溴水14. 下列各组中的离子,能在溶液中大量共存的是( )A、K+、HCO3﹣、SO42﹣、OH﹣ B、Na+、Cu2+、Cl﹣、SO42﹣ C、Na+、H+、CO32﹣、Cl﹣ D、Na+、Mg2+、OH﹣、NO3﹣15. 下列离子方程式书写正确的是( )
A、Na与H2O反应:Na + H2O = Na++ OH﹣+ H2↑ B、食醋除去水垢中的 CaCO3:2H+ + CaCO3 = Ca2+ + H2O + CO2↑ C、向NaHSO4溶液中滴加Ba(OH)2溶液至中性:2H++SO42-+Ba2++2OH﹣=2H2O+BaSO4↓ D、氢氧化钠吸收少量二氧化碳: OH﹣+CO2 =HCO3﹣16. 已知X2、Y2、Z2、W2四种物质的氧化性强弱为W2>Z2>X2>Y2 , 下列氧化还原反应能发生的是( )A、2NaW+Z2=2NaZ+W2 B、2NaX+Y2=2NaY+X2 C、2NaY+W2=2NaW+Y2 D、2NaZ+X2=2NaX+Z217. 对下列实验过程的评价,正确的是( )A、某溶液中滴加BaCl2溶液,生成不溶于稀HNO3的白色沉淀,证明一定含有SO42﹣ B、某溶液中加入NaOH溶液,加热产生使湿润的红色石蕊试纸变蓝的气体,证明该溶液含有NH4+ C、某溶液中加入AgNO3溶液,有白色沉淀生成,证明一定含有Cl﹣存在 D、某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐18. 下列叙述正确的是( )A、同温同压下,相同体积的物质,其物质的量一定相等 B、任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等 C、1L一氧化碳气体一定比1L氧气的质量小 D、相同条件下的二氧化碳气体和氮气,若体积相等,则质量也相等19. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下,22.4 mLCCl4中含有的分子数目为NA B、1mol HCl气体中的粒子数与0.5 mol/L盐酸中溶质粒子数相等 C、23 g钠在氧气中完全燃烧失去电子数为NA D、标准状况下,22.4L氯气与56 g铁充分反应,转移电子数为3NA20. 往NaBr、NaI混合溶液中通入一定量的氯气,再将溶液蒸干、灼烧,剩余的固体不可能的是( )A、NaCl B、NaCl、NaBr C、NaCl、NaI D、NaCl、NaBr、NaI21. 把VL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含有a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡,则原混合溶液中钾离子的物质的量浓度为( )A、(b-a)/V mol/L B、2(2b-a)/V mol/L C、2(b-a)/V mol/L D、(2b-a)/V mol/L22. 氯气与碱反应时,产物受温度的影响。温度较高时反应如下:3Cl2+6KOH=KClO3+5KCl+3H2O,对于此反应下列说法正确的是( )
A、Cl2是氧化剂,KOH是还原剂 B、氧化剂与还原剂的物质的量之比为1:5 C、反应中每消耗3mol Cl2 , 转移电子数为5mol D、被还原的Cl2物质的量与被氧化的Cl2的物质的量的相等23. 向含1mol HCl和1mol MgSO4的混合溶液中加入1mol/L Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图是( )A、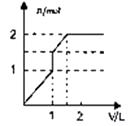 B、
B、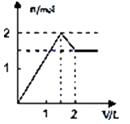 C、
C、 D、
D、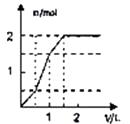 24. 某兴趣小组进行碘的提取实验:首先将海带灼烧成灰,用水浸取得到含碘离子的水溶液,再用硫酸酸化、加氯水氧化得到少量碘水,最后以CCl4为溶剂将碘单质从中提取出来,下列说法正确的是( )A、灼烧的目的是为了使海带灰化,除去有机物,以便于碘离子的浸出 B、灼烧时用到的仪器是烧杯、酒精灯、玻璃棒 C、海带灰浸取液中的碘离子可用淀粉溶液检验 D、CCl4溶剂还可用苯、酒精代替25. 取某固体样品,进行如下实验
24. 某兴趣小组进行碘的提取实验:首先将海带灼烧成灰,用水浸取得到含碘离子的水溶液,再用硫酸酸化、加氯水氧化得到少量碘水,最后以CCl4为溶剂将碘单质从中提取出来,下列说法正确的是( )A、灼烧的目的是为了使海带灰化,除去有机物,以便于碘离子的浸出 B、灼烧时用到的仪器是烧杯、酒精灯、玻璃棒 C、海带灰浸取液中的碘离子可用淀粉溶液检验 D、CCl4溶剂还可用苯、酒精代替25. 取某固体样品,进行如下实验①取一定量的样品,加足量水充分溶解,过滤得到滤液和滤渣;
②取少量滤液,加入BaCl2溶液,有白色沉淀产生;
③取少量滤渣,加入稀盐酸,滤渣全部溶解,同时有气体产生。
根据上述实验现象,该固体样品的成分可能是( )
A、K2SO4、Ba(OH)2、Na2CO3 B、Na2CO3、AgNO3、KNO3 C、K2CO3、NaCl、Ba(NO3)2 D、KNO3、MgCl2、NaOH二、非选择题
-
26. 按要求完成下列填空
(1)、写出“海洋元素”的元素符号 , 该单质的苯溶液颜色为(2)、写出NaHCO3溶于水的电离方程式:(3)、用离子方程式表示用NaOH溶液处理尾气Cl2:(4)、有以下八种物质:①盐酸 ②酒精 ③液氯 ④硫酸铵晶体 ⑤水银 ⑥硫酸 ⑦澄清石灰水 ⑧二氧化硫,其中属于酸性氧化物的是(填序号,下同),属于盐的是 , 能导电的是 , 属于电解质的是27. 实验室需要配制0.20mol/L的硫酸溶液450mL。请回答:(1)、在配制过程中不必要的玻璃仪器是A.烧杯 B.托盘天平C.玻璃棒 D.量筒
还缺少的实验仪器是
(2)、定容时的操作:当液面接近容量瓶刻度线1-2cm处时, ,再将容量瓶塞盖好,反复上下颠倒,摇匀。
(3)、下列操作会使配得的硫酸溶液浓度偏高的是A、摇匀后发现液面低于容量瓶刻度线,再滴加蒸馏水至刻度线 B、溶液未冷却到室温立即转移到容量瓶 C、定容时仰视容量瓶的刻度线 D、转移洗涤液时洒到容量瓶外,继续用该未清洗的容量瓶重新配制(4)、根据计算得知,需用量筒量取物质的量浓度为12.5 mol/L的浓硫酸的体积为mL28. 为探究某橙色含结晶水的盐 X的组成和性质,设计并完成如下实验。请回答: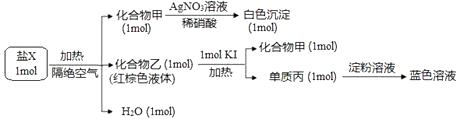 (1)、X的化学式是(2)、乙与 KI反应的化学方程式为:(3)、乙化学性质与其组成元素的单质相似,下列物质中能与乙发生反应的是A、Mg B、CaCl2 C、NaOH D、K2SO429. 工业上,可用向500℃左右的铜屑中通入Cl2的方法生产无水氯化铜,其制备过程中均要求在干燥的条件下完成。现用下图装置模拟该过程进行实验。请回答:
(1)、X的化学式是(2)、乙与 KI反应的化学方程式为:(3)、乙化学性质与其组成元素的单质相似,下列物质中能与乙发生反应的是A、Mg B、CaCl2 C、NaOH D、K2SO429. 工业上,可用向500℃左右的铜屑中通入Cl2的方法生产无水氯化铜,其制备过程中均要求在干燥的条件下完成。现用下图装置模拟该过程进行实验。请回答: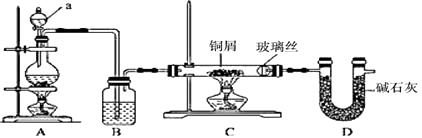 (1)、仪器a的名称为 , 装置A的圆底烧瓶中发生反应的化学方程式为 , 装置C可观察到的现象是(2)、根据实验要求,装置B可选用下列试剂中的A、饱和食盐水 B、NaOH溶液 C、浓硫酸 D、饱和NaHCO3溶液(3)、实验步骤:如图连接装置后,先(填实验操作),再装药品,然后点燃(填“A”或“C”)处酒精灯,当(填实验现象)时,再点燃(填“A”或“C”)处酒精灯.(4)、装置D的作用是30.(1)、(I)将一定质量Na2CO3和NaHCO3的均匀混合物分成等量的两份。将其中的一份直接加热至恒重,质量减轻了1.24g;另一份加入一定量某浓度的盐酸至恰好反应完全,收集到标准状况下2.24L气体,消耗盐酸80.0mL。
(1)、仪器a的名称为 , 装置A的圆底烧瓶中发生反应的化学方程式为 , 装置C可观察到的现象是(2)、根据实验要求,装置B可选用下列试剂中的A、饱和食盐水 B、NaOH溶液 C、浓硫酸 D、饱和NaHCO3溶液(3)、实验步骤:如图连接装置后,先(填实验操作),再装药品,然后点燃(填“A”或“C”)处酒精灯,当(填实验现象)时,再点燃(填“A”或“C”)处酒精灯.(4)、装置D的作用是30.(1)、(I)将一定质量Na2CO3和NaHCO3的均匀混合物分成等量的两份。将其中的一份直接加热至恒重,质量减轻了1.24g;另一份加入一定量某浓度的盐酸至恰好反应完全,收集到标准状况下2.24L气体,消耗盐酸80.0mL。原均匀混合物中NaHCO3的物质的量:n(NaHCO3)=
(2)、盐酸的浓度c(HCl)=(3)、(II)将2.80g含氧化镁的镁条完全溶于50.0mL硫酸溶液后,滴加2.00mol/L氢氧化钠液,恰好完全沉淀时用去200.0mL。将所得沉淀灼烧、冷却后称量得固体质量为4.40g。上述硫酸的物质的量浓度c(H2SO4)=
(4)、镁条中氧化镁和镁的物质的量之比为n(MgO)︰n(Mg)=