湖南省湘西州2019年化学高考模拟试卷
试卷更新日期:2018-11-24 类型:高考模拟
一、单选题
-
1. 如图,B为常见金属或非金属单质,有下列转化关系如下,若C是气体且水溶液能消毒杀菌,D、E都是二元化合物(由两种元素组成),D转化为E时,增加的氧的质量约是D物质总质量的25.8%,则A是 ( )
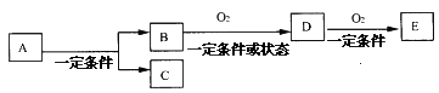 A、AlCl3 B、H2O2 C、NaCl D、KCl2. 分子式为C3H4Cl2的同分异构体共有 ( )A、3种 B、4种 C、5种 D、6种3. 下列有关H2O的说法中,错误的是( )A、水在化学反应中能做氧化剂 B、水既能与碱性氧化物反应,又能与酸性氧化物反应 C、水在化学反应中能做还原剂 D、过氧化钠与水反应时,每生成1molO2转移电子总数为2.408×10244. 铁、铜混合粉末17.6 g加入到800mL 1.0mol/L的 FeCl3溶液中,充分反应后,所得溶液中Fe2+和Cu2+物质的量浓度之比为8∶1。下列有关说法正确的是( )
A、AlCl3 B、H2O2 C、NaCl D、KCl2. 分子式为C3H4Cl2的同分异构体共有 ( )A、3种 B、4种 C、5种 D、6种3. 下列有关H2O的说法中,错误的是( )A、水在化学反应中能做氧化剂 B、水既能与碱性氧化物反应,又能与酸性氧化物反应 C、水在化学反应中能做还原剂 D、过氧化钠与水反应时,每生成1molO2转移电子总数为2.408×10244. 铁、铜混合粉末17.6 g加入到800mL 1.0mol/L的 FeCl3溶液中,充分反应后,所得溶液中Fe2+和Cu2+物质的量浓度之比为8∶1。下列有关说法正确的是( )
A、混合粉末中铁与铜的物质的量之比是1∶2 B、反应后的溶液最多还可以溶解铁粉5.6g C、反应后所得溶液中c(Fe2+)=1.0mol/L (假设反应前后溶液体积无变化) D、向反应后的溶液中加入2.0 mol/L NaOH溶液至金属离子恰好全部沉淀时,需加入NaOH溶液的体积是1.6 L5. 某溶液X中可能含有下列离子中的若干种:Cl-、SO42-、SO32-、HCO3-、Na+、Mg2+、Fe3+ , 为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如下实验,下列说法不正确的是( )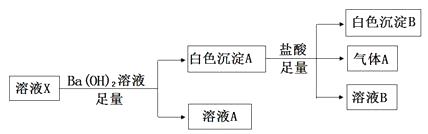 A、气体A可能是CO2或SO2 B、溶液X中一定存在SO42- C、溶液X中一定不存在Fe3+和Mg2+ , 可能存在Na+ D、向溶液A加入硝酸酸化的硝酸银溶液可能生成白色沉淀6. 1 mol某链烃最多能和2 mol氯化氢发生加成反应,生成氯代烷1 mol,该氯代烷能和6 mol氯气发生取代反应,生成只含碳元素和氯元素的氯代烃,该烃可能是( )
A、气体A可能是CO2或SO2 B、溶液X中一定存在SO42- C、溶液X中一定不存在Fe3+和Mg2+ , 可能存在Na+ D、向溶液A加入硝酸酸化的硝酸银溶液可能生成白色沉淀6. 1 mol某链烃最多能和2 mol氯化氢发生加成反应,生成氯代烷1 mol,该氯代烷能和6 mol氯气发生取代反应,生成只含碳元素和氯元素的氯代烃,该烃可能是( )
A、丙烯 B、丙炔 C、1-丁炔 D、1,3-丁二烯7. 下列关于有机化合物的认识正确的是( )A、淀粉、蛋白质、油脂都属于天然高分子化合物 B、C4H10有3种同分异构体 C、乙烯使溴的四氯化碳溶液褪色是因为发生了取代反应 D、新制氢氧化铜可以鉴别乙酸、葡萄糖、乙醛和乙醇8. 可逆反应X(g)+2Y(g) 2Z(g) △H= -a kJ·mol-1 , 在一定条件下达到化学平衡时,下列说法正确的是( )A、反应放出的热量小于a kJ B、c(X)∶c(Y)∶c(Z)=1∶2∶2 C、X的消耗速率与Z的消耗速率相等 D、气体的密度不再发生变化9. 下列高聚物经简单处理可以从线型结构变成体型结构的是( )①

②

③

④
 A、①② B、③④ C、①④ D、②③10. 下列有关物质用途的说法错误的是( )A、氧化铝是一种耐火材料,可制耐高温实验材料 B、氧化铁可用作红色油漆和涂料 C、二氧化硫可以用来加工食品,使食品增白 D、氨气常用作制冷剂11. 某无色溶液中可能含有Na+、K+、NH4+、Ca2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1 mol·L-1。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如右实验:
A、①② B、③④ C、①④ D、②③10. 下列有关物质用途的说法错误的是( )A、氧化铝是一种耐火材料,可制耐高温实验材料 B、氧化铁可用作红色油漆和涂料 C、二氧化硫可以用来加工食品,使食品增白 D、氨气常用作制冷剂11. 某无色溶液中可能含有Na+、K+、NH4+、Ca2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1 mol·L-1。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如右实验:则下列关于原溶液的判断正确的是( )
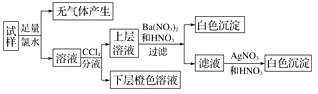 A、若步骤中Ba(NO3)2和HNO3的混合溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响 B、无法确定原溶液中是否存在Cl- C、肯定存在的离子是SO32-、Br- , 是否存在Na+、K+需要通过焰色反应来确定 D、肯定不存在的离子是Ca2+、Cu2+、SO42-、CO32- , 是否含NH4+另需实验验证12. 下列属于酸性氧化物的是( )A、Al2O3 B、SiO2 C、CO D、KClO313. 下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
A、若步骤中Ba(NO3)2和HNO3的混合溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响 B、无法确定原溶液中是否存在Cl- C、肯定存在的离子是SO32-、Br- , 是否存在Na+、K+需要通过焰色反应来确定 D、肯定不存在的离子是Ca2+、Cu2+、SO42-、CO32- , 是否含NH4+另需实验验证12. 下列属于酸性氧化物的是( )A、Al2O3 B、SiO2 C、CO D、KClO313. 下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
下列说法不正确的是( )
A、通过计算,可知系统(Ⅰ)制备氢气的热化学方程式为:H2O(l)= H2(g)+1/2O2(g) ΔH = 286 kJ· mol-1 B、通过计算,可知系统(Ⅱ)制备氢气的热化学方程式为:H2S(g)=H2(g)+S(s) ΔH =20kJ·mol-1 C、若反应H2(g)+1/2O2(g)=H2O(g) ΔH = -a kJ · mol-1 , 则a>286 D、制得等量H2所需能量较少的是热化学硫碘循环硫化氢分解法14. 下列实验操作错误的是A、用药匙取用少量Na2SO4固体 B、用胶头滴管滴加少量NaCl溶液 C、用酒精灯直接加热试管、蒸发皿 D、用10mL量筒量取8.50mL1.0 mol·L-1NaOH溶液15. 下列有水参加的反应中,属于氧化还原反应但水既不是氧化剂也不是还原剂的是( )A、2Na2O2+2H2O=4NaOH+O2↑ B、Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑ C、Na2O+H2O=2NaOH D、2H2O 2H2↑+O2↑16. 一种熔融碳酸盐燃料电池原理示意如图。下列说法不正确的是( ) A、反应CH4+H2O 3H2+CO,每消耗1molCH4转移6mole- B、电池工作时,CO32-向电极A移动 C、电极A上H2参与的电极反应为:H2-2e-=2H+ D、电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
A、反应CH4+H2O 3H2+CO,每消耗1molCH4转移6mole- B、电池工作时,CO32-向电极A移动 C、电极A上H2参与的电极反应为:H2-2e-=2H+ D、电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-二、综合题
-
17. 以不饱和烃A(相对分子质量为42)、D(核磁共振氢谱只有一个峰)及醇G为基本原料合成聚酯增塑剂F及医药中间体I的路线图如图(部分反应条件略去):

已知:
 (1)、B的名称是 , D的分子式为 , A分子中共平面的原子最多有个.(2)、②的反应类型是 , F的结构简式为 , 1中官能团的名称 .(3)、写出反应①的化学方程式: .(4)、E有多种同分异构体,符合下列条件的同分异构体最多有种,
(1)、B的名称是 , D的分子式为 , A分子中共平面的原子最多有个.(2)、②的反应类型是 , F的结构简式为 , 1中官能团的名称 .(3)、写出反应①的化学方程式: .(4)、E有多种同分异构体,符合下列条件的同分异构体最多有种,写出核磁共振氢谱峰面积比为1:1:1:1:6的物质的结构简式: .
①能与NaHCO3反应并放出CO2 , ②能发生水解反应、银镜反应.
(5)、参照上述合成路线,以苯甲酸、乙醇、乙酸为原料通过3步转化可合成 写出合成路线图. 18. 在① CH4 ② C2H2 ③ C2H4 ④ C2H6 ⑤ 苯 ⑥ 甲苯 中:(1)、能使酸性高锰酸钾溶液褪色的是 , 因发生化学反应使溴水褪色的是。(2)、相同物质的量,在氧气中充分燃烧:消耗氧气最多的是。(3)、相同质量,在氧气中充分燃烧:消耗氧气最多的是 , 耗氧量、生成二氧化碳和水都相等的是。19. 氮的固定是几百年来科学家一直研究的课题.(1)、下表列举了不同温度下大气固氮和工业固氮的部分K值.
写出合成路线图. 18. 在① CH4 ② C2H2 ③ C2H4 ④ C2H6 ⑤ 苯 ⑥ 甲苯 中:(1)、能使酸性高锰酸钾溶液褪色的是 , 因发生化学反应使溴水褪色的是。(2)、相同物质的量,在氧气中充分燃烧:消耗氧气最多的是。(3)、相同质量,在氧气中充分燃烧:消耗氧气最多的是 , 耗氧量、生成二氧化碳和水都相等的是。19. 氮的固定是几百年来科学家一直研究的课题.(1)、下表列举了不同温度下大气固氮和工业固氮的部分K值.反应
大气固氮
N2(g)+O2(g)⇌2NO(g)
工业固氮
N2(g)+3H2(g)⇌2NH3(g)
温度/℃
27
2000
25
400
450
K
3.84×10﹣31
0.1
5×108
0.507
0.152
①分析数据可知:大气固氮反应属于(填“吸热”或“放热”)反应
②分析数据可知:人类不适合大规模模拟大气固氮原因
③从平衡角度考虑.工业固氮应该选择常温条件,但实际工业产生却选择500℃左右的高温,解释其原因
(2)、工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是(填“A”或“B”);比较р1、р2的大小关系 . (3)、近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)⇌4NH3(g)+3O2(g),则其反应热△H= .
(3)、近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)⇌4NH3(g)+3O2(g),则其反应热△H= .已知:N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ•mol﹣1
2H2(g)+O2(g)⇌2H2O(l)△H=﹣571.6kJ•mol﹣1 .
20. 现有反应:CO(g)+H2O(g) CO2(g)+H2(g)ΔH<0 在850℃时,K=1。
(1)、若升高温度到950℃时,达到平衡时K1(填“大于”“小于”或“等于”)。(2)、850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2 , 则:①当x=5.0时,上述平衡向(填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是。
(3)、在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则ab(填“大于”“小于”或“等于”)。21. As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如图1流程转化为粗产品。 (1)、“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是。(2)、“氧化”时,1mol AsO33-转化为AsO43-至少需要O2 mol。(3)、“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
(1)、“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是。(2)、“氧化”时,1mol AsO33-转化为AsO43-至少需要O2 mol。(3)、“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:a.Ca(OH)2(s) Ca2+(aq)+2OH-(aq) △H<0
b.5Ca2++OH-+3AsO43- Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳温度是85℃。 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是。
(4)、“还原”过程中H3AsO4转化为H3AsO3 , 反应的化学方程式是。(5)、“还原”后加热溶液,H3AsO3分解为As2O3 , 同时结晶得到粗As2O3。As2O3 在不同温度和不同浓度硫酸中的溶解度(S)曲线如图2所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是。 (6)、下列说法中,正确的是 (填字母)。
(6)、下列说法中,正确的是 (填字母)。a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
22. 为测定某有机物A的结构,进行如下实验。(1)、[分子式的确定]将7.4 g某有机物A置于氧气流中充分燃烧,实验测得:生成9.0 g H2O和17.6 g CO2。
则该物质的最简式是 , 据此 (填“能”或“不能”)确定该有机物的分子式。若前一空选填“能”,请在后面横线上写出其分子式;若前一空选填 “不能”,请在后面横线上写出理由:。
(2)、[结构式的确定]核磁共振氢谱显示该有机物A分子内有2种不同环境的氢原子,且A能与金属钠反应放出无色无味的气体,则A的结构简式为。
(3)、[性质实验]A在浓硫酸作用下加热至一定温度可生成不饱和烃B,请写出B发生加聚反应的反应方程式: 。
23. A.《化学与生活》(1)、材料是人类赖以生存和发展的重要物质基础。①水泥是最常用的建筑材料,它属于(填字母)。
a. 金属材料 b. 无机非金属材料 c. 有机高分子材料
②下列硅酸盐产品的生产原料中不需要石灰石的是(填字母)。
a. 陶瓷 b. 水泥 c. 玻璃
③高岭土是烧制瓷器的重要原料,其组成可以表示为Al2Si2Ox(OH)y , 其中x , y的数值分别是(填字母)。
a. 5、4 b. 6、3 c. 7、2
④下列物品的构成材料中主要是合成高分子材料的是(填字母)。
a. 宣纸 b. 羊毛衫 c. 保鲜膜
⑤橡胶是制造轮胎的主要原料,天然橡胶是结构(填“线型”或“体型”),需经过硫化处理改变其结构,增强其机械强度。
(2)、某品牌果冻标签如图所示。回答下列问题:
①食品添加剂中,属于无机盐的是(填化学式)。
②属于着色剂的是诱惑红和;属于防腐剂的是。
③配料表中白砂糖的成分是蔗糖,请写出蔗糖在人体内水解的化学方程式。
(3)、化学与科学技术、生产生活及环境保护等密切相关。①2016年12月我省启动了保卫碧水蓝天的“263”行动,减少煤炭消费总量,减少雾霾天气的发生。形成硫酸型酸雨的主要气体是;严格整治畜禽养殖场污染 , 主要是为减少和P等元素及化学需氧量对水体的污染。
②目前正在推广用尿素水解液来消除柴油汽车尾气中的氮氧化物。写出尿素水解液中的NH3与NO在催化剂作用下,反应生成无污染物质的化学方程式。
③阿司匹林作为一种药物,主要具有作用;Mg2Si3O8·nH2O(三硅酸镁)具有治疗胃酸过多的作用,写出其与胃酸反应生成SiO2 ·H2O等物质的化学方程式。