湖南省湘西州2019年高考化学模拟试卷
试卷更新日期:2018-11-22 类型:高考模拟
一、单选题
-
1. 下列关于KHSO4的说法中正确的是( )A、在水溶液中KHSO4电离出K+和H+和SO42-离子 B、因为KHSO4在水溶液中能电离出H+ , 从电离角度分类,KHSO4应属于酸类 C、因为KHSO4的晶体中有K+和HSO4-离子,KHSO4晶体能够导电 D、KHSO4和NaHCO3属于同类物质,二者不可能发生反应2. 如图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒的量的关系曲线,下列判断错误的是( )
 A、①线表示Al3+的物质的量的变化 B、x表示AlCl3的物质的量 C、②③线均表示Al(OH)3的物质的量的变化 D、④线表示[Al(OH)4]-的物质的量的变化3. 下列有关H2O的说法中,错误的是( )A、水在化学反应中能做氧化剂 B、水既能与碱性氧化物反应,又能与酸性氧化物反应 C、水在化学反应中能做还原剂 D、过氧化钠与水反应时,每生成1molO2转移电子总数为2.408×10244. 物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当它们的体积比为3:2:1时,三种溶液Cl-的浓度比应是( )A、1:2:3 B、1:1:1 C、3:2:1 D、3:4:35. 将1.52g铜镁合金完全溶解于50mL某浓度的硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),当向反应后的溶液中加入640mL 1.0mol/LNaOH溶液时,金属离子全部转化为沉淀,测得沉淀的质量为2.54g。下列说法正确的是( )A、该合金中铜与镁的物质的量之比是1:2 B、该硝酸中HNO3的物质的量浓度是14.0mol/L C、NO2和N2O4的混合气体中,NO2的体积分数是20% D、该硝酸中HNO3的质量分数为60%6. 25℃时,向20mL0.1mol/LHAuCl4溶液中滴加0.1mol/LNaOH溶液,滴定曲线如图1,含氯微粒的物质的量分数(δ)随pH变化关系如图2,则下列说法错误的是( )
A、①线表示Al3+的物质的量的变化 B、x表示AlCl3的物质的量 C、②③线均表示Al(OH)3的物质的量的变化 D、④线表示[Al(OH)4]-的物质的量的变化3. 下列有关H2O的说法中,错误的是( )A、水在化学反应中能做氧化剂 B、水既能与碱性氧化物反应,又能与酸性氧化物反应 C、水在化学反应中能做还原剂 D、过氧化钠与水反应时,每生成1molO2转移电子总数为2.408×10244. 物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当它们的体积比为3:2:1时,三种溶液Cl-的浓度比应是( )A、1:2:3 B、1:1:1 C、3:2:1 D、3:4:35. 将1.52g铜镁合金完全溶解于50mL某浓度的硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),当向反应后的溶液中加入640mL 1.0mol/LNaOH溶液时,金属离子全部转化为沉淀,测得沉淀的质量为2.54g。下列说法正确的是( )A、该合金中铜与镁的物质的量之比是1:2 B、该硝酸中HNO3的物质的量浓度是14.0mol/L C、NO2和N2O4的混合气体中,NO2的体积分数是20% D、该硝酸中HNO3的质量分数为60%6. 25℃时,向20mL0.1mol/LHAuCl4溶液中滴加0.1mol/LNaOH溶液,滴定曲线如图1,含氯微粒的物质的量分数(δ)随pH变化关系如图2,则下列说法错误的是( )
 A、在c点溶液中:c(Na+)=c(AuCl4-) B、a点对应溶液pH约为5 C、25℃时,HAuCl4的电离常数为1×10-3 D、d点时,溶液中离子浓度大小关系为:c(Na+)>c(AuCl4-)>c(OH-)>c(H+)7. 下列说法正确的是( )A、干冰和石英晶体中的化学键类型相同,熔化时需克服微粒间的作用力类型也相同 B、某物质在熔融态能导电,则该物质中一定含有离子键 C、N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构 D、NaHSO4晶体溶于水时,只有离子键被破坏8. 下列各组物质的无色溶液,不用其他试剂即可鉴别的是( )
A、在c点溶液中:c(Na+)=c(AuCl4-) B、a点对应溶液pH约为5 C、25℃时,HAuCl4的电离常数为1×10-3 D、d点时,溶液中离子浓度大小关系为:c(Na+)>c(AuCl4-)>c(OH-)>c(H+)7. 下列说法正确的是( )A、干冰和石英晶体中的化学键类型相同,熔化时需克服微粒间的作用力类型也相同 B、某物质在熔融态能导电,则该物质中一定含有离子键 C、N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构 D、NaHSO4晶体溶于水时,只有离子键被破坏8. 下列各组物质的无色溶液,不用其他试剂即可鉴别的是( )
①KOHNa2SO4AlCl3②Na2CO3Ba(OH)2H2SO4③HClNa[Al(OH)4]NaHSO4④Ca(OH)2Na2CO3BaCl2A、①② B、②③ C、①③④ D、①②④9. 已知反应:FeO·Cr2O3+Na2CO3+NaNO3 Na2CrO4+Fe2O3+CO2+NaNO2 (未配平)。下列说法正确的是( )A、Na2CrO4是还原产物 B、该反应中有3种元素的化合价发生变化 C、NaNO3是还原剂 D、1 mol FeO·Cr2O3参与反应将得到7 mol电子10. 在密闭容器发生下列反应:aA(g) cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )A、平衡向正反应方向移动 B、a<c+d C、D的体积分数增大 D、A的转化率变大11. 下列说法正确的是( )A、 、 为不同的核素,化学性质也不同 B、乙醇和乙醚互为同分异构体 C、CH3CH(CH3)2的名称叫2-甲基丙烷,也可以叫做异丁烷 D、CH2=CH2和CH2=CH-CH=CH2具有相同的官能团,互为同系物12. 下列说法正确的是( )A、乙烯和苯都可以使酸性KMnO4溶液褪色 B、等物质的量乙烯和乙醇充分燃烧所消耗的O2的质量相同 C、乙醛和乙酸都可以与新制的氢氧化铜悬浊液反应且实验现象相同 D、石油裂化是为了得到更多的乙烯等气态短链烃13. 某溶液中存在大量的OH-、K+、CO32- , 该溶液中还可能大量存在的是( )A、NH4+ B、Ca2+ C、HCO3- D、SO42-14. 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。下列操作中可能使所测NaOH溶液的浓度数值偏低的是( )A、酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 B、滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 C、酸式滴定管在滴定前有气泡,滴定后气泡消失 D、读取盐酸体积时,开始仰视读数,滴定结束时俯视读数15. 用等体积的0.2mol/L的BaCl2 溶液,可使相同体积的Na2SO4、KAl(SO4)2、Fe2(SO4)3三种溶液中的SO42ˉ完全沉淀,则三种硫酸盐的物质的量浓度之比为( )A、6∶3∶1 B、6∶3∶2 C、9∶3∶1 D、12∶3∶216. 下列方法用于快速、微量、精确测定有机物相对分子质量的是( )A、元素分析 B、红外光谱 C、质谱 D、核磁共振氢谱二、综合题
-
17. 某研究小组为了探究一种不溶性盐X(仅含四种元素)的组成和性质,设计并完成了如下实验:
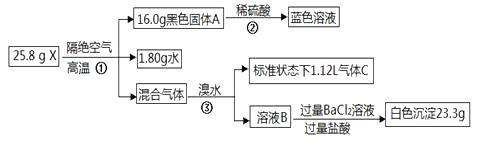
请回答:
(1)、X除了含有H、O元素外,还有元素(填元素符号)。(2)、混合气体通入溴水中发生反应③的离子方程式。(3)、写出X的化学式。18. 化合物X(只含两种短周期元素)是一种重要的还原剂。某同学取X做了如下实验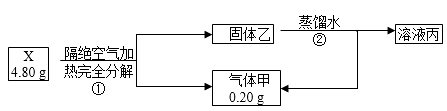
请回答:
(1)、X的电子式是(2)、写出X与水反应的化学方程式。(3)、X在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式。19. 氮和磷为周期表中的第VA族元素,它们的元素及其化合物在性质上既有相似性又有不同性。回答下列问题:(1)、N2分子中两个N原子都达到8电子稳定状态,则两个N原子之间共有电子的数目为;白磷的分子式为P4 , 4个P原子相互之间共形成6个共价单键,且每个P原子都达到8电子稳定状态,则白磷分子的空间构型为。(2)、N、P两种元素都能形成多种气态氢化物。联氨(N2H4)为二元弱碱,在水中的电离与氨相似,写出联氨在水中第一步电离方程式 , 联氨与磷酸(H3PO4)形成的磷酸二氢盐的化学方程式为。(3)、P2O5是一种干燥剂,下列气体不能用P2O5干燥的是________(填字母序号)。A、SO2 B、NH3 C、CO D、H2 E、H2S F、O2(4)、次磷酸(H3PO2)是一元中强酸,它的工业制法是将白磷与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2 , 后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式 , Ba(H2PO2)2为(填“正盐”或“酸式盐”)。20. 碱式硫酸铝溶液可用于烟气脱硫。室温下向一定浓度的硫酸铝溶液中加入一定量的碳酸钙粉末,反应后经过滤得到碱式硫酸铝溶液,反应方程式为(2−x)Al2(SO4)3+3xCaCO3+3xH2O=2[(1−x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑
生成物(1−x)Al2(SO4)3·xAl(OH)3中x值的大小影响碱式硫酸铝溶液的脱硫效率。
(1)、制备碱式硫酸铝溶液时,维持反应温度和反应时间不变,提高x值的方法有。(2)、碱式硫酸铝溶液吸收SO2过程中,溶液的pH(填“增大”、“减小”、“不变”)。(3)、通过测定碱式硫酸铝溶液中相关离子的浓度确定x的值,测定方法如下:①取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.3300 g。
②取碱式硫酸铝溶液2.50 mL,稀释至25 mL,加入0.1000 mol·L−1EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.08000 mol·L−1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1−x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)。
21. KIO3是一种无色易溶于水的晶体,医药上可作防治地方甲状腺肿的药剂,目前碘酸钾被广泛应用于食盐加碘。一种由含碘废水制取碘酸钾的工艺如下: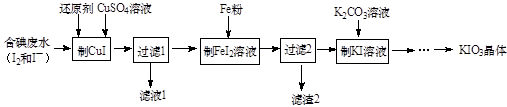 (1)、检验“含碘废水”中含有的单质I2 , 常用的试剂是。(2)、进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤过滤滤液中可通过滴加盐溶液来检验其是否已洗涤干净。(3)、“滤渣2”的成分为(填化学式)。(4)、“制KI”时,发生反应的化学方程式为。(5)、江苏食用加碘盐新标准是每千克食盐中碘元素含量为25毫克(波动范围为18~33mg/kg)。测定食盐试样中碘元素含量的步骤如下:称取4.000g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00mL6.000×10-4mol·L-1Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:
(1)、检验“含碘废水”中含有的单质I2 , 常用的试剂是。(2)、进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤过滤滤液中可通过滴加盐溶液来检验其是否已洗涤干净。(3)、“滤渣2”的成分为(填化学式)。(4)、“制KI”时,发生反应的化学方程式为。(5)、江苏食用加碘盐新标准是每千克食盐中碘元素含量为25毫克(波动范围为18~33mg/kg)。测定食盐试样中碘元素含量的步骤如下:称取4.000g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00mL6.000×10-4mol·L-1Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O =2I- +S4O 。
①计算该食盐试样中碘元素的含量(单位mg/kg,写出计算过程)。
②该食盐试样是否符合江苏食用加碘盐新标准,并说明判断依据。
22.
(1)、下列氯代烃中不能由烯烃与氯化氢加成直接得到的有( )A、氯代环己烷 B、2,2-二甲基-1-氯丙烷 C、2-甲基-2-氯丙烷 D、2,2,3,3一四甲基-1-氯丁烷(2)、盐酸美西律(E)是一种抗心律失常药,其一条合成路线如下:
回答下列问题:
①已知A的分子式为C8H10O,其化学名称为。
②B中的官能团的名称为。
③由A生成C的化学反应方程式为 , 反应类型是。
④由D的结构可判断:D应存在立体异构。该立体异构体的结构简式为。
⑤若用更为廉价易得的氨水替代盐酸羟氨(NH2OH·HCl)与C反应,生成物的结构简式为。
⑥A的同分异构体中能与三氯化铁溶液发生显色反应的还有种:其中,核磁共振氢谱为四组峰,峰面积比为6:2:1:1的结构简式为。
23. 1980年Smith Kline & French(英国)开发了一种叫盐酸卡布特罗的有机物,它是一种用于治疗支气管的药物,其合成路线如下:
已知:①
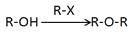 ②
②  (1)、下列说法不正确的是 。A、化合物A能使酸性高锰酸钾溶液褪色 B、试剂X能够和盐酸反应 C、1mol化合物G最多能和4mol氢氧化钠溶液反应 D、反应⑤的反应类型为加成反应(2)、化合物G的结构简式。
(1)、下列说法不正确的是 。A、化合物A能使酸性高锰酸钾溶液褪色 B、试剂X能够和盐酸反应 C、1mol化合物G最多能和4mol氢氧化钠溶液反应 D、反应⑤的反应类型为加成反应(2)、化合物G的结构简式。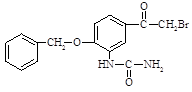 (3)、写出④的化学方程式。(4)、已知:①苯环上有甲基或乙基时,新取代基主要在邻位或对位;
(3)、写出④的化学方程式。(4)、已知:①苯环上有甲基或乙基时,新取代基主要在邻位或对位;②苯环上有羧基或酯基时,新取代基主要在间位。
结合上述合成路线,请设计以乙苯、ClCH2OH、(CH3)2NH为原料合成
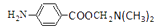 的合成路线(用流程图表示,无机试剂任选),示例如下:
的合成路线(用流程图表示,无机试剂任选),示例如下: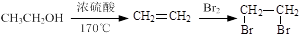 (5)、写出同时满足下列条件的X的所有同分异构体的结构简式。
(5)、写出同时满足下列条件的X的所有同分异构体的结构简式。①有苯环;②核磁共振氢谱有4个峰。
24. 物质的量是沟通宏观与微观的桥梁,物质的量的计算在生产、生活、科技等方面具有广泛的应用。请回答下列问题:(1)、一定量的液态化合物XY2 , 在足量的O2中完全燃烧,反应的方程式为:XY2 (液)+3O2 (气) XO2(气) +2YO2(气)。①若参加反应的XY2的物质的量为0.01 mol,则生成的气体XO2和YO2的体积比为;
②若测得反应后混合气体的总体积为896 mL(STP),则反应前O2的物质的量为。
(2)、病人输液用的葡萄糖(化学式为C6H12O6)注射液,其标签上的部分内容如图所示。
①该注射液的密度为g/cm3;
②该注射液中葡萄糖的物质的量浓度为。
(3)、已知某无土栽培植物营养液的配方为0.3 mol KCl、0.2 molK2SO4、0.4 molNH4Cl和1 L H2O。若以KCl、(NH4)2 SO4和1 L H2O为原料配得相同组成的营养液,需(NH4)2 SO4的物质的量为mol;KCl的物质的量为mol。(4)、实验室为完成某实验,需要0.1 mol/L的Na2CO3溶液490 mL。①则该同学应在托盘天平上称取g十水碳酸钠晶体;
②配制所需Na2CO3溶液用到的玻璃仪器为;
③下列实验操作造成所配溶液的浓度偏低的是(填标号)。
A.忘记将洗涤液转移至容量瓶中
B.托盘天平的砝码生锈
C.容量瓶的内壁附有水珠而未进行干燥处理
D.定容时,俯视容量瓶的刻度线