辽宁省锦州市滨海新区2018-2019学年高三上学期化学12月月考测试卷
试卷更新日期:2018-11-22 类型:月考试卷
一、单选题
-
1. 反应A(g) + 3B(g) ⇌2C(g) + 2D(g) 在四种不同情况下的反应速率分别为:① 、 ② 、 ③ 、④ ,该反应进行的快慢顺序为( )A、①>③=②>④ B、①>②=③>④ C、②>①=④>③ D、①>④>②=③2. 对于任何一个平衡体系,采取下列措施后,一定会使平衡移动的是( )A、加入一种反应物 B、对平衡体系加压 C、升高温度 D、使用催化剂3. 在一定条件下,反应2HI(g)⇌H2(g)+I2(g)△H>0达到平衡时,要使混合气体的颜色变浅,可采取的措施是( )
①增大氢气的浓度 ②升高温度 ③降低温度 ④增大压强 ⑤增大HI的浓度 ⑥扩大体积 ⑦加催化剂.
A、①③⑥ B、③⑤⑥ C、①③⑤ D、②④⑤4. 如图为反应N2+3H2 2NH3的速率v(N2)变化的图像,则横坐标不可能是( )
2NH3的速率v(N2)变化的图像,则横坐标不可能是( )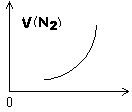 A、反应时间 B、温度 C、压强 D、N2的浓度5. 在密团容器中充入1molCO和1molH2O(气),在一定条件下达到平衡时生成了2/3mol CO2(反应为CO+H2O(g) CO2+H2),当其他条件不变,充入的水蒸气改变为2mol时,平衡时生成CO2的物质的量可能是( )A、0.5mol B、0.95mol C、1mol D、2/3mol6. 在C(s)+CO2(g)=2CO(g)反应中,可使反应速率增大的措施是( )
A、反应时间 B、温度 C、压强 D、N2的浓度5. 在密团容器中充入1molCO和1molH2O(气),在一定条件下达到平衡时生成了2/3mol CO2(反应为CO+H2O(g) CO2+H2),当其他条件不变,充入的水蒸气改变为2mol时,平衡时生成CO2的物质的量可能是( )A、0.5mol B、0.95mol C、1mol D、2/3mol6. 在C(s)+CO2(g)=2CO(g)反应中,可使反应速率增大的措施是( )①增大压强 ②增加炭的量 ③通入CO2 ④恒压下充入N2 ⑤恒容下充入N2 ⑥升温
A、①③④ B、①③⑥ C、②④⑥ D、③⑤⑥7. 将一定量的SO2和O2充入一个容积固定的密闭容器中,在一定条件下发生反应:2SO2+O2⇌2SO3 , 下列哪个量不再变化时,并不能说明化学反应已达到平衡状态( )A、混合气体的密度 B、混合气体的压强 C、混合气体的平均摩尔质量 D、SO2的转化率8. 对于反应;2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH<0。若该反应在绝热恒容的密闭体系中进行,则下列示意图正确且能说明反应进行到t1时已达到平衡状态的是( )A、 B、
B、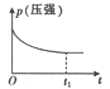 C、
C、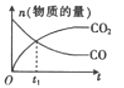 D、
D、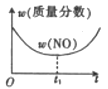 9. 已知某条件下,合成氨反应的数据如下:N2(g)+3H2(g) 2NH3(g)
9. 已知某条件下,合成氨反应的数据如下:N2(g)+3H2(g) 2NH3(g)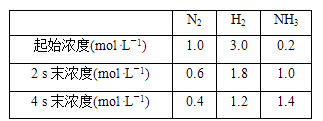
当用氨气浓度的增加来表示该反应的化学反应速率时,下列说法错误的是( )
A、2~4 s内的平均反应速率为0.2 mol·L-1·s-1 B、前4 s内的平均反应速率为0.3 mol·L-1·s-1 C、前2 s内的平均反应速率为0.4 mol·L-1·s-1 D、2 s末的反应速率为0.4 mol·L-1·s-110. 下列叙述中,不能用勒夏特列原理解释的是( )A、红棕色的NO2 , 加压后颜色先变深后变浅 B、高压比常压有利于合成SO3的反应 C、Fe(SCN)3溶液中加入固体KSCN后颜色变深 D、由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深11. 一定温度下,对可逆反应3A(g) 2B(g) +C(g)的下列叙述中,能说明反应已达到平衡的是( ) A、C生成的速率与B分解的速率相等 B、单位时间内消耗3a mol A, 同时消耗生成a mol C C、容器内的压强不再变化 D、混合气体的物质的量不再变化12. 在密闭容器中充入0.5mol N2和1.5mol H2发生反应:N2(g)+3H2(g)
2B(g) +C(g)的下列叙述中,能说明反应已达到平衡的是( ) A、C生成的速率与B分解的速率相等 B、单位时间内消耗3a mol A, 同时消耗生成a mol C C、容器内的压强不再变化 D、混合气体的物质的量不再变化12. 在密闭容器中充入0.5mol N2和1.5mol H2发生反应:N2(g)+3H2(g) 2NH3(g)ΔH =-92.4 kJ•mol-1 , 充分反应后放出的热量为( ) A、等于92.4 kJ B、等于46.2 kJ C、大于46.2 kJ D、小于46.2 kJ13. 一定条件下,向2 L密闭容器中充入4 mol X,2 mol Y,发生反应:2X(g)+Y(g) 2Z(g),该反应的平衡常数的单位是( )A、(mol·L-1)2 B、mol·L-1 C、(mol·L-1)-1 D、(mol·L-1)-214. 已知反应 2NH3 N2 + 3H2 , 在某温度下的平衡常数为0.25,在此条件下,氨的合成反应1/2 N2 + 3/2 H2 NH3的平衡常数为( )A、4 B、2 C、1 D、0.515. 在恒温、容积为2 L的密闭容器中充入2 mol SO2和一定量O2。发生反应2SO2+O2
2NH3(g)ΔH =-92.4 kJ•mol-1 , 充分反应后放出的热量为( ) A、等于92.4 kJ B、等于46.2 kJ C、大于46.2 kJ D、小于46.2 kJ13. 一定条件下,向2 L密闭容器中充入4 mol X,2 mol Y,发生反应:2X(g)+Y(g) 2Z(g),该反应的平衡常数的单位是( )A、(mol·L-1)2 B、mol·L-1 C、(mol·L-1)-1 D、(mol·L-1)-214. 已知反应 2NH3 N2 + 3H2 , 在某温度下的平衡常数为0.25,在此条件下,氨的合成反应1/2 N2 + 3/2 H2 NH3的平衡常数为( )A、4 B、2 C、1 D、0.515. 在恒温、容积为2 L的密闭容器中充入2 mol SO2和一定量O2。发生反应2SO2+O2 2SO3 , 当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是( ) A、等于1.6 mol B、等于1.2 mol C、小于1.2 mol D、大于1.6 mol16. 甲、乙两容器都在进行A→B的反应,甲容器内每分钟减少了4molA,乙容器内每分钟减少了2molA,则甲容器内的反应速率比乙容器内的反应速率要( )A、快 B、慢 C、相等 D、无法判断17. 如图表示容积固定的2L密闭容器中进行的某一可逆反应:A(g)+2B(g 2C(g),以B的浓度改变表示的反应速度v正、v逆与时间的关系如图。已知v的单位为mol/(L·s),则图中阴影部分的面积可表示为 ( )
2SO3 , 当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是( ) A、等于1.6 mol B、等于1.2 mol C、小于1.2 mol D、大于1.6 mol16. 甲、乙两容器都在进行A→B的反应,甲容器内每分钟减少了4molA,乙容器内每分钟减少了2molA,则甲容器内的反应速率比乙容器内的反应速率要( )A、快 B、慢 C、相等 D、无法判断17. 如图表示容积固定的2L密闭容器中进行的某一可逆反应:A(g)+2B(g 2C(g),以B的浓度改变表示的反应速度v正、v逆与时间的关系如图。已知v的单位为mol/(L·s),则图中阴影部分的面积可表示为 ( )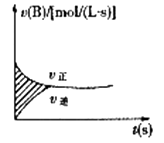 A、A物质的量浓度的减少值 B、B物质的量浓度的减少值 C、C物质的量增加值 D、B物质的量减少值18.
A、A物质的量浓度的减少值 B、B物质的量浓度的减少值 C、C物质的量增加值 D、B物质的量减少值18.合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)
 2NH3(g),673 K、30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
2NH3(g),673 K、30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )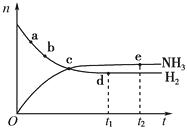 A、点a的正反应速率比点b的小 B、点c处反应达到平衡 C、点d(t1时刻)和点e(t2时刻)处n(N2)不一样 D、其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值大19. 在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)⇌ N2(g)+CO2(g)△H=﹣373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )A、加催化剂同时升高温度 B、加催化剂同时增大压强 C、升高温度同时充入N2 D、降低温度同时增大压强20. 已知反应: 。将一定量的 充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )
A、点a的正反应速率比点b的小 B、点c处反应达到平衡 C、点d(t1时刻)和点e(t2时刻)处n(N2)不一样 D、其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值大19. 在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)⇌ N2(g)+CO2(g)△H=﹣373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )A、加催化剂同时升高温度 B、加催化剂同时增大压强 C、升高温度同时充入N2 D、降低温度同时增大压强20. 已知反应: 。将一定量的 充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )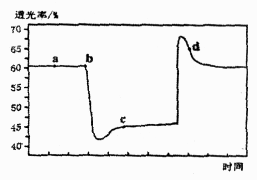 A、b点的操作是压缩注射器 B、c点与a点相比, 增大, 减小 C、平均摩尔质量: D、d点:
A、b点的操作是压缩注射器 B、c点与a点相比, 增大, 减小 C、平均摩尔质量: D、d点:二、填空题
-
21. 某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(标准状况),实验记录如下(累计值):
时间/min
1
2
3
4
5
氢气体积/mL
50
120
232
290
310
(1)、在0~1 min、1~2 min、2~3 min、3~4 min、4~5 min时间段中,反应速率最大的时间段是 , 原因为;反应速率最小的时间段是 , 原因为。
(2)、在2~3 min内,用盐酸的浓度变化表示的反应速率为。(3)、为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液,其中可行的是________。A、蒸馏水 B、Na2SO4溶液 C、NaNO3溶液 D、Na2CO3溶液22. 在850℃时发生如下反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H<0.CO和H2O浓度变化如下图,
t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
时间(min)
CO
H2O
CO2
H2
0
0.200
0.300
0
0
2
0.138
0.238
0.062
0.062
3
C1
C2
C3
C3
4
C1
C2
C3
C3
5
0.116
0.216
0.084
6
0.096
0.266
0.104
①表中3min﹣4min之间反应处于状态;C1数值 0.08mol/L (填大于、小于或等于).
②反应在4min﹣5min问,平衡向逆方向移动,可能的原因是(单选),表中5min﹣6min之间数值发生变化,可能的原因是(单选).
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
三、实验探究题
-
23. 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
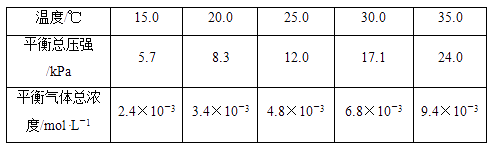 (1)、可以判断该分解反应已经达到平衡的是________(填字母序号)。A、2v(NH3)=v(CO2) B、密闭容器中总压强不变 C、密闭容器中混合气体的密度不变 D、密闭容器中氨气的体积分数不变(2)、根据表中数据,列式计算25.0 ℃时的分解平衡常数:。(3)、取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量将(填“增加”“减少”或“不变”)。(4)、氨基甲酸铵分解反应的焓变ΔH0(填“>”“=”或“<”,下同),熵变ΔS0。
(1)、可以判断该分解反应已经达到平衡的是________(填字母序号)。A、2v(NH3)=v(CO2) B、密闭容器中总压强不变 C、密闭容器中混合气体的密度不变 D、密闭容器中氨气的体积分数不变(2)、根据表中数据,列式计算25.0 ℃时的分解平衡常数:。(3)、取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量将(填“增加”“减少”或“不变”)。(4)、氨基甲酸铵分解反应的焓变ΔH0(填“>”“=”或“<”,下同),熵变ΔS0。