第22讲:盐类的水解及难溶电解质的溶解平衡
试卷更新日期:2018-11-22 类型:一轮复习
一、单选题
-
1. 下列物质溶于水后溶液显酸性的是( )A、KCl B、Na2O C、NH4Cl D、CH3COONa2. 相同温度下,关于盐酸和醋酸两种溶液的比较,下列说法正确的是( )A、相同浓度的两溶液,分别与镁粉反应,开始时反应速率相同 B、相同浓度的两溶液,c(CH3COOˉ) < c(Clˉ) C、分别中和pH相等、体积相等的两溶液,盐酸所需NaOH的物质的量较多 D、pH=3的两溶液分别加水稀释10倍后,醋酸溶液的pH比盐酸大3. 下列有关电解质溶液的说法正确的是( )
A、向K2S溶液中加水稀释, 会减小 B、向醋酸溶液中加NaOH至恰好完全反应,水的电离程度先增大后减小 C、向含有MgCO3同体的溶液中加入少量盐酸, 会增大 D、向CuS和FeS的饱和溶液中加入少量Na2S, 保持不变4. 完成下列实验目的,相关实验设计正确的是( )A、氨气喷泉实验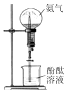 B、比较AgCl和Ag2S的Ksp大小
B、比较AgCl和Ag2S的Ksp大小 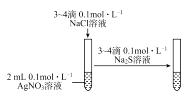 C、实验室制备CO2待用
C、实验室制备CO2待用 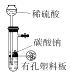 D、测定盐酸浓度
D、测定盐酸浓度  5. 已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp (CaCO3)=2.8×10-9 Ksp(PbCO3)=8.4×10-14 , 三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法错误的是( )
5. 已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp (CaCO3)=2.8×10-9 Ksp(PbCO3)=8.4×10-14 , 三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法错误的是( ) A、a线是CaSO4沉定溶解平衡曲线 B、T℃时,向10mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+)∶c(Pb2+)= C、d点表示CaCO3的饱和溶液。且c(Ca2+)<c(CO32-) D、T℃时,向CaSO4沉淀中加入1mol·L-1的Na2CO3溶液,CaSO4沉淀会转化为CaCO3沉淀6. 测定0.1mol·L-1Na2SO3溶液先升温再降温过程中的pH,数据如下。
A、a线是CaSO4沉定溶解平衡曲线 B、T℃时,向10mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+)∶c(Pb2+)= C、d点表示CaCO3的饱和溶液。且c(Ca2+)<c(CO32-) D、T℃时,向CaSO4沉淀中加入1mol·L-1的Na2CO3溶液,CaSO4沉淀会转化为CaCO3沉淀6. 测定0.1mol·L-1Na2SO3溶液先升温再降温过程中的pH,数据如下。时刻
①
②
③
④
温度/℃
25
30
40
25
pH
9.66
9.52
9.37
9.25
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比试验,④产生白色沉淀多。下列说法错误的是( )
A、Na₂SO3溶液中存在水解平衡:SO32-+H2O HSO-3+OH- B、④的pH与①不同,是由于SO32-浓度减小造成的 C、①→③的过程中,温度和浓度对水解平衡移动方向的影响一致 D、①与④的Kw值相等7. 物质的量浓度均为0.1mol/L的盐酸和醋酸溶液,下列说法正确的是( )A、两溶液加入等质量的锌粉,产生氢气的速率相同 B、两溶液中氢氧根离子浓度均为 mol/L C、加入醋酸钠固体,二者的pH均增大 D、与氢氧化钠反应至中性时,二者消耗氢氧化钠的质量相同8. 常温下,含碳微粒(H2C2O4、HC2O4-、C2O42-)存在于0.1mol/L草酸溶液与等浓度NaOH溶液反应后的溶液中,它们的物质的量分数ω(某微粒物质的量浓度与三种微粒物质的量浓度和比值)与溶液pH的关系如图所示,下列有关说法错误的是( )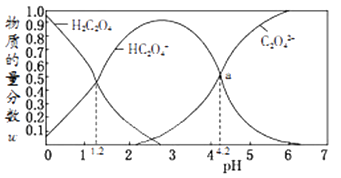 A、向pH=1.2的溶液中加NaOH溶液将pH增大至4.2的过程中水的电离度一直增大 B、pH=4.2时,溶液中c(Na+)>c(HC2O4-)+c(C2O42-) C、若草酸的第二级电离平衡常数为K2 , 则lgK2=-4.2 D、将0.1mol/L相同物质的量浓度NaHC2O4和Na2C2O4的两份溶液等体积混合,可配得上图a点所示混合液9. 下列实验操作规范且能达到相应实验目的的是( )
A、向pH=1.2的溶液中加NaOH溶液将pH增大至4.2的过程中水的电离度一直增大 B、pH=4.2时,溶液中c(Na+)>c(HC2O4-)+c(C2O42-) C、若草酸的第二级电离平衡常数为K2 , 则lgK2=-4.2 D、将0.1mol/L相同物质的量浓度NaHC2O4和Na2C2O4的两份溶液等体积混合,可配得上图a点所示混合液9. 下列实验操作规范且能达到相应实验目的的是( )选项
实验目的
实验操作
A
配制100g4%的NOH溶液
称取4.0gNaOH放在烧杯中,再加入96.0mL水,搅拌均匀
B.
分离KClO3与MnO2制取O2后的残渣
溶解、过滤、洗涤、干燥滤渣得到MnO2 , 滤液蒸发结晶并干燥得到KClO3
C
证明Ksp(BaSO4)<Ksp(BaCO3)
向BaCO3溶液中加入饱和Na2SO4溶液
D
检验Al和Fe2O3反应后固体中是否含Fe2O3
取样,溶于足量稀硫酸,滴加KSCN溶液不变红,说明不含Fe2O3
A、A B、B C、C D、D10. 砷(As)是一些工厂和矿山废水中的污染元素。常温下,H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与加NaOH溶液调节pH的关系如图所示(已知:pKa=-lgKa),下列说法错误的是( )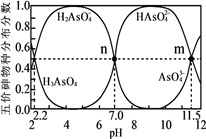 A、Na2HAsO4溶液显碱性 B、H3AsO4溶液pKa2为2.2 C、m点对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1 D、n点对应溶液中离子浓度关系为:c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-)11. 室温下,浓度均为0.1mol/L.体积均为V0的NaX、NaY溶液分别加水稀释至体积V。已知pOH=-lgc(OH-),pOH 与 的变化关系如图所示。下列叙述正确的是( )
A、Na2HAsO4溶液显碱性 B、H3AsO4溶液pKa2为2.2 C、m点对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1 D、n点对应溶液中离子浓度关系为:c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-)11. 室温下,浓度均为0.1mol/L.体积均为V0的NaX、NaY溶液分别加水稀释至体积V。已知pOH=-lgc(OH-),pOH 与 的变化关系如图所示。下列叙述正确的是( )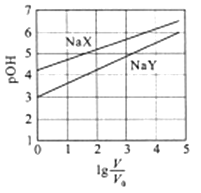 A、HX、HY都是弱酸,且Ka(HX)>Ka(HY) B、图中pOH随 变化始终满足直线关系 C、 =3时,NaX溶液中所含离子总数小于NaY溶液 D、分别向稀释前的两种溶液加盐酸至pH=7时,c(X-)=c(Y-)12. 常温下,向100mL0.1mol/LNH4Cl溶液中,逐滴滴加0.1mol/L NaOH溶液。NH4+和NH3·H2O的变化趋势如图所示(不考虑NH3的逸出)。下列说法正确的是( )
A、HX、HY都是弱酸,且Ka(HX)>Ka(HY) B、图中pOH随 变化始终满足直线关系 C、 =3时,NaX溶液中所含离子总数小于NaY溶液 D、分别向稀释前的两种溶液加盐酸至pH=7时,c(X-)=c(Y-)12. 常温下,向100mL0.1mol/LNH4Cl溶液中,逐滴滴加0.1mol/L NaOH溶液。NH4+和NH3·H2O的变化趋势如图所示(不考虑NH3的逸出)。下列说法正确的是( )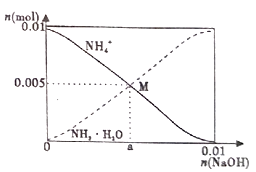 A、M点溶液中水的电离程度比原溶液大 B、在M点时,n(H+)-n(OH-)=(0.005-a)mol C、随着NaOH溶液的滴加, 不断增大 D、当n(NaOH)=0.01mol时,c(NH3·H2O)>c(Na+)>c(OH-)13. 下图所示与对应叙述不相符的是( )
A、M点溶液中水的电离程度比原溶液大 B、在M点时,n(H+)-n(OH-)=(0.005-a)mol C、随着NaOH溶液的滴加, 不断增大 D、当n(NaOH)=0.01mol时,c(NH3·H2O)>c(Na+)>c(OH-)13. 下图所示与对应叙述不相符的是( )



 A、图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)>Ksp(CuS) B、图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸 C、25℃时,图丙表示用0.100mol·L-1的NaOH溶液滴定25.00mL盐酸的滴定曲线,则c(HCl)=0.080mol·L-1 D、图丁表示反应N2(g)+3H2(g) 2NH3(g)平衡时NH3体积分数随起始 变化的曲线,则转化率:aA(H2)<aB(H2)14. 向浓度均为0.010mol·L-1的Na2CrO4、NaBr和NaCl的混合溶液中逐滴加入0.010mol·L-1的AgNO3溶液。[已知Ksp(AgCl)=1.77×10-10 , Ksp(Ag2CrO4)=1.12×10-12 , Ksp(AgBr)=5.35×10-13 , Ag2CrO4为砖红色],下列叙述正确的是( )A、原溶液中n(Na+)=0.040mol B、Na2CrO4 可用作AgNO3溶液滴定Cl-或Br-的指示剂 C、生成沉淀的先后顺序是AgBr一Ag2CrO4一AgCl D、出现Ag2CrO4沉淀时,溶液中c(Cl-):c( Br-)=177:53515. 下列实验操作和现象对应的结论错误的是( )
A、图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)>Ksp(CuS) B、图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸 C、25℃时,图丙表示用0.100mol·L-1的NaOH溶液滴定25.00mL盐酸的滴定曲线,则c(HCl)=0.080mol·L-1 D、图丁表示反应N2(g)+3H2(g) 2NH3(g)平衡时NH3体积分数随起始 变化的曲线,则转化率:aA(H2)<aB(H2)14. 向浓度均为0.010mol·L-1的Na2CrO4、NaBr和NaCl的混合溶液中逐滴加入0.010mol·L-1的AgNO3溶液。[已知Ksp(AgCl)=1.77×10-10 , Ksp(Ag2CrO4)=1.12×10-12 , Ksp(AgBr)=5.35×10-13 , Ag2CrO4为砖红色],下列叙述正确的是( )A、原溶液中n(Na+)=0.040mol B、Na2CrO4 可用作AgNO3溶液滴定Cl-或Br-的指示剂 C、生成沉淀的先后顺序是AgBr一Ag2CrO4一AgCl D、出现Ag2CrO4沉淀时,溶液中c(Cl-):c( Br-)=177:53515. 下列实验操作和现象对应的结论错误的是( )选项
实验操作和现象
结论
A
向溶液X中滴加BaCl2溶液,有白色沉淀生成
溶液X中可能含有SO32-
B

反应结束后,锥形瓶中溶液的溶质是CuSO4 , 集气瓶中收集到的气体是NO
C
向1mL浓度均为0.05mol·L-1NaCl、NaI的混合溶液中滴加2滴0.01mol·L-1AgNO3溶液,振荡,沉淀呈黄色
Ksp(AgCl)<Ksp(AgI)
D
室温下,用pH试纸测得0.1mol·L-1 NaHSO3溶液的pH约为5
HSO3-的电离程度大于其水解程度
A、A B、B C、C D、D二、填空题
-
16. 污水及自来水处理的方法有很多.
Fe2(SO4)3 净水的原理是 . 使用时发现Fe2(SO4)3 并不能使酸性废水中的悬浮物沉降除去,其原因是 . 在酸性环境下,向含重铬酸根的废水中加入FeSO4溶液,然后调节pH,使生成的Cr3+转化为Cr(OH)3 , 写出第一步反应的离子方程式 .
17. 已知Ksp(BaSO4)=1.1×10﹣10 , 若向50.00mL0.009mol•L﹣1Ba(NO3)2溶液中加入50.00mL 0.010mol•L﹣1稀硫酸,混合后溶液中c(Ba2+)= mol•L﹣1 , pH= .18. 常温下,0.1mol•L﹣1NaHB溶液中存在的离子有:Na+、B2﹣、HB﹣、H+、OH﹣ , 存在的分子只有H2O;且c(H+)=0.01mol•L﹣1 , 根据题意回答下列问题:①该溶液中c(HB﹣)+c(B2﹣)=mol•L﹣1
②写出酸H2B的电离方程式﹑ .
③常温下,0.1mol•L﹣1H2B溶液c(H+)0.11mol•L﹣1(填>、<或=).
三、综合题
-
19. NH4Al(SO4)2是常见的焙烤食品添加剂;NH4HSO4在医药、电子工业中用途广泛。请回答下列问题:(1)、相同条件下,0.1mol/L NH4Al(SO4)2中c(NH4+) (填“等于”“大于”或“小于”) 0.1mol/L NH4HSO4中c(NH4+)。
0.1mol/L NH4Al(SO4)2溶液的pH随温度变化的曲线如图甲所示:
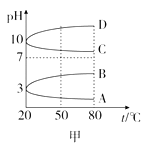 (2)、图甲中符合0.1mol/L NH4Al(SO4)2的pH随温度变化的曲线是(填字母)。(3)、向100mL 0.1mol/L NH4Al(SO4)2溶液中滴入90mL 0.5mol/L NaOH溶液,产生白色沉淀克。(4)、写出NH4HSO4溶液中滴加足量NaOH溶液的化学方程式;
(2)、图甲中符合0.1mol/L NH4Al(SO4)2的pH随温度变化的曲线是(填字母)。(3)、向100mL 0.1mol/L NH4Al(SO4)2溶液中滴入90mL 0.5mol/L NaOH溶液,产生白色沉淀克。(4)、写出NH4HSO4溶液中滴加足量NaOH溶液的化学方程式;25℃时,向100mL 0.1mol/L NH4HSO4溶液中滴加0.1mol/L NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图乙所示。
 (5)、试分析图乙中a、b、c、d四个点,水的电离程度最大的是。20.(1)、①25℃时,NH4Cl溶液呈酸性,原因是水解引起的(填“NH4+”或“Cl-”);
(5)、试分析图乙中a、b、c、d四个点,水的电离程度最大的是。20.(1)、①25℃时,NH4Cl溶液呈酸性,原因是水解引起的(填“NH4+”或“Cl-”);②常温下,0.0100mol/L NaOH溶液的pH=;
③用0.0100mol/L 盐酸滴定未知浓度的NaOH溶液,酚酞作指示剂,滴定终点时,溶液的颜色由浅红色变为(填“蓝色”或“无色”),且半分钟内颜色保持不变。
④ 已知在25℃:AgCl(s) Ag+(aq)+Cl-(aq) Ksp=1.8×10-10
Ag2S(s) 2Ag+(aq)+S2-(aq) Ksp=6.3×10-50
向浓度均为0.001 mol/L的NaCl和Na2S的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是(填“AgCl”或“Ag2S”)。
(2)、已知25℃合成氨反应中,1mol N2完全转化为NH3时释放的能量为92.4 kJ。现将1mol N2和3mol H2混合置于2L密闭容器中,反应进行到2s末测得NH3为0.4mol。回答下列:
① 该反应的热化学方程式是 ;
② 该反应达到平衡后,升高温度平衡向 (填“正”、“逆”)反应方向移动;加入催化剂平衡(填“正”、“逆”、 “不”)移动;
③ 前2s内v(H2)是。
(3)、燃料电池能量转化率高,具有广阔的发展前景。天然气燃料电池中,在负极发生反应的物质是 (填化学式);如果该电池中的电解质溶液是KOH溶液,电极B电极上发生的电极反应式是:。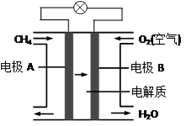 。21. 硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为ZnO,还含有FeO、CuO、SiO2等杂质)制备ZnSO4·7H2O的流程如下。
。21. 硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为ZnO,还含有FeO、CuO、SiO2等杂质)制备ZnSO4·7H2O的流程如下。已知:Ksp[Fe(OH)3]=4.0×10−38 , Ksp[Cu(OH)2]=2.2×10−20
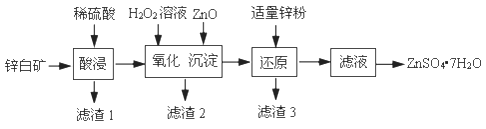 (1)、“滤渣1”的主要成分是(填化学式)。“酸浸”过程中,为了提高锌元素浸出速率,可采取的措施有:①适当提高酸的浓度,②(填一种)。(2)、“氧化”过程中,发生氧化还原反应的离子方程式是。(3)、“沉淀”过程中,加入ZnO产生Fe(OH)3沉淀的原因是。(4)、加入适量ZnO固体,若只析出Fe(OH)3沉淀而未析出Cu(OH)2沉淀,且测得沉淀后的溶液中c(Fe3+)=4.0×10−14mol/L,此时溶液中c(Cu2+)的取值范围是mol/L。(5)、加入适量锌粉的作用是。(6)、由滤液得到ZnSO4•7H2O的操作依次为、、过滤、洗涤、干燥。实验室中过滤操作需要使用的玻璃仪器有烧杯、、。
(1)、“滤渣1”的主要成分是(填化学式)。“酸浸”过程中,为了提高锌元素浸出速率,可采取的措施有:①适当提高酸的浓度,②(填一种)。(2)、“氧化”过程中,发生氧化还原反应的离子方程式是。(3)、“沉淀”过程中,加入ZnO产生Fe(OH)3沉淀的原因是。(4)、加入适量ZnO固体,若只析出Fe(OH)3沉淀而未析出Cu(OH)2沉淀,且测得沉淀后的溶液中c(Fe3+)=4.0×10−14mol/L,此时溶液中c(Cu2+)的取值范围是mol/L。(5)、加入适量锌粉的作用是。(6)、由滤液得到ZnSO4•7H2O的操作依次为、、过滤、洗涤、干燥。实验室中过滤操作需要使用的玻璃仪器有烧杯、、。