第21讲:水溶液和弱电解质的电离
试卷更新日期:2018-11-22 类型:一轮复习
一、单选题
-
1. 下列物质溶于水后因水解显酸性的是( )A、NH4NO3 B、NaHSO4 C、KCl D、KHCO32. 下列说法正确的是( )A、强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 B、强电解质一定是易溶于水的化合物,弱电解质一定是难溶于水的化合物 C、水难电离,纯水是弱电解质 D、溶于水能导电的化合物中一定含有阴阳离子3. 将下列物质溶于水,能促进水的电离的是( )A、NaHSO4 B、Na2CO3 C、SO2 D、NaOH4. 已知Ka(CH3COOH)=1.7×10-5 , Kb(NH3·H2O)=1.7×10-5。25℃时,向40mL浓度均为0.01mol·L-1的盐酸和醋酸(1:1)混合溶液中逐滴加入0.10mol·L-1的氨水,测定过程中电导率和pH变化曲线如图所示,下列说法正确的是( )
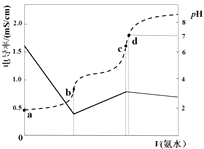 A、a点溶液中,c(CH3COO-)数量级约为10-5 B、b点溶液中,c(NH4+) < c(CH3COOH) C、c点溶液中,c(NH4+) > c(Cl-)+c(CH3COO-) D、d点水的电离程度大于c点5. 向10mL 1 mol·L-1的HCOOH溶液中不断滴加1 mol·L-1的NaOH溶液,并一直保持常温,所加碱的体积与-lg c水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法错误的是( )
A、a点溶液中,c(CH3COO-)数量级约为10-5 B、b点溶液中,c(NH4+) < c(CH3COOH) C、c点溶液中,c(NH4+) > c(Cl-)+c(CH3COO-) D、d点水的电离程度大于c点5. 向10mL 1 mol·L-1的HCOOH溶液中不断滴加1 mol·L-1的NaOH溶液,并一直保持常温,所加碱的体积与-lg c水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法错误的是( ) A、常温下,Ka(HCOOH)的数量级为10-4 B、a、b两点pH均为7 C、从a点到b点,水的电离程度先增大后减小 D、混合溶液的导电性逐渐增强6. 亚砷酸(H3AsO3)可用于治疗白血病,在溶液中存在多种微粒形态。向1L0.1mol·L-1 H3AsO3溶液中逐滴加入0.1mol·L-1KOH溶液,各种微粒物质的量分数与溶液的pH关系如下图所示。下列说法正确的是( )
A、常温下,Ka(HCOOH)的数量级为10-4 B、a、b两点pH均为7 C、从a点到b点,水的电离程度先增大后减小 D、混合溶液的导电性逐渐增强6. 亚砷酸(H3AsO3)可用于治疗白血病,在溶液中存在多种微粒形态。向1L0.1mol·L-1 H3AsO3溶液中逐滴加入0.1mol·L-1KOH溶液,各种微粒物质的量分数与溶液的pH关系如下图所示。下列说法正确的是( ) A、H3AsO3的电离常数Ka1的数量级为10-9 B、pH在8.0~10.0时,反应的离子方程式:H3AsO3+OH-=H2AsO3-+H2O C、M点对应的溶液中:c(H2AsO3-)+c(HAsO32-)+c(AsO33-)+c(H3AsO3)=0.1mol·L-1 D、pH=12时,溶液中:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+)7. 浓度均为0.1mol/L体积均为Vo的HX、HY溶液,分别加水稀释至体积V,pH随V的变化关系如下图所示。下列叙述错误的是( )
A、H3AsO3的电离常数Ka1的数量级为10-9 B、pH在8.0~10.0时,反应的离子方程式:H3AsO3+OH-=H2AsO3-+H2O C、M点对应的溶液中:c(H2AsO3-)+c(HAsO32-)+c(AsO33-)+c(H3AsO3)=0.1mol·L-1 D、pH=12时,溶液中:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+)7. 浓度均为0.1mol/L体积均为Vo的HX、HY溶液,分别加水稀释至体积V,pH随V的变化关系如下图所示。下列叙述错误的是( ) A、HX的酸性比HY的弱,且HY是强酸 B、NaX溶液中存在关系:c(X-)+c(HX)=c(Na+) C、相同温度下,电离常数K(HX):a=b D、 ,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则 减小8. 某温度时水的离子积为1×10-12 , 若该温度下某溶液中的H+浓度为1×10-7mol·L-1 , 则该溶液是( )A、酸性 B、碱性 C、中性 D、无法判断9. 对于常温下1升pH=1 的硝酸溶液,下列叙述正确的是( )A、该溶液1mL稀释至100mL后,pH等于3 B、向该溶液中加入含 0.1mol 氢氧化钡的溶液恰好完全中和 C、该溶液中硝酸电离出的 c(H+)等于水电离出的c(H+) D、该溶液中硝酸电离出的 c(H+)是水电离出的c(H+)的100倍10. X、Y、Z、W是原子序数依次增大的短周期主族元素。Y的单质经常作为保护气;由Z、W形成的一种化合物可与X、W形成的化合物反应,生成淡黄色固体。下列推断正确的是( )A、Y的最简单氢化物的热稳定性比Z的强 B、在同周期元素中,W的最高价氧化物对应的水化物的酸性最强 C、离子半径:X<Y<Z<W D、含W的盐溶液可能呈碱性11. 25℃时,2.0×10−3mol ·L-1氢氟酸水溶液中,通过加HCl气体或NaOH固体来调节溶液pH(忽略体积变化),得到c(HF)、c(Fˉ)与溶液pH的变化关系,如下图所示:
A、HX的酸性比HY的弱,且HY是强酸 B、NaX溶液中存在关系:c(X-)+c(HX)=c(Na+) C、相同温度下,电离常数K(HX):a=b D、 ,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则 减小8. 某温度时水的离子积为1×10-12 , 若该温度下某溶液中的H+浓度为1×10-7mol·L-1 , 则该溶液是( )A、酸性 B、碱性 C、中性 D、无法判断9. 对于常温下1升pH=1 的硝酸溶液,下列叙述正确的是( )A、该溶液1mL稀释至100mL后,pH等于3 B、向该溶液中加入含 0.1mol 氢氧化钡的溶液恰好完全中和 C、该溶液中硝酸电离出的 c(H+)等于水电离出的c(H+) D、该溶液中硝酸电离出的 c(H+)是水电离出的c(H+)的100倍10. X、Y、Z、W是原子序数依次增大的短周期主族元素。Y的单质经常作为保护气;由Z、W形成的一种化合物可与X、W形成的化合物反应,生成淡黄色固体。下列推断正确的是( )A、Y的最简单氢化物的热稳定性比Z的强 B、在同周期元素中,W的最高价氧化物对应的水化物的酸性最强 C、离子半径:X<Y<Z<W D、含W的盐溶液可能呈碱性11. 25℃时,2.0×10−3mol ·L-1氢氟酸水溶液中,通过加HCl气体或NaOH固体来调节溶液pH(忽略体积变化),得到c(HF)、c(Fˉ)与溶液pH的变化关系,如下图所示:下列分析正确的是( )
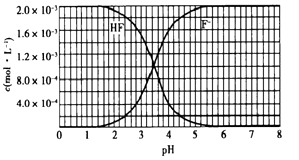 A、pH=1时,溶液中c(Fˉ)+c(OHˉ)=c(H+) B、pH=4时,溶液中存在:c(Fˉ) > c(HF) > c(Na+) > c(H+) C、当溶液中c(HF)=c(Fˉ)时,水的电离被促进 D、将等物质的量的HF和NaF混合物溶于水,Fˉ的水解能力小于HF的电离能力12. pH=1的两种酸溶液HA、HB各1 mL,分别加水稀释到1000 mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
A、pH=1时,溶液中c(Fˉ)+c(OHˉ)=c(H+) B、pH=4时,溶液中存在:c(Fˉ) > c(HF) > c(Na+) > c(H+) C、当溶液中c(HF)=c(Fˉ)时,水的电离被促进 D、将等物质的量的HF和NaF混合物溶于水,Fˉ的水解能力小于HF的电离能力12. pH=1的两种酸溶液HA、HB各1 mL,分别加水稀释到1000 mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )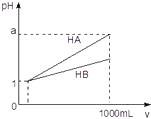 A、同浓度、同体积的HA,HB溶液分别加入过量的锌粒,产生的氢气体积后者大 B、物质的量浓度HA<HB C、若1<a<4,则HA,HB都是弱酸 D、体积相同pH均为1的HA,HB溶液分别滴加同浓度的NaOH溶液至中性,前者消耗的NaOH少13. 相同温度下,关于盐酸和醋酸两种溶液的比较,下列说法正确的是( )A、pH相等的两溶液中:c(CH3COOˉ)=c(Clˉ) B、分别中和pH相等、体积相等的两溶液,所需NaOH的物质的量相同 C、相同浓度的两溶液,分别与金属镁反应,反应速率相同 D、相同浓度的两溶液,分别与NaOH固体反应后呈中性的溶液中(忽略溶液体积变化):c(CH3COOˉ)=c(Clˉ)14. 常温下,CH3COOH和NH3·H2O的电离常数均为1.8×10-5。向20 mL浓度均为0.1 mol/L NaOH和NH3·H2O的混合液中滴加等物质的量浓度的CH3COOH溶液,所得混合液的导电率与加入CH3COOH溶液的体积(V)的关系如图所示。下列说法错误的是( )
A、同浓度、同体积的HA,HB溶液分别加入过量的锌粒,产生的氢气体积后者大 B、物质的量浓度HA<HB C、若1<a<4,则HA,HB都是弱酸 D、体积相同pH均为1的HA,HB溶液分别滴加同浓度的NaOH溶液至中性,前者消耗的NaOH少13. 相同温度下,关于盐酸和醋酸两种溶液的比较,下列说法正确的是( )A、pH相等的两溶液中:c(CH3COOˉ)=c(Clˉ) B、分别中和pH相等、体积相等的两溶液,所需NaOH的物质的量相同 C、相同浓度的两溶液,分别与金属镁反应,反应速率相同 D、相同浓度的两溶液,分别与NaOH固体反应后呈中性的溶液中(忽略溶液体积变化):c(CH3COOˉ)=c(Clˉ)14. 常温下,CH3COOH和NH3·H2O的电离常数均为1.8×10-5。向20 mL浓度均为0.1 mol/L NaOH和NH3·H2O的混合液中滴加等物质的量浓度的CH3COOH溶液,所得混合液的导电率与加入CH3COOH溶液的体积(V)的关系如图所示。下列说法错误的是( )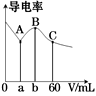 A、a=20,b=40,且溶液呈中性处于A,B两点之间 B、B点溶液中:c(CH3COO-)>c(Na+)>c(NH4+) C、已知lg3≈0.5,则C点的pH≈5 D、A,B,C三点中,B点溶液中水的电离程度最大15. 常温下,将CO2通入2LpH=12的KOH溶液中,溶液中水电离出的OHˉ离子浓度(c)与通入的CO2的体积(V)的关系如图所示.下列叙述错误的是( )
A、a=20,b=40,且溶液呈中性处于A,B两点之间 B、B点溶液中:c(CH3COO-)>c(Na+)>c(NH4+) C、已知lg3≈0.5,则C点的pH≈5 D、A,B,C三点中,B点溶液中水的电离程度最大15. 常温下,将CO2通入2LpH=12的KOH溶液中,溶液中水电离出的OHˉ离子浓度(c)与通入的CO2的体积(V)的关系如图所示.下列叙述错误的是( ) A、a点溶液中:水电离出的c(H+)=1×10-12 mol/L B、b点溶液中:c(H+)=1×10-7mol/L C、c点溶液中:c(K+)=2[c(CO32-)+c(HCO3ˉ)+c(H2CO3)] D、d点溶液中:c(K+)=2c(CO32-)+c(HCO3ˉ)
A、a点溶液中:水电离出的c(H+)=1×10-12 mol/L B、b点溶液中:c(H+)=1×10-7mol/L C、c点溶液中:c(K+)=2[c(CO32-)+c(HCO3ˉ)+c(H2CO3)] D、d点溶液中:c(K+)=2c(CO32-)+c(HCO3ˉ)二、填空题
-
16. 有以下物质A.氨水 B.蔗糖 C.烧碱 D. NH3·H2O E. CO2 F.碳酸钙 G.醋酸 H.铜 I.氯气 J.石墨K.盐酸 L.HCl气体 M.熔融的氯化钠。
其中属于强电解质的是(填序号,下同);属于弱电解质的是;属于非电解质的是。
17. 根据问题填空:(1)、现有下列物质 A.氯化钠 B.醋酸 C.硫酸钡 D.醋酸钠,请用以上物质回答下列问题.①属于弱电解质的是 , 写出其水溶液的电离方程式:;
②D物质的水溶液显(填酸性、碱性或中性),用离子方程式表示其原因 , 其水溶液中离子浓度大小关系为 .
(2)、某温度水的离子积KW=1×10﹣12 , 则该温度(填“>”、“<”或“=”)25℃.18. ①向0.1mol/L NaAlO2溶液中加入等体积0.1mol/L NaHCO3溶液,会产生白色沉淀.据此推断AlO2﹣和CO32﹣结合H+能力更强的是;②已知CO32﹣比ClO﹣结合H+能力更强,则在次氯酸钠溶液中通入少量CO2的离子反应方程式为:;
③室温下,等浓度的NaAlO2溶液的pHNaClO溶液的pH(填>、<或=).
19. 水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.则100℃时1mol•L﹣1的NaOH溶液中,由水电离出的c(H+)=mol•L﹣1 , KW(25℃)KW(100℃)(填“>”、“<”或“=”).25℃时,向水的电离平衡体系中加入少量NH4HCO3固体,对水的电离平衡的影响是(填“促进”、“抑制”或“不影响”).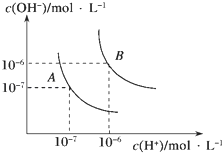
三、综合题
-
20. 现有下列十种物质:①0.1mol/L硫酸、②小苏打、③纯碱、④二氧化碳、⑤葡萄糖、⑥0.1mol/LNaOH溶液、⑦氢氧化铁胶体、⑧氨水、⑨Al2O3、⑩硫酸铁溶液(1)、上述十种物质中,属于非电解质的有(填序号)。(2)、有两种物质在水溶液中可发生反应,离子方程式为:H++OH-=H2O,这两种物质的序号是(填序号)。
(3)、既能跟盐酸反应又能跟NaOH溶液反应的是(填序号)。(4)、标谁状况下,L④中含有0.4mol氧原子。(5)、现有100mL⑩溶液中含Fe3+5.6g,则溶液中c(SO42-)=。
(6)、将①滴加到⑥的溶液中,⑥的溶液导电能力变化为(填“增强”“ 减弱”或“基本不变”)21. 某二元酸H2A在水中的电离方程式是H2A = H+ + HA﹣ , HA﹣ H+ + A2﹣ . 回答下列问题:(1)、Na2A溶液显(填“酸性”、“中性”或“碱性”),理由是(用离子方程式或必要的文字说明).(2)、常温下,已知0.1mol•L﹣1NaHA溶液pH=2,则0.1mol•L﹣1H2A溶液中氢离子的物质的量浓度可能0.11mol•L﹣1(填“大于”、“等于”或“小于”),理由是 .(3)、0.1mol•L﹣1NaHA溶液中各种离子浓度由大到小的顺序是 .(4)、Na2A溶液中,下列表述正确的是_________.A、c(Na+)+ c(H+)= c(HA﹣)+ 2c(A2﹣)+ c(OH﹣) B、c(OH﹣)= c(HA﹣)+ c(H+) C、c(OH﹣)= c(HA﹣)+ c(H+)+ 2c(H2A) D、c (Na+)= 2[c(HA﹣)+ c(A2﹣) + c(H2A)]