第20讲:化学平衡的应用
试卷更新日期:2018-11-22 类型:一轮复习
一、单选题
-
1. 通过控制或改变反应条件可以加快、减缓甚至阻止反应的进行,使化学反应有利于人类的生存和提高生活质量.下列各图所示的措施中,是为了加快化学反应速率的是( )A、铁门表面喷漆
 B、橡胶里加炭黑
B、橡胶里加炭黑 C、扇子扇煤炉火
C、扇子扇煤炉火 D、木头电线杆
D、木头电线杆 2. 在一恒容密闭烧瓶中,25℃时存在平衡:2NO2(g) N2O4(g) △H<0。将烧瓶置于100℃的水中,则下列物理量中不会改变的是( )
2. 在一恒容密闭烧瓶中,25℃时存在平衡:2NO2(g) N2O4(g) △H<0。将烧瓶置于100℃的水中,则下列物理量中不会改变的是( )
A、颜色 B、密度 C、N2O4的浓度 D、压强3. 硝酸生产中,500℃时,NH3和O2可能发生如下反应:①4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)+9072kJ/K=1.1×1026
②4NH3(g)+4O2(g)⇌2N2O(g)+6H2O(g)+1105kJ/K=4.4×1028
③4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g)+1269kJ/K=7.1×1034
其中,②、③是副反应.若要减少副反应,提高NO的产率,最合理的措施是( )
A、减小压强 B、降低温度 C、增大O2浓度 D、使用合适的催化剂4. 下列有关工业生产过程的叙述正确的是( )A、合成氨工业中及时将NH3液化分离,可加快反应速率,并提高N2、H2的转化率 B、向汽油中添加甲醇后,该混合燃料的热值不变 C、氯碱工业中采用阴离子交换膜法,可防止阴极产生的Cl2和阳极产生的碱反应 D、目前淡化海水的方法有多种,其中蒸馏法历时最久,成本最高5. 在一密闭容器中,反应aA(g)+bB(g)⇌cB(g)+dD(s)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则( )A、D的浓度减小了 B、A的转化率减小了 C、物质B的质量分数增加了 D、a+b>c+d6. 已知一定温度下,2X(g)+Y(g)⇌mZ(g)△H=﹣a kJ/mol(a>0),现有甲、乙两容积相等且固定不变的密闭容器,在保持该温度下,向密闭容器甲中通入2mol X和1mol Y,达到平衡状态时,放出热量b kJ,向密闭容器乙中通入1mol X和0.5mol Y,达到平衡时,放出热量c kJ,且b>2c,则a、b、m的值或关系正确的是( )A、m=4 B、a=b C、a< D、m<37. 下列关于化学反应限度的叙述错误的是( )A、不同的化学反应,限度可能不同 B、可以通过改变温度来控制化学反应的限度 C、可以通过延长化学反应的时间来改变化学反应的限度 D、一个化学反应在一定条件下达到限度时,正、逆反应速率相等8. NO2存在下列平衡:2NO2(g)⇌N2O4(g)+Q(Q>0)在测定NO2的相对分子质量时,下列条件下测定结果最接近理论值的是( )A、温度130℃、压强3.03×105Pa B、温度25℃、压强1.01×105Pa C、温度130℃、压强5.05×104Pa D、温度0℃、压强5.05×104Pa9. T℃时,在一固定容积的密闭容器中发生反应: A(g)+B(g) C(s) △H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是( )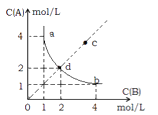 A、T℃时,该反应的平衡常数 B、c点没有达到平衡,此时反应向逆向进行 C、若c点为平衡点,则此时容器内的温度高于T℃ D、T℃时,直线cd上的点均为平衡状态10.
A、T℃时,该反应的平衡常数 B、c点没有达到平衡,此时反应向逆向进行 C、若c点为平衡点,则此时容器内的温度高于T℃ D、T℃时,直线cd上的点均为平衡状态10.德国哈伯发明以低成本制造大量氨的方法,流程图中为提高原料转化率而采取措施是( )
 A、①②③ B、②④⑤ C、①③⑤ D、②③④11. 在一定容积的密闭容器中进行反应:N2(g)+3H2(g) 2NH3(g)。已知反应过程中某一时刻N2 , H2 , NH3的浓度分别为0.1mol/L,0.3mol/L,0.2mol/L。当反应达到平衡时,可能存在的数据是( )A、N2为0.2mol/L,H2为0.6mol/L B、N2为0.15mol/L C、N2 , H2均为0.18mol/L D、NH3为0.4mol/L12. 在容积不变的密闭容器中进行反应X(g)+Y(g)⇌2Z(g)+W(s),已知反应中X、Y的起始浓度分别为0.1mol•L-1、0.2mol•L-1 , 在一定条件下,当反应达到化学平衡时,各物质的浓度可能是( )A、X为0.05mol•L-1 B、Y为0.1mol•L-1 C、Z为0.2mol•L-1 D、W为0.1mol•L-113. 下列对化学平衡移动的分析中,不正确的是( )
A、①②③ B、②④⑤ C、①③⑤ D、②③④11. 在一定容积的密闭容器中进行反应:N2(g)+3H2(g) 2NH3(g)。已知反应过程中某一时刻N2 , H2 , NH3的浓度分别为0.1mol/L,0.3mol/L,0.2mol/L。当反应达到平衡时,可能存在的数据是( )A、N2为0.2mol/L,H2为0.6mol/L B、N2为0.15mol/L C、N2 , H2均为0.18mol/L D、NH3为0.4mol/L12. 在容积不变的密闭容器中进行反应X(g)+Y(g)⇌2Z(g)+W(s),已知反应中X、Y的起始浓度分别为0.1mol•L-1、0.2mol•L-1 , 在一定条件下,当反应达到化学平衡时,各物质的浓度可能是( )A、X为0.05mol•L-1 B、Y为0.1mol•L-1 C、Z为0.2mol•L-1 D、W为0.1mol•L-113. 下列对化学平衡移动的分析中,不正确的是( )①已达平衡的反应C(s)+H2O(g)⇌CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)⇌2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动.
A、①④ B、①②③ C、②③④ D、①②③④14. 工业上合成氨时一般采用700K左右的温度,其原因是( )①提高合成氨的速率 ②提高氢气的转化率③提高氨的产率 ④催化剂在700K时活性最大.
A、只有① B、①② C、②③④ D、①④15. 反应N2(g)+3H2(g) 2NH3(g)ΔH<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( ) A、容器内的温度不再变化 B、容器内的压强不再变化 C、相同时间内,断开H-H键的数目和生成N-H键的数目相等 D、容器内气体的浓度c(N2)∶c(H2)∶c(NH3)=1∶3∶2
2NH3(g)ΔH<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( ) A、容器内的温度不再变化 B、容器内的压强不再变化 C、相同时间内,断开H-H键的数目和生成N-H键的数目相等 D、容器内气体的浓度c(N2)∶c(H2)∶c(NH3)=1∶3∶2二、填空题
-
16. 在容积固定且为2L的密闭容器中进行反应:N2(g)+3H2(g)=2NH3(g)△H=﹣92.4kJ/mol,恒温条件下,体系中某两种物质的物质的量随时间关系图,回答下列问题:

(1)图象中a、b、c、d四点,其中处于平衡状态的点有
(2)用H2表示15分钟内的反应速率为v(H2)= .达到平衡状态时,下列说法不正确的是
A.2v(N2)正=v(NH3)逆
B.容器的总压强不再随时间而变化
C.N2、NH3的分子数之比保持1:2不变
D.混合气体的摩尔质量保持不变
E.充入少量He时平衡体系中H2的体积百分含量将会减小
(3)25min时采用的措施是 ;若从a点时刻改变某一条件,以实现达到d点时的状态,此时KbKd(填“<”、“>”或“=”).
(4)以N2、H2为电极反应物,以1L浓度均为0.05mol•L﹣1的HCl﹣NH4Cl混合液为电解质溶液的燃料电池,请写出电池工作时的正极反应式: .已知NH3•H2O在常温下的电离平衡常数为K,N2﹣H2燃料电池工作一段时间后溶液的pH=7,求电路中通过的电子的物质的量为 (用含K的代数式表示,假设NH3与H2O完全转化为NH3•H2O且忽略溶液体积的变化).
17. 已知一定条件下合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1 , 在反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施。
2NH3(g) ΔH=-92.4 kJ·mol-1 , 在反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施。
t1; t2; t3; t4。
18. 在某一容积为2L的密闭容器中,X,Y,Z三种气体的物质的量n(mol)随时间t(min)的变化曲线如图所示.
①该反应的化学方程式为
②0~6min内用X的浓度变化表示的平均反应速度为
③第4min时,曲线发生改变的条件可能是
19. 在一个固定体积的密闭容器内,保持一定的温度发生以下反应:H2+Br2⇌2HBr.已知加入1molH2和2molBr2 时,达到平衡状态生成a molHBr.在相同条件下,且保持平衡时的各物质的百分含量相同,则填写下列空白:编号
起始状态(mol)
平衡时HBr
物质的量(mol)
H2
Br2
HBr
已知
1
2
0
a
①
2
4
0
②
1
0.5a
③
m
n(n≥2m)
三、综合题
-
20. “绿水青山就是金山银山”,研究NO2、NO、CO、SO2等大气污染物和水污染物的处理对建设美丽中国具有重要意义。(1)、已知: ①NO2+CO CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
NO2
CO
CO2
NO
812kJ
1076kJ
1490kJ
632kJ
②N2(g)+O2(g) 2NO(g) △H=+179.5kJ/mol K2
③2NO(g)+O2(g) 2NO2(g) △H=-112.3kJ/mol K3
写出NO与CO反应生成无污染气体的热化学方程式 , 该热化学方程式的平衡常数K=(用K1、K2、K3表示)。
(2)、在体积可变的恒压(p总)密闭容器中充入1molCO2 与足量的碳,让其发生反应: C(s)+ CO2(g) 2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。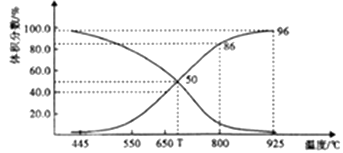
①T℃时,在容器中若充入稀有气体,v(正)v(逆)(填“>”“<”或“="),平衡移动(填“正向”“逆向”或“不”。下同);若充入等体积的CO2 和CO,平衡移动。
②CO体积分数为40%时,CO2 的转化率为。
③已知:气体分压(p分)=气体总压×体积分数。用平衡分压代替平衡浓度表示平衡Kp常数的表达式为;925℃时,Kp=(用含p总的代数式表示)。
(3)、直接排放含SO2 的烟气会形成酸雨,危害环境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。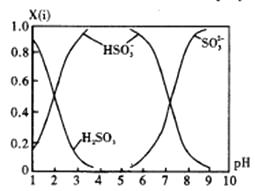
①若是0.1mol/LNaOH 反应后的溶液,测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2 溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因。
21. 氨是最重要的氮肥,是产量最大的化工产品之一.德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1 , 他因此获得了1918年诺贝尔化学奖.在密闭容器中,将2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ·mol-1 , 他因此获得了1918年诺贝尔化学奖.在密闭容器中,将2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。 (1)、当反应达到平衡时,N2和H2的浓度比是;N2和H2的转化率比是 . 反应放出的热量(填“大于”“小于”或“等于”)184.8 kJ。(2)、降低平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 , 密度 . 平衡常数K(填“增大”“减小”或“不变”).(3)、当达到平衡时,充入氩气,并保持压强不变,平衡将(填“正向”“逆向”或“不”)移动.(4)、若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将(填“向左移动”“向右移动”或“不移动”).达到新平衡后,容器内温度(填“大于”“小于”或“等于”)原来的2倍。
2NH3(g) ΔH=-92.4 kJ·mol-1。 (1)、当反应达到平衡时,N2和H2的浓度比是;N2和H2的转化率比是 . 反应放出的热量(填“大于”“小于”或“等于”)184.8 kJ。(2)、降低平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 , 密度 . 平衡常数K(填“增大”“减小”或“不变”).(3)、当达到平衡时,充入氩气,并保持压强不变,平衡将(填“正向”“逆向”或“不”)移动.(4)、若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将(填“向左移动”“向右移动”或“不移动”).达到新平衡后,容器内温度(填“大于”“小于”或“等于”)原来的2倍。