第19讲:化学反应方向及化学平衡
试卷更新日期:2018-11-22 类型:一轮复习
一、单选题
-
1. 对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ΔH=-444.3 kJ·mol-1 ΔS=-280.1 J·mol-1·K-1。在常温、常压下反应能自发进行,对反应的方向起决定性作用的是( )A、熵变 B、温度 C、压强 D、焓变2. 已知:△G=△H-T△S,当△G<0,反应能自发进行,△G>0反应不能自发进行。下列说法中正确的是( )A、非自发反应在任何条件下都不能发生 B、熵增加且放热的反应一定是自发反应 C、自发反应一定是熵增加的反应,非自发反应一定是熵减小或不变的反应 D、凡是放热反应都是能自发进行的反应,而吸热反应都是非自发进行的反应3. 目前国际空间站处理CO2废气涉及的反应为CO2+4H2
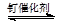 CH4+2H2O。该反应的下列说法正确的是( ) A、钌催化剂能加快该反应的速率 B、升高温度能减慢该反应的速率 C、达到平衡时,CO2能100%转化为CH4 D、达到平衡时,反应速率:v(正) = v(逆) = 04. 在一密闭容器中,当反应aA(g) bB(g)+cC(g)达到平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度为原来的55%,则( )A、平衡向正反应方向移动 B、a>b+c C、物质B的质量分数增大 D、以上判断都错误5. 25℃和1.01×105Pa时,反应2N2O5(g)=4NO2(g)+O2(g) △H=+56.7kJ/mol,自发进行的原因是( )A、是吸热反应 B、是放热反应 C、是熵减少的反应 D、熵增大效应大于能量效应6. 在初始温度为500℃、容积恒定为10L的三个密闭容器中,如图充料发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-25kJ/mol。已知乙达到平衡时气体的压强为开始时的0.55倍;乙、丙中初始反应方向不同,平衡后对应各组分的体积分数相等。下列分析正确的是( )
CH4+2H2O。该反应的下列说法正确的是( ) A、钌催化剂能加快该反应的速率 B、升高温度能减慢该反应的速率 C、达到平衡时,CO2能100%转化为CH4 D、达到平衡时,反应速率:v(正) = v(逆) = 04. 在一密闭容器中,当反应aA(g) bB(g)+cC(g)达到平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度为原来的55%,则( )A、平衡向正反应方向移动 B、a>b+c C、物质B的质量分数增大 D、以上判断都错误5. 25℃和1.01×105Pa时,反应2N2O5(g)=4NO2(g)+O2(g) △H=+56.7kJ/mol,自发进行的原因是( )A、是吸热反应 B、是放热反应 C、是熵减少的反应 D、熵增大效应大于能量效应6. 在初始温度为500℃、容积恒定为10L的三个密闭容器中,如图充料发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-25kJ/mol。已知乙达到平衡时气体的压强为开始时的0.55倍;乙、丙中初始反应方向不同,平衡后对应各组分的体积分数相等。下列分析正确的是( ) A、刚开始反应时速率:甲>乙 B、平衡后反应放热:甲>乙 C、500℃下该反应平衡常数:K=3×102 D、若a≠0,则0.9<b<l7. 某温度下,在三个容积均为1L的恒容密闭容器中仅发生反应: 2NO(g)+Br2(g) 2NOBr(g)(正反应放热)。下列说法正确的是( )
A、刚开始反应时速率:甲>乙 B、平衡后反应放热:甲>乙 C、500℃下该反应平衡常数:K=3×102 D、若a≠0,则0.9<b<l7. 某温度下,在三个容积均为1L的恒容密闭容器中仅发生反应: 2NO(g)+Br2(g) 2NOBr(g)(正反应放热)。下列说法正确的是( )容器
编号
物质的起始浓度(mol/L)
物质的平衡浓度(mol/L)
c(NO)
c(Br2)
c(NOBr)
c(NOBr)
I
0.3
0.15
0.1
0.2
II
0.4
0.2
0
III
0
0
0.2
A、容器II达平衡所需的时间为4min,则v(Br2)=0.05mol/(L•min) B、达平衡时,容器I与容器III中的总压强之比为2:1 C、升高温度,逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 D、达平衡时,容器II中c(Br2)/c(NOBr)比容器III中的小8. 已知某可逆反应:mA(g)+nB(g) r C(g)在密闭容器中进行。下图表示此反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线。由曲线分析下列判断正确的是( )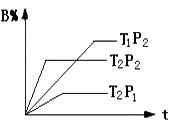 A、T1>T2 , p1>p2 , m+n>r,正反应吸热 B、T1<T2 , p1<p2 , m+n<r,正反应吸热 C、T1>T2 , p1>p2 , m+n<r,正反应放热 D、T1<T2 , p1<p2 , m+n>r,正反应放热9. 下列四个图像所反映的内容与相应反应符合的是(a、b、c、d均大于0)( )A、
A、T1>T2 , p1>p2 , m+n>r,正反应吸热 B、T1<T2 , p1<p2 , m+n<r,正反应吸热 C、T1>T2 , p1>p2 , m+n<r,正反应放热 D、T1<T2 , p1<p2 , m+n>r,正反应放热9. 下列四个图像所反映的内容与相应反应符合的是(a、b、c、d均大于0)( )A、 4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH=-akJ·mol-1
B、
4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH=-akJ·mol-1
B、 N2(g)+3H2(g) 2NH3(g)ΔH=-bkJ·mol-1
C、
N2(g)+3H2(g) 2NH3(g)ΔH=-bkJ·mol-1
C、 2SO3(g) 2SO2(g)+O2(g)ΔH=+ckJ·mol-1
D、
2SO3(g) 2SO2(g)+O2(g)ΔH=+ckJ·mol-1
D、 2N2O5(g) 4NO2(g)+O2(g)ΔH=+dkJ·mol-1
10. 常压下羰基化法精炼镍的原理为:Ni(s) +4CO(g)
2N2O5(g) 4NO2(g)+O2(g)ΔH=+dkJ·mol-1
10. 常压下羰基化法精炼镍的原理为:Ni(s) +4CO(g) Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是 ( )
A、增加c(CO),平衡向正向移动,反应的平衡常数增大 B、第一阶段,在30℃和50℃两者之间选择反应温度,选50℃ C、第二阶段,Ni(CO) 4分解率较低 D、该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)11. 室温下,向圆底烧瓶中加入1molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是( )A、加入NaOH,可增大乙醇的物质的量 B、增大HBr浓度,有利于生成C2H5Br C、若反应物增大至2 mol,则两种反应物平衡转化率之比不变 D、若起始温度提高至60℃,可缩短反应达到平衡的时间12. 已知:25℃时,Ksp[Zn(OH)2]=1.0×10-18 , Ka(HCOOH)=1.0×10-4。该温度下,下列说法错误的是( )A、Zn(OH)2溶于水形成的饱和溶液中c(Zn2+)>1.0×10-6 mol·L-l B、HCOO-的水解常数为1.0×10-10 C、向Zn(OH)2悬浊液中加入HCOOH,溶液中c(Zn2+)增大 D、Zn(OH)2+2HCOOH Zn2++2HCOO-+2H2O的平衡常数K=10013. 在一定的条件下,将 2mol SO2和1mol O2充入一定容密闭容器中,发生下列反应:2SO2(g)+O2(g) 2SO3(g) △H=-197 kJ/mol, 当达到平衡状态时,下列说法中正确的是( )
A、生成 2 mol SO3 B、放出热量197 kJ C、SO2和 SO3共有 2 mol D、含有氧原子共有3mol14. 下图是恒温下H2(g)+I2(g) 2HI(g)+Q(Q>0)的化学反应速率随反应时间变化的示意图,t1时刻改变的外界条件是( ) A、升高温度 B、增大压强 C、增大反应物浓度 D、加入催化剂15. 一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中
A、升高温度 B、增大压强 C、增大反应物浓度 D、加入催化剂15. 一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中 和
和  代表不同元素的原子。( )
代表不同元素的原子。( )
关于此反应说法错误的是( )
A、一定属于吸热反应 B、一定属于可逆反应 C、一定属于氧化还原反应 D、一定属于分解反应16. 下列有关化学反应方向及其判据的说法中错误的是( )A、1mol H2O在不同状态时的熵值:S[H2O(s)]<S[H2O(g)] B、凡是放热反应都是自发的,因为吸热反应都是非自发的 C、CaCO3(s)⇌CaO(s)+CO2(g)△H>0 能否自发进行与温度有关 D、常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0二、填空题
-
17. 若在一定条件下得到的尿素为固体,2NH3(g)+CO2(g)⇌CO(NH2) 2 (s)+H2O(g),开始在一密闭容器中充入0.1molNH3、0.65molH2O(g),保持温度不变,达到平衡时,混合气体的平均摩尔质量与起始相比 (填“变大”、“变小”或“不变”)18.
在某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图所示.
(1)由图中的数据分析,该反应的化学方程式为 .在该温度下,此化学反应的平衡常数表达式为
(2)反应开始至5min,Y的转化率为 .
(3)在其他条件不变的情况下,如果起始充入X、Y、Z的物质的量分别为4mol、6mol、2mol,则此反应向 (填“正反应”,“逆反应”)方向进行.
 19. 根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g),此反应的△S0(填“>”或“<”).若已知:N2(g)+3H2(g)=2NH3(g)△H=a kJ/mol 2H2(g)+O2(g)=2H2O(l)△H=b kJ/mol 2N2(g)+6H2O(l)=4NH3(g)+3O2(g)的△H=用含a、b的式子表示).20. 可逆反应:aA(g)+bB(g) cC(g)+dD(g);根据图回答:
19. 根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g),此反应的△S0(填“>”或“<”).若已知:N2(g)+3H2(g)=2NH3(g)△H=a kJ/mol 2H2(g)+O2(g)=2H2O(l)△H=b kJ/mol 2N2(g)+6H2O(l)=4NH3(g)+3O2(g)的△H=用含a、b的式子表示).20. 可逆反应:aA(g)+bB(g) cC(g)+dD(g);根据图回答:①压强 P1P2;(a+b)(c+d)(填“>”或“<”下同).
②温度t1℃ t2℃;△H0.
③保持体积和温度不变,通入He,平衡会移动(填“正向”、“逆向”或“不”).
 21. 800℃时,在2L密闭容器中发生反应2NO(g)+O2(g)⇌2NO2(g),在反应体系中,n(NO)随时间的变化如表所示:
21. 800℃时,在2L密闭容器中发生反应2NO(g)+O2(g)⇌2NO2(g),在反应体系中,n(NO)随时间的变化如表所示:时间(s)
0
1
2
3
4
5
n(NO)(mol)
0.020
0.010
0.008
0.007
0.007
0.007
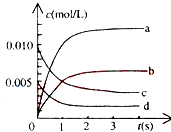
①图中表示NO2变化的曲线是 , 用O2表示从0~2s内该反应的平均速率v= .
②能说明该反应已经达到平衡状态的是
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变.
22.化学学科中的平衡理论包括:化学平衡、电离平衡、溶解平衡等,且均符合勒夏特列原理.请回答下列问题.
(1)一定温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)⇌2C(g)△H>0,起始时,c(A)=0.2mol/L,c(B)=0.6mol/L,c(C)=0.4mol/L.当平衡时,下列数据可能存在的是
a.c(A)=0.4mol/L b.c(B)=1.0mol/L
c.c(A)=0.3mol/L且c(C)=0.2mol/L d.c(C)=1.0mol/L
若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是
a.增加A的物质的量 b.减压
c.升温 d.使用催化剂
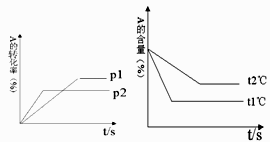
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.
则图中表示醋酸溶液中pH变化曲线的是 (填“a”或“b”).设盐酸中加入的Zn质量为m1 , 醋酸溶液中加入的Zn质量为m2 , 则m1 (选填“<”、“=”、“>”)m2 .

三、综合题
-
23. 现有反应:CO(g)+H2O(g) CO2(g)+H2(g)ΔH<0 在850℃时,K=1。
(1)、若升高温度到950℃时,达到平衡时K1(填“大于”“小于”或“等于”)。(2)、850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2 , 则:①当x=5.0时,上述平衡向(填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是。
(3)、在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则ab(填“大于”“小于”或“等于”)。24. Cu2O是重要的催化剂和化工原料,工业上制备Cu2O的主要反应如下:Ⅰ.C(g)+CO2(g) 2CO(g) ΔH=+172.5kJ/mol
Ⅱ.CO(g)+2CuO(s) Cu2O(s)+CO2(g)ΔH=-138.0KJ/mol
请回答:
(1)、C与CuO反应生成Cu2O和CO的热化学方程式为 , 一定温度下,该反应在密闭容器中达到平衡后,只增大容器的容积,再次达到平衡时,CO的平衡浓度(填“增大”、“减小”或“不变”)。(2)、一定温度下,向5L恒容密闭容器中加入1molCO和2molCuO,发生反应Ⅱ.5min时达到平衡,测得容器中CuO的物质的量为0.8mol。①0-5min内,用CO2表示的反应速率v(CO2)=.
②CO的平衡转化率a=.
(3)、向5L密闭容器中加入1molC和1molCO2 , 发生反应Ⅰ。 CO2、CO的平衡体积分数(φ)与温度(T)的关系如图所示。
①能表示CO2的平衡体积分数与温度关系的曲线为(填"L1”或“L2”),理由为。
②温度为T1时,该反应的平衡常数K=。
(4)、其他条件不变时,若水的分解反应用Cu2O作催化剂,则该反应的活化能(填“增大”、“减小”或“不变”,下同), 反应热(ΔH)。25. 碳的氧化物和氮的氧化物与人类生活息息相关,它们之间有多种相互转化关系,可以变废为宝。(1)、为了模拟汽车尾气在催化转化器内的工作反应情况,控制定条件,让反应在恒容密闭容器中进行如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g),用传感器测得不同时间NO和CO的依度如下表:时间/s
0
1
2
3
4
5
c(NO)(10-4mol/L)
10.0
4.50
2.50
1.50
1.00
1.00
c(NO)(10-3mol/L)
3.60
3.05
2.85
2.75
2.70
2.70
①前2s内的平均反应速率v(N2)= , 此温度下,该反应的平衡常数K=
②能说明上述反应达到平衡状态的是。
A.2n(CO2)=n(N2)
B.混合气体的平均相对分子质量不变
C.气体密度不变
D.容器内气体压强不变
③当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图所示。则NO的平衡转化率随温度升高而减小的原因是 ,压强p1、P2、P3的大小关系是 , 理由是。
 (2)、用氨气催化氧化还原法脱硝(NOx)
(2)、用氨气催化氧化还原法脱硝(NOx)①根据下图判断提高脱硝效率(单位时间内NOx浓度变化占烟气初始浓度的百分比)的最佳条件是:。

②已知:N2(g)+O2(g)=2NO(g)△H=+akJ/mol
N2(g)+3H2(g) 2NH3(g)△H=-bk/mol
2H2(g)+O2(g)=2H2O(g)△H=-ckJ/mol其中a、b、c均为大于0。
则放热反应:4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g)△H=。