第18讲:化学反应速率及其影响因素
试卷更新日期:2018-11-22 类型:一轮复习
一、单选题
-
1. 下列生产生活中需要增大化学反应速率的是( )A、铁锹生锈
 B、牛奶变质
B、牛奶变质  C、塑料老化
C、塑料老化  D、高炉炼铁
D、高炉炼铁  2. 在1 L密闭容器中,把1 mol A和1 mol B混合发生如下反应:3A(g)+B(g) xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,下列叙述中不正确的是( )A、x的值为2 B、A的转化率为60% C、B的平衡浓度为0.8 mol/L D、D的体积分数为25%3. 反应A(g) + 3B(g) ⇌2C(g) + 2D(g) 在四种不同情况下的反应速率分别为:① 、 ② 、 ③ 、④ ,该反应进行的快慢顺序为( )A、①>③=②>④ B、①>②=③>④ C、②>①=④>③ D、①>④>②=③4. 已知反应A(g)+3B(g) 2C(g),在10s内,A的浓度由4mol/L变成了2mol/L,则以A的浓度变化表示的反应速率为( )A、0.2mol/(L·s) B、0.3 mol/(L·s) C、0.4 mol/(L·s) D、0.1 mol/(L·s)5. 将已除去氧化膜的镁条投入到盛有稀盐酸的敞口容器中,产生H2的速率v与时间t的关系如下图所示,其中影响AB段速率的主要因素是( )
2. 在1 L密闭容器中,把1 mol A和1 mol B混合发生如下反应:3A(g)+B(g) xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,下列叙述中不正确的是( )A、x的值为2 B、A的转化率为60% C、B的平衡浓度为0.8 mol/L D、D的体积分数为25%3. 反应A(g) + 3B(g) ⇌2C(g) + 2D(g) 在四种不同情况下的反应速率分别为:① 、 ② 、 ③ 、④ ,该反应进行的快慢顺序为( )A、①>③=②>④ B、①>②=③>④ C、②>①=④>③ D、①>④>②=③4. 已知反应A(g)+3B(g) 2C(g),在10s内,A的浓度由4mol/L变成了2mol/L,则以A的浓度变化表示的反应速率为( )A、0.2mol/(L·s) B、0.3 mol/(L·s) C、0.4 mol/(L·s) D、0.1 mol/(L·s)5. 将已除去氧化膜的镁条投入到盛有稀盐酸的敞口容器中,产生H2的速率v与时间t的关系如下图所示,其中影响AB段速率的主要因素是( ) A、H+的浓度 B、Cl-的浓度 C、溶液的温度 D、体系的压强6. 目前国际空间站处理CO2废气涉及的反应为CO2+4H2
A、H+的浓度 B、Cl-的浓度 C、溶液的温度 D、体系的压强6. 目前国际空间站处理CO2废气涉及的反应为CO2+4H2 CH4+2H2O。该反应的下列说法正确的是( ) A、钌催化剂能加快该反应的速率 B、升高温度能减慢该反应的速率 C、达到平衡时,CO2能100%转化为CH4 D、达到平衡时,反应速率:v(正) = v(逆) = 07. 已知:2CH3COCH3(l) CH3COCH2COH(CH3)2(l)。取等量CH3COCH分别在0℃和20℃下反应,测得其转化率(α)随时间(t)变化的关系曲线如图所示。下列说法正确的是( )
CH4+2H2O。该反应的下列说法正确的是( ) A、钌催化剂能加快该反应的速率 B、升高温度能减慢该反应的速率 C、达到平衡时,CO2能100%转化为CH4 D、达到平衡时,反应速率:v(正) = v(逆) = 07. 已知:2CH3COCH3(l) CH3COCH2COH(CH3)2(l)。取等量CH3COCH分别在0℃和20℃下反应,测得其转化率(α)随时间(t)变化的关系曲线如图所示。下列说法正确的是( ) A、曲线Ⅱ表示20℃时的转化反应 B、升高温度能提高反应物的平衡转化率 C、在a点时,曲线Ⅰ和Ⅱ表示反应的化学平衡常数相等 D、化学反应速率的大小顺序为:d>b>c8. 下列措施不能增大锌与稀硫酸反应制氢气的化学反应速率的是( )A、改用热的稀硫酸溶液 B、向该稀硫酸溶液中加几滴硫酸铜溶液 C、用浓硫酸代替稀硫酸 D、使用粗锌粒或使用锌粉9. 可逆反应X(g)+2Y(g) 2Z(g) △H= -a kJ·mol-1 , 在一定条件下达到化学平衡时,下列说法正确的是( )A、反应放出的热量小于a kJ B、c(X)∶c(Y)∶c(Z)=1∶2∶2 C、X的消耗速率与Z的消耗速率相等 D、气体的密度不再发生变化10. 如图是可逆反应A+2B 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是( )
A、曲线Ⅱ表示20℃时的转化反应 B、升高温度能提高反应物的平衡转化率 C、在a点时,曲线Ⅰ和Ⅱ表示反应的化学平衡常数相等 D、化学反应速率的大小顺序为:d>b>c8. 下列措施不能增大锌与稀硫酸反应制氢气的化学反应速率的是( )A、改用热的稀硫酸溶液 B、向该稀硫酸溶液中加几滴硫酸铜溶液 C、用浓硫酸代替稀硫酸 D、使用粗锌粒或使用锌粉9. 可逆反应X(g)+2Y(g) 2Z(g) △H= -a kJ·mol-1 , 在一定条件下达到化学平衡时,下列说法正确的是( )A、反应放出的热量小于a kJ B、c(X)∶c(Y)∶c(Z)=1∶2∶2 C、X的消耗速率与Z的消耗速率相等 D、气体的密度不再发生变化10. 如图是可逆反应A+2B 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是( )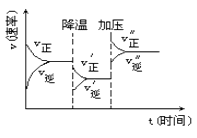 A、正反应是放热反应 B、A,B一定都是气体 C、D一定不是气体 D、C可能是气体11. 一定量的锌粉和6mol/L的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,但不影响产生H2的总量的是( )
A、正反应是放热反应 B、A,B一定都是气体 C、D一定不是气体 D、C可能是气体11. 一定量的锌粉和6mol/L的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,但不影响产生H2的总量的是( )①铜粉 ②铁粉 ③石墨粉 ④CuO ⑤浓盐酸 ⑥碳酸钠 ⑦醋酸钠
A、①③⑤ B、②③⑤⑦ C、①③④⑤ D、④⑤⑥12. 在工业上合成氨反应:N2+3H2 2NH3 ,欲增大反应速率,下列措施可行的是:( )A、降低温度 B、减小压强 C、减小H2的浓度 D、使用催化剂13. 一定条件下,工业合成氨的反应达到平衡。下列措施,既能加快该反应的速率,又能增大反应物转化率的是( )
A、使用催化剂 B、移走 NH3 C、提高反应温度 D、缩小容器体积14. 某工业流程中,进入反应塔的混合气体中NO和O2的物质的量分数分别为0.10和0.06,发生化学反应2NO(g)+O2(g) 2NO2(g),在其他条件相同时,测得实验数据如下表:
2NO2(g),在其他条件相同时,测得实验数据如下表:压强/(×105 Pa)
温度/℃
NO达到所列转化率需要时间/s
50%
90%
98%
1.0
30
12
250
2830
90
25
510
5760
8.0
30
0.2
3.9
36
90
0.6
7.9
74
根据表中数据,下列说法正确的是( )
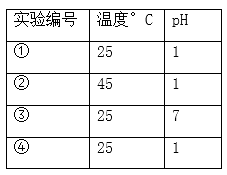
A、升高温度,反应速率加快 B、增大压强,反应速率变慢 C、在1.0×105 Pa、90℃条件下,当转化率为98%时反应已达平衡 D、若进入反应塔的混合气体为a mol,反应速率以v=Δn/Δt表示,则在8.0×105 Pa、30℃条件下,转化率从50%增至90%时段NO的反应速率为4a/370 mol·sˉ115. 用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果.设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,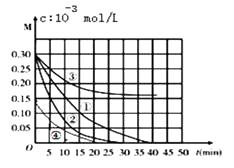
下列说法正确的是( )
A、实验①在15 min内M的降解速率为1.33×10-2mol/(L·min) B、若其他条件相同,实验①②说明升高温度,M降解速率增大 C、若其他条件相同,实验①③证明pH越高,越有利于M的降解 D、实验②④说明M的浓度越小,降解的速率越慢二、填空题
-
16. 某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为: . 反应开始至2min,Z的平均反应速率为
 17. 某温度下,在2 L密闭容器中,X、Y、Z三种气态物质发生化学反应时,物质的量随时间变化的关系曲线如图所示:
17. 某温度下,在2 L密闭容器中,X、Y、Z三种气态物质发生化学反应时,物质的量随时间变化的关系曲线如图所示: (1)、由图中的数据分析,该反应的化学方程式为。(2)、5 min内用Z表示的平均反应速率为。(3)、化学反应速率受到很多因素的影响,例如:实验室制取氢气时一般用粗锌替代纯锌和稀硫酸反应,这是利用原理加快了氢气生成的速率。18.(1)、在反应A(g)+3B(g)=2C(g)中,若以物质A表示的该反应的化学反应速率为0.2 mol·L-1·min-1 , 则以物质B表示此反应的化学反应速率为 mol·L-1·min-1。(2)、在2 L的密闭容器中,充入2 mol N2和3 mol H2 , 在一定条件下发生反应,3 s后测得N2为1.9 mol,则以H2的浓度变化表示的反应速率为。(3)、将10 mol A和5 mol B放入容积为10 L的密闭容器中,某温度下发生反应:3A(g)+B(g)
(1)、由图中的数据分析,该反应的化学方程式为。(2)、5 min内用Z表示的平均反应速率为。(3)、化学反应速率受到很多因素的影响,例如:实验室制取氢气时一般用粗锌替代纯锌和稀硫酸反应,这是利用原理加快了氢气生成的速率。18.(1)、在反应A(g)+3B(g)=2C(g)中,若以物质A表示的该反应的化学反应速率为0.2 mol·L-1·min-1 , 则以物质B表示此反应的化学反应速率为 mol·L-1·min-1。(2)、在2 L的密闭容器中,充入2 mol N2和3 mol H2 , 在一定条件下发生反应,3 s后测得N2为1.9 mol,则以H2的浓度变化表示的反应速率为。(3)、将10 mol A和5 mol B放入容积为10 L的密闭容器中,某温度下发生反应:3A(g)+B(g) 2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1 , 则在2 s时,容器中有 mol A,此时C的物质的量浓度为。
2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1 , 则在2 s时,容器中有 mol A,此时C的物质的量浓度为。
三、解答题
-
19. 把0.6mol X气体和0.6mol Y气体混合于2L密闭容器中,使它们发生如下反应:2X(g)+Y(g)=nM(g)+2W(g).2min 末,若测知以W 的浓度变化表示的反应速率为0.05mol•L﹣1•min﹣1 , 容器内气体的总物质的量与反应前容器内气体的总物质的量之比为5:4,计算:
(1)前2min内用Y的浓度变化表示的平均反应速率.
(2)2min末时X的浓度.
(3)化学反应方程式中n的值是多少?
四、综合题
-
20. 一密封体系中发生下列反应:N2 +3H2 2NH3 ΔH<0,下图是某一时间段中反应速率与反应进程的曲线关系图:

回答下列问题:
(1)、处于平衡状态的时间段是 .(2)、t1、t3、t4时刻体系中分别是什么条件发生了变化?、、
(3)、下列各时间段时,氨的百分含量最高的是______.A、t0~t1 B、t2~t3 C、t3~t4 D、t5~t6
-