2019年高考化学模拟卷(卷I)
试卷更新日期:2018-11-18 类型:高考模拟
一、单选题
-
1. 习近平总书记指出“绿水青山就是金山银山”。下列观点合理的( )A、将工业废液排入海洋以减少河道污染 B、为了减少火电厂产生的大气污染,应将燃煤粉碎并鼓人尽可能多的空气 C、习总书记2018年4月2日参加北京植树节这体现了绿色化学的思想 D、与2016年相比,2017年某地区降水pH平均值增加了0.27,说明酸雨情况有所改善2. 设 为阿伏加德罗常数的值,下列叙述正确的是( )A、 的 溶液中含有 的数目为 B、1mol苯乙烯(
 )中含有的碳碳双键数为
C、加热条件下, 金属Na与足量 反应的产物中阳离子和阴离子总数为 .
D、常温时,1 的硝酸铵溶液中, 和 总数为
3. 短周期主族元素a、b、c、d原子序数依次增大,b元素的一种同位素可用于考古年代鉴定。甲、乙分别是元素b、d的单质,通常甲为固体,乙为气体,0.001mol/L的丙溶液pH=3;W、X、Y均是由这些元素构成的二元化台物,Y是形成酸雨的主要物质之一。上述物质的转化关系如图,下列说法正确的是( )
)中含有的碳碳双键数为
C、加热条件下, 金属Na与足量 反应的产物中阳离子和阴离子总数为 .
D、常温时,1 的硝酸铵溶液中, 和 总数为
3. 短周期主族元素a、b、c、d原子序数依次增大,b元素的一种同位素可用于考古年代鉴定。甲、乙分别是元素b、d的单质,通常甲为固体,乙为气体,0.001mol/L的丙溶液pH=3;W、X、Y均是由这些元素构成的二元化台物,Y是形成酸雨的主要物质之一。上述物质的转化关系如图,下列说法正确的是( )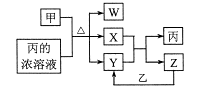 A、原子半径:b B、a、c、d形成的化台物一定是共价化合物 C、W、X、Y中X的熔沸点最高 D、Y、Z均可用排水法收集4. 二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )
A、原子半径:b B、a、c、d形成的化台物一定是共价化合物 C、W、X、Y中X的熔沸点最高 D、Y、Z均可用排水法收集4. 二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )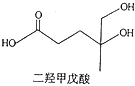 A、与乙醇发生酯化反应生成产物的分子式为C8H18O4 B、能发生加成反应,不能发生取代反应 C、在铜的催化下与氧气反应的产物可以发生银镜反应 D、标准状况下1mol该有机物可以与足量金属钠反应产生22.4LH25. 下列各组离子能大量共存,且当加入试剂后反应的离子方程式书写正确的是( )
A、与乙醇发生酯化反应生成产物的分子式为C8H18O4 B、能发生加成反应,不能发生取代反应 C、在铜的催化下与氧气反应的产物可以发生银镜反应 D、标准状况下1mol该有机物可以与足量金属钠反应产生22.4LH25. 下列各组离子能大量共存,且当加入试剂后反应的离子方程式书写正确的是( )选项
离子组
加入试剂
发生反应的离子方程式
A
Fe3+、I-、Cl-
NaOH溶液
Fe3+ + 3OH- =Fe(OH)3↓
B
K+、ClO-、SO42-
盐酸
H++ClO- =HClO
C
K+、OH-、Cl-
过量SO2
SO2+ OH-=HSO3-
D
H+、Fe2+、 SO42-
Ba(NO3)2溶液
SO42-+ Ba2+ =BaSO4↓
A、A B、B C、C D、D6. 常温下,CH3COOH和NH3·H2O的电离常数均为1.8×10-5。向20 mL浓度均为0.1 mol/L NaOH和NH3·H2O的混合液中滴加等物质的量浓度的CH3COOH溶液,所得混合液的导电率与加入CH3COOH溶液的体积(V)的关系如图所示。下列说法错误的是( )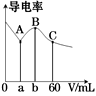 A、a=20,b=40,且溶液呈中性处于A,B两点之间 B、B点溶液中:c(CH3COO-)>c(Na+)>c(NH4+) C、已知lg3≈0.5,则C点的pH≈5 D、A,B,C三点中,B点溶液中水的电离程度最大7. 在好氧菌和厌氧菌作用下,废液中NH4+能转化为N2(g)和H2O(l),示意图如下:
A、a=20,b=40,且溶液呈中性处于A,B两点之间 B、B点溶液中:c(CH3COO-)>c(Na+)>c(NH4+) C、已知lg3≈0.5,则C点的pH≈5 D、A,B,C三点中,B点溶液中水的电离程度最大7. 在好氧菌和厌氧菌作用下,废液中NH4+能转化为N2(g)和H2O(l),示意图如下: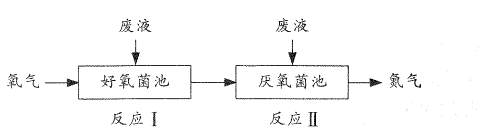
反应I
反应Ⅱ
下列说法正确的是( )
A、两池发生的反应中,氮元素只被氧化 B、两池中投放的废液体积相等时,NH4+能完全转化为N2 C、常温常压下,反应Ⅱ中生成22.4LN2转移的电子数为3.75×6 02×1023 D、二、实验
-
8. 水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl据此,某学生设计了下列实验。
【制备NaClO溶液】实验装置如下图图甲所示(部分夹持装置已省略)
已知:3NaClO 2NaCl+NaClO3
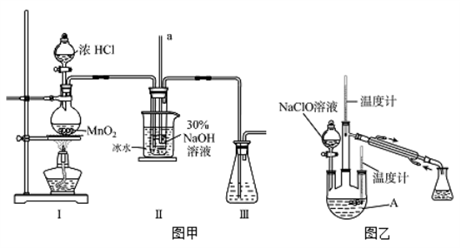 (1)、配制30 %NaOH溶液时,所需玻璃仪器除量筒外还有__________(填字母)。A、容量瓶 B、烧杯 C、移液管 D、玻璃棒(2)、装置I中发生的离子反应方程式是;Ⅱ中玻璃管a的作用为;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的(3)、【制取水合肼】实验装置如上图图乙所示
(1)、配制30 %NaOH溶液时,所需玻璃仪器除量筒外还有__________(填字母)。A、容量瓶 B、烧杯 C、移液管 D、玻璃棒(2)、装置I中发生的离子反应方程式是;Ⅱ中玻璃管a的作用为;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的(3)、【制取水合肼】实验装置如上图图乙所示反应过程中,如果分液漏斗中溶液的滴速过快, 部分N2H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
(4)、称取馏分0.3000 g,加水配成20.0 mL溶液,一定条件下用0.1500 mol·L-1的I2溶液滴定。已知: N2H4·H2O + 2I2 = N2↑+ 4HI + H2O。①滴定时,可以选用的指示剂为;
②实验测得消耗I2溶液的平均值为20. 00 mL,馏分中N2H4·H2O的质量分数为。
三、综合题
-
9. 汽车尾气(主要成分为NOx和CO)已成为主要的空气污染物来源之一,有发生光化学烟雾污染的潜在危险。(1)、某小组同学为研究光化学烟雾的形成进行了模拟实验。测得烟雾的主要成分为CxHy(烃)、NO、NO2、O3、PAN (CH3COOONO2),各种物质的相对浓度随时间的变化如右图。根据图中数据,下列推论最不合理的是。(填选项序号字母)
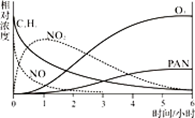
a.NO的消失的速率比CxHy快
b.NO生成NO2
c.CxHy及NO2可以生成PAN及O3
d.O3生成PAN
(2)、一定条件下,将2 mol NO与2 mol O2置于恒容密闭容器中发生反应2NO(g)+O2(g) 2NO2(g),下列可判断反应达平衡的是。(填选项序号字母)a.体系压强保持不变
b.混合气体密度保持不变
c.NO和O2的物质的量之比保持不变
d.每消耗2 mol NO同时生成2 mol NO2
(3)、高温下N2和O2发生N2(g)+O2(g) 2NO(g)反应,是导致汽车尾气中含有NO的原因之一。①下图是T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图像,据此判断反应N2(g)+O2(g) 2NO(g)为(填“吸热”或“放热”)反应。

②2000℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2 , 达到平衡后NO的物质的量为2 mol,则此刻反应的平衡常数K=。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为。
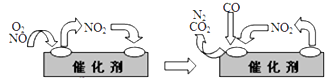
③汽车净化装置里装有含Pd化合物的催化剂,气体在催化剂表面吸附与解吸作用的机理如右图所示。写出其变化的总化学反应方程式:。
(4)、为减少汽车尾气中NOx的排放,常采用CxHy(烃)催化还原NOx消除氮氧化物的污染。例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2
若16 g CH4还原NO2至N2 , 共放出热量867 kJ,则ΔH2=。若用标准状况下4.48 L CH4还原NO2至N2 , 共转移的电子总数为(阿伏加德罗常数的值用NA表示)。
10. 钴酸锂电池应用广泛,电池正极材料主要含有LiCoO2、导电剂乙炔黑、铝箔及少量Fe,可通过下列实验方法回收钴、锂。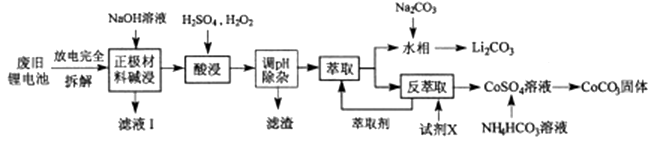
几种金属离子沉淀完全(离子浓度为10-5mo/L) 的pH如下表:
离子
Fe3+
Al3+
Fe2+
Co2+
溶液pH
3.2
4.7
9.0
9.2
回答下列问题:
(1)、LiCoO2中,Co元素的化合价为 , 滤液I的主要成分是。(2)、已知:氧化性Co3+>H2O2>Fe3+ , “酸浸”过程中H2O2所起主要作用是。“调节pH”除去的离子主要有Al3+和。(3)、酸浸时浸出率随温度变化如图所示,温度升高至50℃以上时漫出率下降的原因是。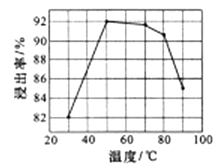 (4)、“萃取”和“反萃取“可简单表示为: Co2++2(HA)2 Co(HA2)2+2H+。则反萃取过程加入的试剂X是。(5)、向CoSO4溶液中加入NH4HCO3溶液,发生反应的离子方程式为。(6)、工业上用Li2CO3粗品制备高纯Li2CO3可采用如下方法:将Li2CO3溶于盐酸,加入如图所示的电解槽,电解后向LiOH溶液中加入稍过量的NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
(4)、“萃取”和“反萃取“可简单表示为: Co2++2(HA)2 Co(HA2)2+2H+。则反萃取过程加入的试剂X是。(5)、向CoSO4溶液中加入NH4HCO3溶液,发生反应的离子方程式为。(6)、工业上用Li2CO3粗品制备高纯Li2CO3可采用如下方法:将Li2CO3溶于盐酸,加入如图所示的电解槽,电解后向LiOH溶液中加入稍过量的NH4HCO3溶液,过滤、烘干得高纯Li2CO3。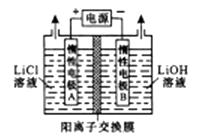
①电解槽中阳极的电极反应式是。
②向LiOH溶液中加入稍过量的NH4HCO3溶液时,发生反应的化学方程式为。
11. [化学一选修5:有机化学基础]聚对苯二甲酸丁二醇酯(PBT)是一种性能优异的热塑性高分子材料。PBT的一种合成路线如图所示:
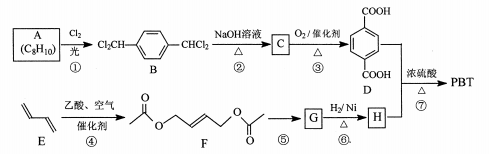
回答下列问题:
(1)、A的结构简式是 , C的化学名称是。(2)、⑤的反应试剂和反应条件分别是。(3)、F的分子式是 , ⑥的反应类型是。(4)、⑦的化学方程式是。(5)、M是H的同分异构体,同时符合_列条件的M可能的结构有种。a.0.1 molM与足量金属钠反应生成氢气2.24 L(标准状况)
b.同一个碳原子上不能连接2个羟基
其中核磁共振氢谱显示3组峰,且峰面积之比为3:1:1的结构简式是。
(6)、以2一甲基-1-3一丁二烯为原料(其它试剂任选),设计制备 的合成路线: 12. [化学选修3:物质结构与性质】
的合成路线: 12. [化学选修3:物质结构与性质】翡翠是玉石中的一种,其主要成分为硅酸铝钠-NaAI(Si2O6),常含微量Cr、Ni、Mn、Mg、Fe等元素。回答下列问题:
(1)、基态Cr原子的电子排布式为;Fe位于元素周期表的 区。(2)、翡翠中主要成分硅酸锚钠表示为氧化物的化学式为 , 其中四种元素第一电离能由小到大的顺序是。(3)、钙和铁部是第四周期元素,且原子的最外层电子数相同,为什么铁的熔沸点远大于钙?。(4)、在硅酸盐中存在 结构单元,其中Si原子的杂化轨道类型为。当无限多个(用n表示) 分别以3个顶角氧和其他3个 形成层状结构时(如图所示),其中Si、O原子的数目之比为。若其中有一半的Si被Al替换,其化学式为。
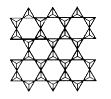 (5)、Cr和Ca可以形成种具有特殊导电性的复合氧化物,晶胞结构如图所示。该晶体的化学式为 , 若Ca与O的核间距离为x nm,则该晶体的密度为 g/cm3。
(5)、Cr和Ca可以形成种具有特殊导电性的复合氧化物,晶胞结构如图所示。该晶体的化学式为 , 若Ca与O的核间距离为x nm,则该晶体的密度为 g/cm3。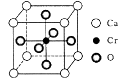
-