宁夏回族自治区吴忠市吴忠中学2018-2019学年高二化学期中考试模拟试卷
试卷更新日期:2018-11-17 类型:期中考试
一、单选题
-
1. 参照反应Br+H2 HBr+H的能量对应反应历程的示意图,下列叙述中正确的是( )
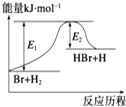 A、该反应的反应热△H=E2﹣E1 B、正反应为吸热反应 C、吸热反应一定要加热后才能发生 D、升高温度可增大正反应速率,降低逆反应速率2. 已知液氨的性质与水相似。T℃时,NH3+NH3 NH4++NH2- , NH4+的平衡浓度为1×10-15mol/L,则下列说法中正确的是( )A、在此温度下液氨的离子积为1×10-17 B、在液氨中放入金属钠,可生成NaNH2 C、恒温下,在液氨中加入NH4Cl,可使液氨的离子积减小 D、降温,可使液氨电离平衡逆向移动,且c(NH4+)<c(NH2-)3. 某温度下向含AgCl固体的AgCl饱和溶液中加少量稀盐酸,下列说法正确的是( )
A、该反应的反应热△H=E2﹣E1 B、正反应为吸热反应 C、吸热反应一定要加热后才能发生 D、升高温度可增大正反应速率,降低逆反应速率2. 已知液氨的性质与水相似。T℃时,NH3+NH3 NH4++NH2- , NH4+的平衡浓度为1×10-15mol/L,则下列说法中正确的是( )A、在此温度下液氨的离子积为1×10-17 B、在液氨中放入金属钠,可生成NaNH2 C、恒温下,在液氨中加入NH4Cl,可使液氨的离子积减小 D、降温,可使液氨电离平衡逆向移动,且c(NH4+)<c(NH2-)3. 某温度下向含AgCl固体的AgCl饱和溶液中加少量稀盐酸,下列说法正确的是( )
A、AgCl的溶解度、Ksp均减小 B、AgCl的溶解度、Ksp均不变 C、AgCl的溶解度减小、Ksp不变 D、AgCl的溶解度不变、Ksp减小4. 已知H2A为二元弱酸,室温下向100.0mL0.1mol/LH2A溶液中加入不同质量的NaOH固体,pH变化如下表(不考虑溶液体积变化)。下列分析正确的是( )m(NaOH)/g
0
0.4
0.8
1.2
pH
3.8
8.3
12.0
13.2
A、H2A第一步电离K1的数量级为10-8 B、上述过程中水的电离程度一直增大 C、m(NaOH)=0.6g时,c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+) D、若溶液中加NaOH至 时,c(OH-)>100c(H+)5. 已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:温度/ ℃
700
800
830
1000
1200
平衡常数
1.7
1.1
1.0
0.6
0.4
830℃时,向一个2 L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4 s内A的平均反应速率v(A)=0.005mol/(L·s)。下列说法正确的是( )
A、4 s时c(B)为0.76mol/L B、830℃达平衡时,A的转化率为80% C、反应达平衡后,升高温度,平衡正向移动 D、1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为0.46. 如图是可逆反应A+2B 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是( )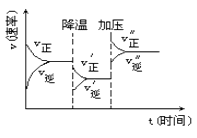 A、正反应是放热反应 B、A,B一定都是气体 C、D一定不是气体 D、C可能是气体7. 下列说法不正确的是( )A、纯碱可用于去除物品表面的油污 B、二氧化碳可用作镁燃烧的灭火剂 C、植物秸秆可用于制造酒精 D、氢氧化铁胶体可用作净水剂8. 氢卤酸的能量关系如图所示:下列说法正确的是( )
A、正反应是放热反应 B、A,B一定都是气体 C、D一定不是气体 D、C可能是气体7. 下列说法不正确的是( )A、纯碱可用于去除物品表面的油污 B、二氧化碳可用作镁燃烧的灭火剂 C、植物秸秆可用于制造酒精 D、氢氧化铁胶体可用作净水剂8. 氢卤酸的能量关系如图所示:下列说法正确的是( )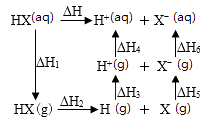 A、已知HF气体溶于水放热,则HF的ΔH1<0 B、相同条件下,HCl的ΔH2比HBr的小 C、相同条件下,HCl的(ΔH3+ΔH4)比HI的大 D、一定条件下,气态原子生成1 mol H-X键放出a kJ能量,则该条件下ΔH2=a kJ·molˉ19. 小苏打溶液水解的离子方程式书写正确的是( )A、HCO3-+H+→H2CO3 B、HCO3-+ H2O H2CO3+ OH- C、CO32-+ H2O HCO3-+ OH- D、HCO3-+ H2O CO32-+ H3O+10. 将下列物质溶于水,能促进水的电离的是( )A、NaHSO4 B、Na2CO3 C、SO2 D、NaOH11. 根据下列实验操作和现象所得出的结论正确的是( )
A、已知HF气体溶于水放热,则HF的ΔH1<0 B、相同条件下,HCl的ΔH2比HBr的小 C、相同条件下,HCl的(ΔH3+ΔH4)比HI的大 D、一定条件下,气态原子生成1 mol H-X键放出a kJ能量,则该条件下ΔH2=a kJ·molˉ19. 小苏打溶液水解的离子方程式书写正确的是( )A、HCO3-+H+→H2CO3 B、HCO3-+ H2O H2CO3+ OH- C、CO32-+ H2O HCO3-+ OH- D、HCO3-+ H2O CO32-+ H3O+10. 将下列物质溶于水,能促进水的电离的是( )A、NaHSO4 B、Na2CO3 C、SO2 D、NaOH11. 根据下列实验操作和现象所得出的结论正确的是( )选项
实验操作和现象
结论
A
向苯酚浊液中滴加Na2CO3溶液,浊液变清
苯酚的酸性强于H2CO3的酸性
B
向碘水中加入等体积CCl4 , 振荡后静置,上层接近无色,下层显紫红色
I2在CCl4中的溶解度大于在水中的溶解度
C
向CuSO4溶液中加入铁粉,有红色固体析出
Fe2+的氧化性强于Cu2+的氧化性
D
向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成
Ksp(AgCl) >Ksp(AgI)
A、A B、B C、C D、D12. 已知某可逆反应:mA(g)+nB(g) r C(g)在密闭容器中进行。下图表示此反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线。由曲线分析下列判断正确的是( )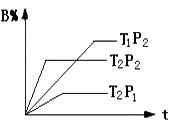 A、T1>T2 , p1>p2 , m+n>r,正反应吸热 B、T1<T2 , p1<p2 , m+n<r,正反应吸热 C、T1>T2 , p1>p2 , m+n<r,正反应放热 D、T1<T2 , p1<p2 , m+n>r,正反应放热13. 在一密闭容器中,当反应aA(g) bB(g)+cC(g)达到平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度为原来的55%,则( )A、平衡向正反应方向移动 B、a>b+c C、物质B的质量分数增大 D、以上判断都错误14. 下列事实可用勒夏特列原理解释的是( )A、使用催化剂有利于加快合成氨反应的反应速率 B、H2、I2(g)、HI平衡混合气体加压后颜色变深 C、500℃左右比在室温时更有利于提高合成氨的转化率 D、配制氯化铁溶液时,将氯化铁固体溶于浓盐酸中,然后加水稀释15. 下列化学反应中,属于吸热反应的是( )A、木炭燃烧反应 B、稀硫酸与烧碱反应 C、生石灰与水反应 D、Ba(OH)2·8H2O与NH4Cl晶体16. 已知: ①C6H12O6(s)=2C2H5OH(l)+2CO2(g) △H1
A、T1>T2 , p1>p2 , m+n>r,正反应吸热 B、T1<T2 , p1<p2 , m+n<r,正反应吸热 C、T1>T2 , p1>p2 , m+n<r,正反应放热 D、T1<T2 , p1<p2 , m+n>r,正反应放热13. 在一密闭容器中,当反应aA(g) bB(g)+cC(g)达到平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度为原来的55%,则( )A、平衡向正反应方向移动 B、a>b+c C、物质B的质量分数增大 D、以上判断都错误14. 下列事实可用勒夏特列原理解释的是( )A、使用催化剂有利于加快合成氨反应的反应速率 B、H2、I2(g)、HI平衡混合气体加压后颜色变深 C、500℃左右比在室温时更有利于提高合成氨的转化率 D、配制氯化铁溶液时,将氯化铁固体溶于浓盐酸中,然后加水稀释15. 下列化学反应中,属于吸热反应的是( )A、木炭燃烧反应 B、稀硫酸与烧碱反应 C、生石灰与水反应 D、Ba(OH)2·8H2O与NH4Cl晶体16. 已知: ①C6H12O6(s)=2C2H5OH(l)+2CO2(g) △H1②6CO2(g)+6H2O(g)=C6H12O6(s)+6O2 △H2
③2H2O(g)=2H2(g)+O2(g) △H3
④2CO2(g)+6H2(g)=C2H5OH(l)+3H2O △H4
下列有关说法正确的是( )
A、H2的燃烧热为 B、反应①使用催化剂,△H1将减小 C、标准状况下,反应②生成1.12LO2 , 转移的电子数为0.1×6.02×1023 D、2△H4=△H1+△H2-6△H317. H2S的分解反应是一个可逆反应,其能量与反应进程的关系如图所示,下列有关说法正确的是( )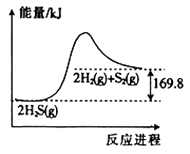 A、正反应的活化能大于逆反应的活化能 B、若减小体系的压强,则该反应的焓变将增大 C、升高温度,化学反应速率加快,H2S的平衡转化率减小 D、向密闭容器中充入1molH2S充分反应,吸收84.9kJ的热量18. 某化学反应的反应物浓度在20 s内由3.0 mol/L变为1.0 mol/L,则以该反应物浓度的变化表示20s内的平均反应速率为( )A、0.05 mol/(L·s) B、0.10 mol/(L·s) C、0.15 mol/(L·s) D、2.0 mol/(L·s)19. 反应A(g) + 3B(g) ⇌2C(g) + 2D(g) 在四种不同情况下的反应速率分别为:① 、 ② 、 ③ 、④ ,该反应进行的快慢顺序为( )A、①>③=②>④ B、①>②=③>④ C、②>①=④>③ D、①>④>②=③20. 通过以下反应均可获取CO。下列有关说法正确的是( )
A、正反应的活化能大于逆反应的活化能 B、若减小体系的压强,则该反应的焓变将增大 C、升高温度,化学反应速率加快,H2S的平衡转化率减小 D、向密闭容器中充入1molH2S充分反应,吸收84.9kJ的热量18. 某化学反应的反应物浓度在20 s内由3.0 mol/L变为1.0 mol/L,则以该反应物浓度的变化表示20s内的平均反应速率为( )A、0.05 mol/(L·s) B、0.10 mol/(L·s) C、0.15 mol/(L·s) D、2.0 mol/(L·s)19. 反应A(g) + 3B(g) ⇌2C(g) + 2D(g) 在四种不同情况下的反应速率分别为:① 、 ② 、 ③ 、④ ,该反应进行的快慢顺序为( )A、①>③=②>④ B、①>②=③>④ C、②>①=④>③ D、①>④>②=③20. 通过以下反应均可获取CO。下列有关说法正确的是( )①木炭不完全燃烧制CO:2C(s)+O2(g)=2CO(g) ΔH1=-221kJ·mol-1
②木炭还原CO2制CO:C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
③焦炭还原Fe2O3制CO:Fe2O3(s) + 3C(s) 2Fe(s) + 3CO(g) ΔH 3=+489.0kJ·mol-1
A、反应①中化学能全部转化为热能 B、反应②为吸热反应,在任何情况下都不能自发进行 C、反应③中使用催化剂或移走部分CO,均可提高Fe2O3的转化率 D、反应Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) ΔH=-28.5 kJ·mol-121. 反应N2(g)+3H2(g) 2NH3(g)ΔH<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( ) A、容器内的温度不再变化 B、容器内的压强不再变化 C、相同时间内,断开H-H键的数目和生成N-H键的数目相等 D、容器内气体的浓度c(N2)∶c(H2)∶c(NH3)=1∶3∶222. 已知:△G=△H-T△S,当△G<0,反应能自发进行,△G>0反应不能自发进行。下列说法中正确的是( )A、非自发反应在任何条件下都不能发生 B、熵增加且放热的反应一定是自发反应 C、自发反应一定是熵增加的反应,非自发反应一定是熵减小或不变的反应 D、凡是放热反应都是能自发进行的反应,而吸热反应都是非自发进行的反应23. 下列说法正确的是( )A、氢氧燃料电池放电时化学能全部转化为电能 B、反应4Fe(s)+3O2(g)=2Fe2O3(s)常温下可自发进行,该反应为吸热反应 C、3 mol H2与1 mol N2混合反应生成NH3 , 转移电子的数目小于6×6.02×1023 D、在酶催化淀粉水解反应中,温度越高淀粉水解速率越快24. 已知C2H2 (g) + O2 (g) → 2CO2 (g) + H2O (g)+1256 kJ,下列说法正确的是( )A、1 份乙炔完全燃烧可放热1256 kJ B、反应中乙炔做还原剂、被还原 C、乙炔完全燃烧时,生成2 mol液态水,所放热量小于2512 kJ D、若有10 mol电子发生转移,则需消耗2.5 mol O225. 已知
2NH3(g)ΔH<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( ) A、容器内的温度不再变化 B、容器内的压强不再变化 C、相同时间内,断开H-H键的数目和生成N-H键的数目相等 D、容器内气体的浓度c(N2)∶c(H2)∶c(NH3)=1∶3∶222. 已知:△G=△H-T△S,当△G<0,反应能自发进行,△G>0反应不能自发进行。下列说法中正确的是( )A、非自发反应在任何条件下都不能发生 B、熵增加且放热的反应一定是自发反应 C、自发反应一定是熵增加的反应,非自发反应一定是熵减小或不变的反应 D、凡是放热反应都是能自发进行的反应,而吸热反应都是非自发进行的反应23. 下列说法正确的是( )A、氢氧燃料电池放电时化学能全部转化为电能 B、反应4Fe(s)+3O2(g)=2Fe2O3(s)常温下可自发进行,该反应为吸热反应 C、3 mol H2与1 mol N2混合反应生成NH3 , 转移电子的数目小于6×6.02×1023 D、在酶催化淀粉水解反应中,温度越高淀粉水解速率越快24. 已知C2H2 (g) + O2 (g) → 2CO2 (g) + H2O (g)+1256 kJ,下列说法正确的是( )A、1 份乙炔完全燃烧可放热1256 kJ B、反应中乙炔做还原剂、被还原 C、乙炔完全燃烧时,生成2 mol液态水,所放热量小于2512 kJ D、若有10 mol电子发生转移,则需消耗2.5 mol O225. 已知H-H
Cl-Cl
H-Cl
键能(kJ/mol)
436
243
431
对于反应H2(g)+Cl2(g)=2HCl(g)的能量变化描述正确的是( )
A、436kJ/mol是指断开1 molH2中的H-H键需要放出436kJ的能量 B、431kJ/mol是指生成2 mol HCl中的H- Cl键需要放出431kJ的能量 C、由键能数据分析,该反应属于吸热反应 D、2mol HCl(g)的能量比1molH2(g)和1molCl2(g)的总能量低二、填空题
-
26. 根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:
N2(g)+3H2O(l)=2NH3(g)+1.5O2(g),△H.
已知:N2(g)+3H2(g)=2NH3(g)△H=a kJ/mol,
2H2(g)+O2(g)=2H2O(l)△H=b kJ/mol,
则N2(g)+3H2O(l)=2NH3(g)+1.5O2(g)的△H=kJ/mol(用含a、b的式子表示).
27. ①用50mL0.50mol/L盐酸与50mL一定浓度的NaOH溶液在如图所示的装置中进行中和反应.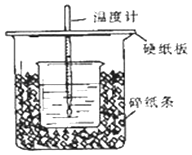
通过测定反应过程中所放出的热量可计算中和热.该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称 , 另一处错误是 .
②实验室提供了0.50mol/L和0.55mol/L两种浓度的NaOH溶液,应该选择mol•L﹣1的溶液进行实验.大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”).
③如果用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液进行上述实验,测得的中和热的数值会;(填“偏大、偏小、无影响”) 如果用60mL0.50mol/L盐酸与50mL0.55mol/L的NaOH溶液所求中和热(填“相等、不相等”).
28. (1)一定温度下,向1L 0.1mol•L﹣1 CH3COOH溶液中加入0.1mol CH3COONa固体,则醋酸的电离平衡向 (填“正”或“逆”)反应方向移动;溶液中的值 (填“增大”、“减小”或“不变”).(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3•H2O.已知:
a.常温下,醋酸和NH3•H2O的电离平衡常数均为1.74×10﹣5;
b.CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O.
则CH3COONH4溶液呈 性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈 性,NH4HCO3溶液中物质的量浓度最大的离子是 (填化学式).
(3)99℃时,Kw=1.0×10﹣12 , 该温度下测得0.1mol•L﹣1 Na2A溶液的pH=6.
①H2A在水溶液中的电离方程式为 .
②该温度下,将0.01mol•L﹣1 H2A溶液稀释到20倍后,溶液的pH= .
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气 .
A.盐酸多 B.H2A多
C.一样多 D.无法确定
④将0.1mol•L﹣1 H2A溶液与0.2mol•L﹣1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为 .
29. 水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.则100℃时1mol•L﹣1的NaOH溶液中,由水电离出的c(H+)=mol•L﹣1 , KW(25℃)KW(100℃)(填“>”、“<”或“=”).25℃时,向水的电离平衡体系中加入少量NH4HCO3固体,对水的电离平衡的影响是(填“促进”、“抑制”或“不影响”).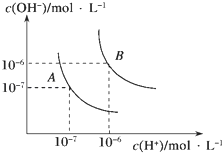 30. 已知某溶液中只存在H+、OH﹣、NH4+、Cl﹣四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
30. 已知某溶液中只存在H+、OH﹣、NH4+、Cl﹣四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:A.c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣)
B.c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+)
C.c(Cl﹣)>c(H+)>c(NH4+)>c(OH﹣)
D.c(NH4+)>c(Cl﹣)>c(OH﹣)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称为 , 上述离子浓度大小顺序关系中正确的是(填序号);
②若上述关系中C是正确的,则溶液中溶质的化学式为;
③若该溶液由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合后溶液中 c(NH4+)c(Cl﹣)(填>、<或=).
31. 在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)⇌2NH3(g)△H<0,其平衡常数K与温度T的关系如表:T/K
298
398
498
平衡常数K
4.1×106
K1
K2
①试判断K1K2(填写“>”,“=”或“<”)
②下列各项能说明该反应已达到平衡状态的是(填字母)
a.单位时间内,消耗1molN2的同时生成2mol NH3 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变.
32. 已知KMnO4、MnO2在酸性条件下均能将草酸 (H2C2O4)氧化:( i)MnO4﹣+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)
( ii)MnO2+H2C2O4+2H+=Mn2++2CO2↑+2H2O
某研究小组为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品,加入1.80g草酸,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液转移到容量瓶中并定容;从中取出25.00mL待测液置于锥形瓶中,再用0.020mol•L﹣1KMnO4标准溶液进行滴定,当滴入20.00mLKMnO4溶液时恰好完全反应.试回答下列问题:
①方程式( i)配平后H2C2O4的计量系数为 .
②0.020mol•L﹣1KMnO4标准溶液应置于(填“甲”或“乙”)滴定管中;滴定终点的颜色变化是 .
③你能否帮助该研究小组求得软锰矿中MnO2的质量分数;若“能”,请给出计算结果;若“否”,试说明原因.“能”的计算结果或“否”的原因说明 .
④若在实验过程中存在下列操作,其中会使所测MnO2的质量分数偏小的是 .
A.滴定前尖嘴部分有一气泡,滴定终点时消失
B.溶液转移至容量瓶中,未将烧杯、玻棒洗涤
C.滴定前仰视读数,滴定后俯视读数
D.定容时,俯视刻度线
E.锥形瓶水洗之后未用待测液润洗.