浙江省温州市“十五校联合体”2018-2019学年高一上学期化学期中考试试卷
试卷更新日期:2018-11-15 类型:期中考试
一、选择题
-
1. 下列属于酸式盐的是( )A、NH4Cl B、NaHCO3 C、H2O2 D、NaH2. 下列变化是氧化还原反应的是( )A、NH4HCO3 NH3↑+H2O+CO2↑ B、2FeSO4 Fe2O3+SO2↑+SO3↑ C、2O3 3O2 D、CaO+CO2 = CaCO33. 下列说法不正确的是( )A、物质的量是研究物质所含微粒集体的多少,单位为mol B、物质的量把微观粒子数目与宏观物质的质量联系起来 C、1mol NaCl 晶体中含有NA个NaCl分子 D、0.012kg C-12中所含的原子数为阿伏加德常数,NA近似为6.02x1023mol-14. 已知a g CH4中含有b个H原子,则NA为( )A、4b/a B、 b/a C、16b/a D、a/4b5. 下列说法正确的是( )A、1mol 固体或液体的体积主要由微粒间距离决定 B、1mol气体的体积主要由微粒的大小决定 C、O2的气体摩尔体积约为22.4L·mol-1 D、气体微粒间的距离受温度压强影响大,固体或液态微粒间的距离受温度压强影响小6. 下列关于胶体的描述不正确的是( )A、胶体分散质粒子直径在1-100nm之间 B、胶体具有丁达尔现象 C、Fe(OH)3胶体具有净水作用 D、胶体是不透明,但均一,相对稳定的分散系7. 下列说法正确的是( )A、HCl溶于水后形成水合氢离子和水合氯离子 B、HCl溶于水或融熔状态下均能导电 C、盐酸是电解质,酒精为非电解质 D、盐酸属于无氧酸,H2SO4属于含氧酸8. 下列电离方程式正确的是( )A、CaCl2=Ca2++Cl2- B、CH3CH2OH(乙醇)=CH3CH2O- +H+ C、NaHSO4=Na++H++SO42- D、KMnO4=K++Mn2++4O2-9. 下列关于物质分离提纯的描述不正确的是( )A、物质分离或提纯方法的选择依据是混合物的状态和性质 B、KCl和MnO2混合物分离步骤为:溶于水、过滤、洗涤、干燥、蒸发、结晶 C、从碘水中萃取I2 , 可选择用苯、乙醇、四氯化碳作萃取剂 D、NaCl中混有少量KNO3杂质,分离步骤为溶于水、蒸发结晶、趁热过滤、洗涤、干燥10. 下列实验操作正确的是( )A、用蒸发皿蒸发溶液时,应垫石棉网 B、使用分液漏斗前无需检漏 C、萃取时,分液漏斗倒转,不断振荡,并及时放气 D、分液时,上层液体等下层液放出后,再继续放出11. 下列仪器可用于物质的分离提纯的是( )
①蒸发皿 ②漏斗 ③分液漏斗 ④表面皿 ⑤研钵
⑥蒸馏烧瓶 ⑦托盘天平 ⑧洗气瓶
A、②③④⑥⑧ B、①②③⑥⑧ C、①③⑥⑧ D、③⑤⑥⑦⑧12. 下列说法不正确的是( )A、焰色反应体现了元素的物理性质 B、用盐酸酸化的BaCl2溶液检验待测溶液中是否存在SO42- C、有色玻璃是某些胶态金属氧化物分散到玻璃中制成 D、用原子吸收光谱确定物质中含有哪些金属元素13. 下列说法正确的是( )A、物质的量浓度是指单位体积溶剂中所含溶质的物质的量 B、容量瓶不能作反应的容器,但可以储存配好的溶液 C、容量瓶使用前要检漏,方法是加入一定量水倒转过来不漏即可 D、定容时,往容量瓶中注入蒸馏水,直到液面接近容量瓶的刻度线1—2厘米处时,改用胶头滴管滴加,直到溶液凹液面正好与刻度线相切14. 下列说法不正确的是( )A、原子结构模型的演变为:希腊哲学家提出原子概念→ 道尔顿原子学说 → 汤姆生葡萄干面包式 → 卢瑟福带核原子模型 → 玻尔电子轨道理论 → 量子力学 B、人类对原子结构的认识过程,启示了微观结构也要通过实验验证,同时要付出很大心血 C、在原子结构分层排布中,M层(第三层)容纳电子数最多为18,最少为8 D、在化学反应过程中,原子核不发生变化,但原子外层电子可能发生变化15. 下列说法不正确的是( )A、质量数是将原子核内所有的质子和中子的相对质量取整数值之和 B、 表示一种X元素的一种原子,中子数为A-Z C、 中,A为该原子的相对原子质量的近似值 D、原子都是质子和中子、电子组成,原子不带电16. 若612C原子的质量为a g,A原子的质量为b g,NA为阿伏加德罗常数,则A元素的相对原子质量为( )
A、12 a/b B、12 b/a C、aNA D、不能确定17. 下列说法不正确的是( )
A、14C的放射性可用于考古判断年代 B、1H2、2H2、3H2互为同位素 C、1mol T2O中含中子数为12NA D、氢有三种同位素,氧有三种同位素,组成的水分子有18种18. 下列说法不正确的是( )A、 I- 遇淀粉变蓝色,I2易升华 B、常温下单质溴为深红棕色液体,溴元素被称为海洋元素 C、海水制溴,溶于水的溴可鼓入热空气或水蒸气吹出来 D、AgBr是重要的感光材料,AgI 可用于人工降雨19. 电解饱和食盐水,2NaCl+2H2O H2↑+Cl2↑+2NaOH 生成4mol 的NaOH,(a为饱和食盐水),下列说法正确的是( )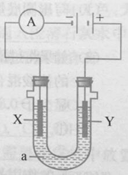 A、在X极生成2mol Cl2 B、在X极生成2molH2 C、在Y极生成4mol Cl2 D、NaOH在Y极生成20. 下列说法不正确的是( )A、新制氯水具有漂白性,与活性炭的漂白原理相同 B、HClO是一种弱酸,酸性比碳酸弱 C、HClO见光、加热易分解,放出O2 D、新制氯水存在Cl2、HClO、H2O分子,H+、Cl-、ClO-、OH- 离子21. 在相同温度和压强下,容器A中的臭氧(O3)和容器B中的乙炔气(C2H2)所含的分子个数相同,则A、B两容器中气体的体积之比是( )A、4:3 B、3:4 C、1:1 D、2:322. 氯化钠中含有少量硫酸镁、氯化钙和泥沙等杂质,需进行下列项操作:①加水溶解 ② 加入过量的氯化钡溶液 ③加热蒸发得到晶体 ④加入过量碳酸钠和氢氧化钠 ⑤ 加入适量的盐酸⑥过滤 下列操作顺序正确的是( )A、①②④③⑥⑤ B、①②④⑥⑤③ C、①④⑤⑥③② D、①④②⑤⑥③23. 判断下列有关化学基本概念的依据不正确的是( )A、氧化还原反应:元素化合价前后是否有变化 B、溶液与胶体:不同的本质是分散质粒子的直径 C、电解质与非电解质:化合物本身是否能导电 D、纯净物与混合物:是否仅含有一种物质24. NA为阿伏加德罗常数,下列叙述正确的是( )A、标准状况下,4.48L乙醇含分子为0.2NA B、13g C-13含有的碳原子数为NA C、32g O3所含有的电子数为16NA D、2.4g Mg与足量盐酸反应转移电子数0.1NA25. 由四种金属Zn、Fe、Mg、Al组成的混合物10g,与足量的盐酸反应产生的H2 , 在标准状况下的体积为11.2L,则混和物中一定存在的金属是( )A、Zn B、Fe C、Mg D、Al
A、在X极生成2mol Cl2 B、在X极生成2molH2 C、在Y极生成4mol Cl2 D、NaOH在Y极生成20. 下列说法不正确的是( )A、新制氯水具有漂白性,与活性炭的漂白原理相同 B、HClO是一种弱酸,酸性比碳酸弱 C、HClO见光、加热易分解,放出O2 D、新制氯水存在Cl2、HClO、H2O分子,H+、Cl-、ClO-、OH- 离子21. 在相同温度和压强下,容器A中的臭氧(O3)和容器B中的乙炔气(C2H2)所含的分子个数相同,则A、B两容器中气体的体积之比是( )A、4:3 B、3:4 C、1:1 D、2:322. 氯化钠中含有少量硫酸镁、氯化钙和泥沙等杂质,需进行下列项操作:①加水溶解 ② 加入过量的氯化钡溶液 ③加热蒸发得到晶体 ④加入过量碳酸钠和氢氧化钠 ⑤ 加入适量的盐酸⑥过滤 下列操作顺序正确的是( )A、①②④③⑥⑤ B、①②④⑥⑤③ C、①④⑤⑥③② D、①④②⑤⑥③23. 判断下列有关化学基本概念的依据不正确的是( )A、氧化还原反应:元素化合价前后是否有变化 B、溶液与胶体:不同的本质是分散质粒子的直径 C、电解质与非电解质:化合物本身是否能导电 D、纯净物与混合物:是否仅含有一种物质24. NA为阿伏加德罗常数,下列叙述正确的是( )A、标准状况下,4.48L乙醇含分子为0.2NA B、13g C-13含有的碳原子数为NA C、32g O3所含有的电子数为16NA D、2.4g Mg与足量盐酸反应转移电子数0.1NA25. 由四种金属Zn、Fe、Mg、Al组成的混合物10g,与足量的盐酸反应产生的H2 , 在标准状况下的体积为11.2L,则混和物中一定存在的金属是( )A、Zn B、Fe C、Mg D、Al二、填空题
-
26.(1)、下列物质中含原子数最多的是(填序号,下同)
①9g H2O ②3.01×1023个CH4分子 ③0.3mol NH3④11.2L CO2(标况)
(2)、下列物质中属于电解质的是①盐酸 ② Fe ③ 熔融NaCl ④ 蔗糖 ⑤KNO3晶体 ⑥Na2SO4溶液
(3)、除去KNO3固体中少量的KCl,选择正确的操作并排序①过滤 ②萃取 ③固体溶于水 ④冷却结晶 ⑤蒸发浓缩
⑥干燥 ⑦洗涤 ⑧分液
27. 固体粉末可能含有:NH4Cl、K2CO3、Ba(NO3)2、CuCl2、Na2SO4、Na2CO3中的一种或几种,实验如下:① 将固体粉末溶于水,得无色溶液和白色沉淀
② 将①得到的溶液加入AgNO3溶液产生白色沉淀
③ 将①得到的溶液加入浓NaOH溶液并加热,产生刺激性的气体遇湿润的红色石蕊试纸变蓝
④ 将①滤出的白色沉淀加入稀盐酸,沉淀部分溶解,并产生气体,则:
(1)、关于Na2CO3、K2CO3的存在说法正确的是( )A. 两者一定存在 B. 两者可能都不存在 C. 两者可能同时存在
D. 若无K2CO3 , 必然存在Na2CO3;若有K2CO3 , 不能确定Na2CO3的存在
(2)、检验是否存在K2CO3的具体操作是28. 为配制480mL0.1mol.L-1 Na2SO4溶液回答下列问题(1)、应用托盘天平称取十水硫酸钠(Na2SO4·10H2O)晶体 g。(2)、配制Na2SO4溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、、。(3)、实验时遇下列情况,溶液的浓度偏低的是A.溶解后没有冷却便进行定容 B.忘记将洗涤液转入容量瓶
C.容量瓶内壁附有水珠而未干燥处理 D.称量的硫酸钠晶体部分失水
E.加水定容时越过刻度线 F.俯视刻度线定容
29. 用海带制备单质碘,制备过程如下:
已知:常温下,碘在水中的溶解度为0.034g;碘的沸点为184℃;CCl4的沸点为77℃。
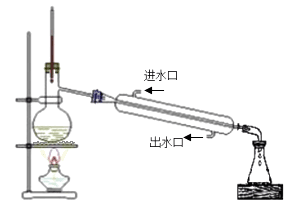
请回答:
(1)、A物质是(2)、写出在酸化下用H2O2氧化NaI的化学反应方程式(3)、流程中省略部分的操作是(4)、蒸馏装置中错误的是(写三条)
(5)、蒸馏出的CCl4液体中常会带淡紫色,可能的原因是30. 实验室制备Cl2和新制的氯水,如图所示: (1)、装置中若无盛饱和食盐水的洗气瓶,将导致(2)、要证明Cl2与水反应是可逆反应,则证明Cl2水存在Cl2分子的现象是 ,
(1)、装置中若无盛饱和食盐水的洗气瓶,将导致(2)、要证明Cl2与水反应是可逆反应,则证明Cl2水存在Cl2分子的现象是 ,证明同时存在HCl和HClO的实验操作是
(3)、吸收Cl2尾气的化学反应方程式为(4)、用KClO3代替MnO2 , 不需加热就可以快速制得Cl2 , 该反应化学方程式为(5)、有一种含氯氧化物,含氧量18.4%,与水反应,生成HClO,该氧化物的化学式是它属于
A. 酸性氧化物 B. 碱性氧化物 C. 酸酐 D.氯化物
(6)、新制氯水中加入少量Na2CO3溶液有气体产生,该反应的化学方程式为三、计算(不考虑有效数字)