江苏省七校联盟2018-2019学年高二上学期化学期中考试试卷
试卷更新日期:2018-11-15 类型:期中考试
一、单项选择题
-
1. “保护环境”是我国的基本国策。下列做法不应该提倡的是 ( )A、采取低碳、节俭的生活方式 B、按照规定对生活废弃物进行分类放置 C、深入农村和社区宣传环保知识 D、经常用一次性筷子、纸杯、塑料袋等2. 酚酞是一种常用的酸碱指示剂,其结构简式如右图所示,酚酞属于( )
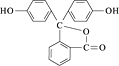 A、氧化物 B、碱 C、有机物 D、无机物3. 成语言简意赅,是中华民族智慧的结晶。下列成语描绘的变化属于化学变化的是( )A、滴水成冰 B、木已成舟 C、烛炬成灰 D、沙里淘金4. 最近我国“人造太阳”研究获重大进展。核聚变中下列质子数小于中子数的原子是 ( )A、 H B、 H C、 He D、 H5. 既可用排水法又可用向上排空气法收集的气体是( )A、NO B、O2 C、NH3 D、NO26. 下列化学用语正确的是( )A、乙烯分子的结构简式:CH2CH2 B、硫原子的结构示意图:
A、氧化物 B、碱 C、有机物 D、无机物3. 成语言简意赅,是中华民族智慧的结晶。下列成语描绘的变化属于化学变化的是( )A、滴水成冰 B、木已成舟 C、烛炬成灰 D、沙里淘金4. 最近我国“人造太阳”研究获重大进展。核聚变中下列质子数小于中子数的原子是 ( )A、 H B、 H C、 He D、 H5. 既可用排水法又可用向上排空气法收集的气体是( )A、NO B、O2 C、NH3 D、NO26. 下列化学用语正确的是( )A、乙烯分子的结构简式:CH2CH2 B、硫原子的结构示意图: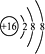 C、淀粉的化学式(C6H10O5)n
D、硫酸铁的电离方程式Fe2(SO4)3=Fe23++3SO42-
7. 目前国际空间站处理CO2废气涉及的反应为CO2+4H2
C、淀粉的化学式(C6H10O5)n
D、硫酸铁的电离方程式Fe2(SO4)3=Fe23++3SO42-
7. 目前国际空间站处理CO2废气涉及的反应为CO2+4H2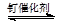 CH4+2H2O。该反应的下列说法正确的是( ) A、钌催化剂能加快该反应的速率 B、升高温度能减慢该反应的速率 C、达到平衡时,CO2能100%转化为CH4 D、达到平衡时,反应速率:v(正) = v(逆) = 08. 下列物质中,既含有离子键又含有共价键的是( )A、N2 B、HCl C、MgCl2 D、Na2O29. 下列常见物质的俗名与化学式对应正确的是( )A、烧碱——NaOH B、小苏打——Na2SO4 C、熟石灰——CaCl2 D、明矾——Al2(SO4)310. 某溶液中存在大量的OH-、K+、CO32- , 该溶液中还可能大量存在的是( )A、NH4+ B、Ca2+ C、HCO3- D、SO42-11. 反应TiCl4+4Na Ti+4NaCl可用于制取金属钛,该反应属于( )A、复分解反应 B、化合反应 C、置换反应 D、分解反应12. 下列有关实验操作或现象描述正确的是( )
CH4+2H2O。该反应的下列说法正确的是( ) A、钌催化剂能加快该反应的速率 B、升高温度能减慢该反应的速率 C、达到平衡时,CO2能100%转化为CH4 D、达到平衡时,反应速率:v(正) = v(逆) = 08. 下列物质中,既含有离子键又含有共价键的是( )A、N2 B、HCl C、MgCl2 D、Na2O29. 下列常见物质的俗名与化学式对应正确的是( )A、烧碱——NaOH B、小苏打——Na2SO4 C、熟石灰——CaCl2 D、明矾——Al2(SO4)310. 某溶液中存在大量的OH-、K+、CO32- , 该溶液中还可能大量存在的是( )A、NH4+ B、Ca2+ C、HCO3- D、SO42-11. 反应TiCl4+4Na Ti+4NaCl可用于制取金属钛,该反应属于( )A、复分解反应 B、化合反应 C、置换反应 D、分解反应12. 下列有关实验操作或现象描述正确的是( )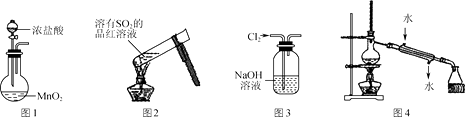 A、实验室用图1装置制备Cl2 B、加热后图2中溶液颜色恢复红色 C、用图3装置除去Cl2中含有的少量HCl D、实验室用图4装置制取少量蒸馏水13. 下列反应属于吸热反应的是( )A、Mg+Cl2 MgCl2 B、Fe+2HCl=FeCl2+H2↑ C、C+H2O(g) CO+H2 D、CaO+H2O=Ca(OH)214. 下列关于乙酸的说法正确的是( )A、常温下是一种无色无味的液体 B、能与乙醇发生酯化反应 C、不能与NaHCO3反应放出CO2 D、能与溴水发生加成反应15. 国产航母001A等舰艇的船底都涂有含Cu2O的防污涂料,制备Cu2O的一种方法为:Zn +2CuSO4+2NaOH = Cu2O+ZnSO4+Na2SO4+H2O。该反应的下列说法正确的是( )
A、实验室用图1装置制备Cl2 B、加热后图2中溶液颜色恢复红色 C、用图3装置除去Cl2中含有的少量HCl D、实验室用图4装置制取少量蒸馏水13. 下列反应属于吸热反应的是( )A、Mg+Cl2 MgCl2 B、Fe+2HCl=FeCl2+H2↑ C、C+H2O(g) CO+H2 D、CaO+H2O=Ca(OH)214. 下列关于乙酸的说法正确的是( )A、常温下是一种无色无味的液体 B、能与乙醇发生酯化反应 C、不能与NaHCO3反应放出CO2 D、能与溴水发生加成反应15. 国产航母001A等舰艇的船底都涂有含Cu2O的防污涂料,制备Cu2O的一种方法为:Zn +2CuSO4+2NaOH = Cu2O+ZnSO4+Na2SO4+H2O。该反应的下列说法正确的是( ) A、Zn得到电子 B、CuSO4被氧化 C、NaOH是还原剂 D、CuSO4是氧化剂16. 用NA表示阿伏加德罗常数的值。下列判断正确的是( )A、46 g NO2含有氧原子数为2NA B、常温常压下,22.4 L N2含有的分子数为NA C、1 L 1 mol·L-1 Al2(SO4)3溶液中含SO42-数目为NA D、1 mol Fe在足量Cl2中燃烧,转移电子数为2NA17. 下列反应的离子方程式书写正确的是( )A、锌与CH3COOH溶液反应:Zn + 2H+ = Zn2++ H2↑ B、氢氧化铝与稀硝酸反应:H+ + OH- = H2O C、CuCl2溶液与铁粉反应:3Cu2+ + 2Fe =3Cu + 2Fe3+ D、MgCl2溶液与氨水反应:Mg2+ + 2NH3·H2O = Mg(OH)2↓+2NH18. 下列鉴别物质的方法能达到目的的是 ( )A、用加热灼烧的方法鉴别铁粉和炭粉 B、用酚酞溶液鉴别未知浓度的NaOH溶液和Na2CO3溶液 C、用丁达尔效应鉴别FeCl2溶液和FeCl3溶液 D、用氨水鉴别MgSO4溶液和Al2(SO4)3溶液19. 下列有关物质用途的说法错误的是( )A、氧化铝是一种耐火材料,可制耐高温实验材料 B、氧化铁可用作红色油漆和涂料 C、二氧化硫可以用来加工食品,使食品增白 D、氨气常用作制冷剂20. 将少量固体分别投入到盛少量水的烧杯中,再滴入酚酞,溶液不会变为红色的是( )A、Na B、Na2O C、Na2CO3 D、NaCl21. 下列化学方程式书写正确的是( )A、
A、Zn得到电子 B、CuSO4被氧化 C、NaOH是还原剂 D、CuSO4是氧化剂16. 用NA表示阿伏加德罗常数的值。下列判断正确的是( )A、46 g NO2含有氧原子数为2NA B、常温常压下,22.4 L N2含有的分子数为NA C、1 L 1 mol·L-1 Al2(SO4)3溶液中含SO42-数目为NA D、1 mol Fe在足量Cl2中燃烧,转移电子数为2NA17. 下列反应的离子方程式书写正确的是( )A、锌与CH3COOH溶液反应:Zn + 2H+ = Zn2++ H2↑ B、氢氧化铝与稀硝酸反应:H+ + OH- = H2O C、CuCl2溶液与铁粉反应:3Cu2+ + 2Fe =3Cu + 2Fe3+ D、MgCl2溶液与氨水反应:Mg2+ + 2NH3·H2O = Mg(OH)2↓+2NH18. 下列鉴别物质的方法能达到目的的是 ( )A、用加热灼烧的方法鉴别铁粉和炭粉 B、用酚酞溶液鉴别未知浓度的NaOH溶液和Na2CO3溶液 C、用丁达尔效应鉴别FeCl2溶液和FeCl3溶液 D、用氨水鉴别MgSO4溶液和Al2(SO4)3溶液19. 下列有关物质用途的说法错误的是( )A、氧化铝是一种耐火材料,可制耐高温实验材料 B、氧化铁可用作红色油漆和涂料 C、二氧化硫可以用来加工食品,使食品增白 D、氨气常用作制冷剂20. 将少量固体分别投入到盛少量水的烧杯中,再滴入酚酞,溶液不会变为红色的是( )A、Na B、Na2O C、Na2CO3 D、NaCl21. 下列化学方程式书写正确的是( )A、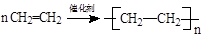 B、CH2=CH2 + Br2
B、CH2=CH2 + Br2 CH3CHBr2
C、
CH3CHBr2
C、 D、
D、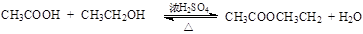 22. 短周期主族元素A、B、C、D、E的原子序数依次增大,其中A与C同主族,A与其它元素不在同一周期,B与D同主族,常温下D的单质为淡黄色固体。下列推断中正确的是( )
22. 短周期主族元素A、B、C、D、E的原子序数依次增大,其中A与C同主族,A与其它元素不在同一周期,B与D同主族,常温下D的单质为淡黄色固体。下列推断中正确的是( )
A、原子半径由小到大的顺序:r(C)<r(D)<r(E) B、元素D,E分别与A形成的化合物的热稳定性:E>D C、元素D的最高价氧化物对应水化物的酸性比E的强 D、元素B分别与A,C形成的化合物中化学键的类型完全相同23. 将一定量的由Cu和Cu2O组成的混合粉末加入到125mL2.6mol·L-1的硝酸中,固体恰好完全溶解,得蓝色溶液X并收集到VmL(标准状况)的纯净无色气体Y。下列结论正确的是
A、X中有两种溶质 B、Y通入纯水中得到酸性溶液 C、原混合粉末的总质量小于7.8g D、当V=1680时,原混合粉末中Cu和Cu2O的物质的量之比为8∶1二、非选择题
-
24. A.《化学与生活》(1)、材料是人类赖以生存和发展的重要物质基础。
①水泥是最常用的建筑材料,它属于(填字母)。
a. 金属材料 b. 无机非金属材料 c. 有机高分子材料
②下列硅酸盐产品的生产原料中不需要石灰石的是(填字母)。
a. 陶瓷 b. 水泥 c. 玻璃
③高岭土是烧制瓷器的重要原料,其组成可以表示为Al2Si2Ox(OH)y , 其中x , y的数值分别是(填字母)。
a. 5、4 b. 6、3 c. 7、2
④下列物品的构成材料中主要是合成高分子材料的是(填字母)。
a. 宣纸 b. 羊毛衫 c. 保鲜膜
⑤橡胶是制造轮胎的主要原料,天然橡胶是结构(填“线型”或“体型”),需经过硫化处理改变其结构,增强其机械强度。
(2)、某品牌果冻标签如图所示。回答下列问题:
①食品添加剂中,属于无机盐的是(填化学式)。
②属于着色剂的是诱惑红和;属于防腐剂的是。
③配料表中白砂糖的成分是蔗糖,请写出蔗糖在人体内水解的化学方程式。
(3)、化学与科学技术、生产生活及环境保护等密切相关。①2016年12月我省启动了保卫碧水蓝天的“263”行动,减少煤炭消费总量,减少雾霾天气的发生。形成硫酸型酸雨的主要气体是;严格整治畜禽养殖场污染 , 主要是为减少和P等元素及化学需氧量对水体的污染。
②目前正在推广用尿素水解液来消除柴油汽车尾气中的氮氧化物。写出尿素水解液中的NH3与NO在催化剂作用下,反应生成无污染物质的化学方程式。
③阿司匹林作为一种药物,主要具有作用;Mg2Si3O8·nH2O(三硅酸镁)具有治疗胃酸过多的作用,写出其与胃酸反应生成SiO2 ·H2O等物质的化学方程式。
25. 有关物质的转化关系如下图所示(部分物质和条件已略去)。A是由两种元素组成的难溶于水的物质,摩尔质量为88 g·mol-1;B是常见的强酸;C是一种气态氢化物;气体E能使带火星的木条复燃;F是最常见的无色液体;无色气体G能使品红溶液褪色;向含有I的溶液中滴加KSCN试剂,溶液出现血红色。请回答下列问题: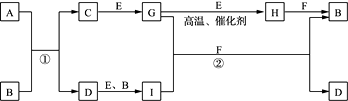 (1)、G的化学式为。(2)、C的电子式为。(3)、写出反应①的离子方程式:。(4)、写出反应②的化学方程式:。26. KIO3是一种无色易溶于水的晶体,医药上可作防治地方甲状腺肿的药剂,目前碘酸钾被广泛应用于食盐加碘。一种由含碘废水制取碘酸钾的工艺如下:
(1)、G的化学式为。(2)、C的电子式为。(3)、写出反应①的离子方程式:。(4)、写出反应②的化学方程式:。26. KIO3是一种无色易溶于水的晶体,医药上可作防治地方甲状腺肿的药剂,目前碘酸钾被广泛应用于食盐加碘。一种由含碘废水制取碘酸钾的工艺如下: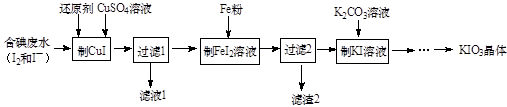 (1)、检验“含碘废水”中含有的单质I2 , 常用的试剂是。(2)、进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤过滤滤液中可通过滴加盐溶液来检验其是否已洗涤干净。(3)、“滤渣2”的成分为(填化学式)。(4)、“制KI”时,发生反应的化学方程式为。(5)、江苏食用加碘盐新标准是每千克食盐中碘元素含量为25毫克(波动范围为18~33mg/kg)。测定食盐试样中碘元素含量的步骤如下:称取4.000g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00mL6.000×10-4mol·L-1Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:
(1)、检验“含碘废水”中含有的单质I2 , 常用的试剂是。(2)、进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤过滤滤液中可通过滴加盐溶液来检验其是否已洗涤干净。(3)、“滤渣2”的成分为(填化学式)。(4)、“制KI”时,发生反应的化学方程式为。(5)、江苏食用加碘盐新标准是每千克食盐中碘元素含量为25毫克(波动范围为18~33mg/kg)。测定食盐试样中碘元素含量的步骤如下:称取4.000g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00mL6.000×10-4mol·L-1Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O =2I- +S4O 。
①计算该食盐试样中碘元素的含量(单位mg/kg,写出计算过程)。
②该食盐试样是否符合江苏食用加碘盐新标准,并说明判断依据。