北京市东城区2017-2018学年高三上学期化学期末考试试卷
试卷更新日期:2018-11-13 类型:期末考试
一、单选题
-
1. 中华民族的发明创造为人类文明进步做出了巨大贡献,下列没有涉及化学反应的是( )A、
 神十一载人飞船发射
B、
神十一载人飞船发射
B、 陶器烧制
C、
陶器烧制
C、 湿法炼铜
D、
湿法炼铜
D、 打磨磁石制司南
2. 下列表述合理的是( )A、苯与乙炔的实验式均是C2H 2 B、H2O2的电子式是
打磨磁石制司南
2. 下列表述合理的是( )A、苯与乙炔的实验式均是C2H 2 B、H2O2的电子式是 C、溴乙烷的比例模型是
C、溴乙烷的比例模型是  D、NH3﹒H2O的电离方程式是NH3﹒H2O= +
3. 是一种放射性核素,可治疗多种皮肤病。下列有关该核素说法正确的是( )A、 的摩尔质量是32 B、 和 互称为同位素 C、1mol 含质子数约为32×6.02×1023 D、由质量数可以判断其在周期表的位置4. 下列说法错误的是( )A、蛋白质是生命的基础,是人类必需的营养物质 B、维生素C又称抗坏血酸,新鲜蔬菜中富含维生素C C、阿司匹林是常用的解热镇痛药,可以长期大量服用 D、葡萄糖是自然界中分布最广的单糖,在人体中发生氧化反应,放出能量5. 药物利喘贝(结构如下)主要用于荨麻疹、皮肤瘙痒等病症的治疗,下列关于该有机物的说法错误的是( )
D、NH3﹒H2O的电离方程式是NH3﹒H2O= +
3. 是一种放射性核素,可治疗多种皮肤病。下列有关该核素说法正确的是( )A、 的摩尔质量是32 B、 和 互称为同位素 C、1mol 含质子数约为32×6.02×1023 D、由质量数可以判断其在周期表的位置4. 下列说法错误的是( )A、蛋白质是生命的基础,是人类必需的营养物质 B、维生素C又称抗坏血酸,新鲜蔬菜中富含维生素C C、阿司匹林是常用的解热镇痛药,可以长期大量服用 D、葡萄糖是自然界中分布最广的单糖,在人体中发生氧化反应,放出能量5. 药物利喘贝(结构如下)主要用于荨麻疹、皮肤瘙痒等病症的治疗,下列关于该有机物的说法错误的是( ) A、分子式是C18H17O5N B、一定存在顺反异构体 C、一定能发生聚合反应 D、一定能发生银镜反应6. 下列说法正确的是( )A、Si、P、S、Cl原子半径依次增大 B、HF、HCl、HBr、HI稳定性依次减弱 C、C、N、O、F 元素的最高正化合价依次升高 D、NaOH、Mg(OH)2、Al(OH)3碱性依次增强7. 下列事实对应的离子方程式错误的是( )A、用碳酸钠溶液处理锅炉中的硫酸钙水垢:CaSO4(s)+ (aq) CaCO3(s)+ (aq) B、用加热的方法降低自来水中钙离子浓度:Ca2++2H CaCO3 ↓+H2O+CO2↑ C、用醋酸清洗热水壶中的碳酸钙水垢:2H++CaCO3= Ca2++H2O+CO2↑ D、用肥皂(主要成分C17H35COONa)检验含有较多钙离子的硬水:2C17H35COO-+Ca2+ = (C17H35COO)2Ca↓8. 下列实验装置正确且能达到实验目的的是( )
A、分子式是C18H17O5N B、一定存在顺反异构体 C、一定能发生聚合反应 D、一定能发生银镜反应6. 下列说法正确的是( )A、Si、P、S、Cl原子半径依次增大 B、HF、HCl、HBr、HI稳定性依次减弱 C、C、N、O、F 元素的最高正化合价依次升高 D、NaOH、Mg(OH)2、Al(OH)3碱性依次增强7. 下列事实对应的离子方程式错误的是( )A、用碳酸钠溶液处理锅炉中的硫酸钙水垢:CaSO4(s)+ (aq) CaCO3(s)+ (aq) B、用加热的方法降低自来水中钙离子浓度:Ca2++2H CaCO3 ↓+H2O+CO2↑ C、用醋酸清洗热水壶中的碳酸钙水垢:2H++CaCO3= Ca2++H2O+CO2↑ D、用肥皂(主要成分C17H35COONa)检验含有较多钙离子的硬水:2C17H35COO-+Ca2+ = (C17H35COO)2Ca↓8. 下列实验装置正确且能达到实验目的的是( )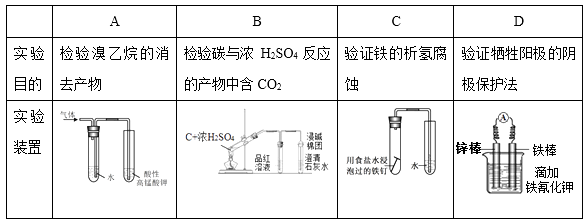 A、A B、B C、C D、D9. 醌类化合物广泛存在于植物中,有抑菌、杀菌作用,可由酚类物质制备:
A、A B、B C、C D、D9. 醌类化合物广泛存在于植物中,有抑菌、杀菌作用,可由酚类物质制备:
下列说法错误的是( )
A、反应Ⅰ、Ⅱ均为氧化反应 B、对苯醌、萘醌均属于芳香化合物 C、苯酚与萘酚含有相同官能团,但不互为同系物 D、 属于酚类,
属于酚类,  属于醌类
10. 常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是( )
属于醌类
10. 常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是( ) A、a点的pH=1 B、b点时,c (CH3COO—)=0.05mol/L C、c点时,V(NaOH)=20mL D、反应过程中, 的值不断增大11. 由下列实验及现象不能得出相应结论的是( )
A、a点的pH=1 B、b点时,c (CH3COO—)=0.05mol/L C、c点时,V(NaOH)=20mL D、反应过程中, 的值不断增大11. 由下列实验及现象不能得出相应结论的是( )实验
现象
结论
A
向2 mL 0.01mol/L的 FeCl 3溶液中加入1滴KSCN溶液,再加入足量铁粉,充分振荡
溶液变为红色,加入铁粉后红色褪去,变为浅绿色
Fe3+比Fe2+的氧化性强
B
将一小块金属钠放置在空气中,一段时间后,将其放置在坩埚中加热
钠表面变暗,加热时,钠燃烧,发出黄色火焰
钠易与氧气反应,加热时生成Na2O的速率加快
C
加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸
湿润的红色石蕊试纸逐渐变蓝
NH4HCO3分解产生氨气
D
向2支盛有2mL相同浓度银氨溶液的试管中,分别加入2滴相同浓度的NaCl和NaI溶液
一支无明显现象,另一支产生黄色沉淀
相同条件下,AgI比AgCl的溶解度小
A、A B、B C、C D、D12. 活性炭可处理大气污染物NO。为模拟该过程,T℃时,在3L密闭容器中加入NO和活性炭粉,反应体系中各物质的量变化如下表所示。下列说法正确的是( )活性炭/mol
NO/mol
X/mol
Y/mol
起始时
2.030
0.100
0
0
10min达平衡
2.000
0.040
0.030
0.030
A、X一定是N2 , Y一定是CO2 B、10min后增大压强,NO的吸收率增大 C、10min后加入活性炭,平衡向正反应方向移动 D、0~10min的平均反应速率v(NO)=0.002 mol/(L•min)13. 常温时,研究pH对一定浓度FeSO4的稳定性的影响,根据下图分析不合理的是( ) A、pH小于1时,亚铁几乎无损耗,可能的原因是4Fe2++ O2+ 10H2O 4Fe(OH)3 + 8H+平衡逆向移动 B、pH在3.0~5.5之间,pH的变化对FeSO4稳定性影响不大 C、pH大于6.5时,亚铁损耗量突变,可能的原因是生成的Fe(OH) 2更易被氧化 D、其它条件相同时,FeSO4溶液中加入少量(NH4)2SO4固体,FeSO4的稳定性减弱
A、pH小于1时,亚铁几乎无损耗,可能的原因是4Fe2++ O2+ 10H2O 4Fe(OH)3 + 8H+平衡逆向移动 B、pH在3.0~5.5之间,pH的变化对FeSO4稳定性影响不大 C、pH大于6.5时,亚铁损耗量突变,可能的原因是生成的Fe(OH) 2更易被氧化 D、其它条件相同时,FeSO4溶液中加入少量(NH4)2SO4固体,FeSO4的稳定性减弱二、综合题
-
14. 某医药中间体F的制备流程如下(部分产物已略去)。

已知:
 (R、R1、R2、R3表示烃基)(1)、F中含有官能团的名称是羰基和。(2)、电石(CaC2)与水反应生成乙炔的化学方程式是。(3)、A不能发生银镜反应,则A的结构简式是。(4)、反应①~④中,属于加成反应的是(填序号)。(5)、反应⑥的化学方程式是。(6)、反应⑦的化学方程式是。(7)、某聚合物H的单体与A互为同分异构体,该单体核磁共振氢谱有三个峰,峰面积之比为1:2:3,且能与NaHCO3溶液反应,则聚合物H的结构简式是。(8)、
(R、R1、R2、R3表示烃基)(1)、F中含有官能团的名称是羰基和。(2)、电石(CaC2)与水反应生成乙炔的化学方程式是。(3)、A不能发生银镜反应,则A的结构简式是。(4)、反应①~④中,属于加成反应的是(填序号)。(5)、反应⑥的化学方程式是。(6)、反应⑦的化学方程式是。(7)、某聚合物H的单体与A互为同分异构体,该单体核磁共振氢谱有三个峰,峰面积之比为1:2:3,且能与NaHCO3溶液反应,则聚合物H的结构简式是。(8)、 ,以B和G为起始原料合成C,选用必要的无机试剂,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。 15. 羰基硫(COS)广泛应用于农药、医药和其它化工生产中。(1)、氧和硫元素位于同一主族,其原子结构的共同点是;羰基硫中含有的化学键类型是。(2)、CO和H2S混合加热生成羰基硫的反应是CO(g) + H2S(g) COS(g) + H2(g),
,以B和G为起始原料合成C,选用必要的无机试剂,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。 15. 羰基硫(COS)广泛应用于农药、医药和其它化工生产中。(1)、氧和硫元素位于同一主族,其原子结构的共同点是;羰基硫中含有的化学键类型是。(2)、CO和H2S混合加热生成羰基硫的反应是CO(g) + H2S(g) COS(g) + H2(g),请回答下列问题。
①某温度下,在1L恒容密闭容器中,加入10mol CO和10mol H2S,平衡时测得CO转化率为40%,则该温度下反应的平衡常数K=。
②由下图分析该反应是反应(填“吸热”或“放热”)。


③请解释上图250℃以前, 曲线 ⅰ 变化的可能原因是。
16. 从废旧液晶显示器的主材 ITO(主要成分是含铟、锡的氧化物)回收铟和锡,流程示意图如下。
资料:
物质
铟(In)
锡(Sn)
周期表位置
第五周期、第IIIA族
第五周期、第IVA族
颜色、状态
银白色固体
银白色固体
与冷酸作用
缓慢反应
缓慢反应
与强碱溶液
不反应
反应
(1)、为了加快步骤①的反应速率,可以采取的措施有(至少答两点)。(2)、步骤①中铟的氧化物转化成In3+的离子方程式是。(3)、步骤②中加入过量铟能够除去溶液中的Sn2+ , 根据所给资料分析其原因是。(4)、步骤④和⑤中NaOH溶液的作用是。(5)、下图是模拟精炼铟的装置图,请在方框中填写相应的物质。 17. 二氧化碳是主要的温室气体,也是一种工业原料。将其固定及利用,有利于缓解温室效应带来的环境问题。(1)、用二氧化碳合成甲醇。
17. 二氧化碳是主要的温室气体,也是一种工业原料。将其固定及利用,有利于缓解温室效应带来的环境问题。(1)、用二氧化碳合成甲醇。已知:2H2(g)+O2(g)=2H2O(g) △H1=-484 kJ/mol
2CH3OH(g) +3O2(g)=2CO2(g)+4H2O(g) △H2=-1348 kJ/mol
在催化剂作用下,CO2(g)和H2(g)反应生成CH3OH(g)和H2O(g),该反应的热化学方程式是。
(2)、用二氧化碳合成低密度聚乙烯(LDPE)。以纳米二氧化钛膜为工作电极,常温常压电解CO2 , 可制得LDPE,该电极反应可能的机理如下图所示。
① 过程Ⅰ~Ⅲ中碳元素均发生反应(填“氧化”或“还原”)。
② CO2转化为LDPE的电极反应式是(补充完整并配平)
2n CO2 + □__ +□__=
 + □__。
+ □__。③工业上生产1.4×104 kg 的LDPE,理论上需要标准状况下CO2的体积是L。
(3)、用二氧化碳与环氧丙烷( )反应合成可降解塑料PPC,同时也能生成副产物CPC,其化学反应过程中的能量变化如下图所示;在不同温度和压强下,PPC的选择性(产物中PPC的质量与产物总质量的比值)和总产率(产物总质量与反应物投料总质量的比值)如下表所示。
)反应合成可降解塑料PPC,同时也能生成副产物CPC,其化学反应过程中的能量变化如下图所示;在不同温度和压强下,PPC的选择性(产物中PPC的质量与产物总质量的比值)和总产率(产物总质量与反应物投料总质量的比值)如下表所示。 
①通过表中数据ⅰ、ⅱ、ⅲ可以得出的结论是;在25℃时,实际生产中选择反应压强为1.5MPa,而不是2.0MPa,理由是。
②通过表中数据ⅱ、ⅳ、ⅴ可知温度升高会使PPC的选择性下降,结合上图说明其原因可能是。
三、实验题
-
18. 某小组研究Na2S溶液与KMnO4溶液反应,探究过程如下。

资料:ⅰ. 在强酸性条件下被还原为Mn2+ , 在近中性条件下被还原为MnO2。
ⅱ. 单质硫可溶于硫化钠溶液,溶液呈淡黄色。
(1)、根据实验可知,Na2S具有性。(2)、甲同学预测实验I中S2–被氧化成 。①根据实验现象,乙同学认为甲的预测不合理,理由是。
②乙同学取实验I中少量溶液进行实验,检测到有 ,得出S2–被氧化成 的结论,丙同学否定了该结论,理由是。
③同学们经讨论后,设计了如下实验,证实该条件下 的确可以将S2–氧化成 。

a.右侧烧杯中的溶液是。
b.连通后电流计指针偏转,一段时间后,(填操作和现象)。
(3)、实验I的现象与资料i存在差异,其原因是新生成的产物(Mn2+)与过量的反应物( )发生反应,该反应的离子方程式是。(4)、实验II的现象与资料也不完全相符,丁同学猜想其原因与(3)相似,经验证猜想成立,他的实验方案是。(5)、反思该实验,反应物相同,而现象不同,体现了物质变化不仅与其自身的性质有关,还与因素有关。