浙江省衢州市2018-2019 学年九年级上学期科学期中考试试卷
试卷更新日期:2018-11-08 类型:期中考试
一、选择题
-
1. 我们家乡衢州特产丰富,以下特产制作的部分过程中涉及到化学变化的是( )A、生产红糖时蒸发甘蔗汁液 B、酿制江山米酒时发酵糯米 C、制作龙游发糕时将成品进行包装 D、制作开化开顺牌黑木耳时晒干水分2. 物质的性质决定用途。下列物质的性质和用途不一致的是( )
A、铜的导电性好,用作导线 B、铝的密度小,用作飞机材料 C、金的延展性好,做成金箔 D、银的导热性好,作装饰品3. 用 ”和
”和  ”表示不同元素的原子,下列微观示意图能表示化合物的是( ) A、
”表示不同元素的原子,下列微观示意图能表示化合物的是( ) A、 B、
B、 C、
C、 D、
D、 4. 下列有关物质的化学式、名称、俗名不完全对应的是( )A、NaCl 氯化钠 食盐 B、CaO 氧化钙 生石灰 C、Na2CO3 碳酸钠 苏打 D、NaOH 氢氧化钠 纯碱5. 关于下图中四个实验操作及评价正确的是( )
4. 下列有关物质的化学式、名称、俗名不完全对应的是( )A、NaCl 氯化钠 食盐 B、CaO 氧化钙 生石灰 C、Na2CO3 碳酸钠 苏打 D、NaOH 氢氧化钠 纯碱5. 关于下图中四个实验操作及评价正确的是( ) A、图甲的操作能准确测定溶液的酸碱度 B、图乙所示的胶头滴管操作不规范 C、可用图丙方式来稀释浓硫酸 D、图丁木条碳化的原因是浓硫酸有吸水性6. 下列有关物质的科学知识不正确的是( )A、稀有气体的化学性质很不活泼 B、农业上可以用熟石灰改良酸性土壤 C、全棉棉线燃烧时能闻到烧焦羽毛气味 D、保护金属资源的有效途径是防止金属腐蚀,回收利用废旧金属,合理有效地开采矿物,以及寻找金属的代用品等7. 下列方案设计能达到实验目的,且书写的化学方程式正确的是( )A、用稀盐酸除去铁钉表面的铁锈:Fe2O3+6HCl=2FeCl3+3H2O B、用稀硫酸洗去试管壁上附着的铜:Cu+H2SO4=CuSO4+H2↑ C、用氢氧化钠溶液除去盛石灰水的试剂瓶内壁的一层白膜: CaCO3+2NaOH=Ca(OH)2+Na2CO3 D、用 AgCl 除去铜粉中含有的少量铁粉:Fe+2AgCl=FeCl2 +2Ag8. 归纳和演绎是重要的科学方法。下列归纳或演绎合理的是( )A、金属 Fe、Zn 能与酸反应生成氢气,所以金属都能与酸反应生成氢气 B、硫酸、盐酸电离时都能产生 H+ , 所以电离时能产生 H+的化合物是酸 C、氧化物是由两种元素组成,其中一种是氧元素的化合物,所以水是氧化物 D、盐中含有金属阳离子和酸根阴离子,硝酸铵中没有金属阳离子,所以硝酸铵不属于盐9. “绿色化学”要求从根本上清除污染。它包括“原料的绿色化”、“化学反应的绿色化”、“产物的绿色化”等内容。其中“化学反应的绿色化”要求原料物质中的所有原子完全被利用且全部转入期望的产品中。下列符合“化学反应的绿色化”的是( )A、以氧化镁为原料制取 MgCl2 B、实验室制取二氧化碳气体 C、工业上生成乙醛:2C2H4+ O2 2C2H4O D、以铁屑、氧化铜、稀硫酸为原料制取铜10. 下列实验设计或操作,能达到实验目的的是( )
A、图甲的操作能准确测定溶液的酸碱度 B、图乙所示的胶头滴管操作不规范 C、可用图丙方式来稀释浓硫酸 D、图丁木条碳化的原因是浓硫酸有吸水性6. 下列有关物质的科学知识不正确的是( )A、稀有气体的化学性质很不活泼 B、农业上可以用熟石灰改良酸性土壤 C、全棉棉线燃烧时能闻到烧焦羽毛气味 D、保护金属资源的有效途径是防止金属腐蚀,回收利用废旧金属,合理有效地开采矿物,以及寻找金属的代用品等7. 下列方案设计能达到实验目的,且书写的化学方程式正确的是( )A、用稀盐酸除去铁钉表面的铁锈:Fe2O3+6HCl=2FeCl3+3H2O B、用稀硫酸洗去试管壁上附着的铜:Cu+H2SO4=CuSO4+H2↑ C、用氢氧化钠溶液除去盛石灰水的试剂瓶内壁的一层白膜: CaCO3+2NaOH=Ca(OH)2+Na2CO3 D、用 AgCl 除去铜粉中含有的少量铁粉:Fe+2AgCl=FeCl2 +2Ag8. 归纳和演绎是重要的科学方法。下列归纳或演绎合理的是( )A、金属 Fe、Zn 能与酸反应生成氢气,所以金属都能与酸反应生成氢气 B、硫酸、盐酸电离时都能产生 H+ , 所以电离时能产生 H+的化合物是酸 C、氧化物是由两种元素组成,其中一种是氧元素的化合物,所以水是氧化物 D、盐中含有金属阳离子和酸根阴离子,硝酸铵中没有金属阳离子,所以硝酸铵不属于盐9. “绿色化学”要求从根本上清除污染。它包括“原料的绿色化”、“化学反应的绿色化”、“产物的绿色化”等内容。其中“化学反应的绿色化”要求原料物质中的所有原子完全被利用且全部转入期望的产品中。下列符合“化学反应的绿色化”的是( )A、以氧化镁为原料制取 MgCl2 B、实验室制取二氧化碳气体 C、工业上生成乙醛:2C2H4+ O2 2C2H4O D、以铁屑、氧化铜、稀硫酸为原料制取铜10. 下列实验设计或操作,能达到实验目的的是( ) A、①干燥氢气 B、②验证质量守恒定律 C、③检验 X 溶液中是否含有 SO42- D、④验证 Zn、Fe、Cu 的活动性强弱11. 下列物质的变化中,只有加酸才能一步实现的是( )A、CaCO3→CO2 B、Fe2O3→FeCl3 C、Zn→ZnSO4 D、KOH→KCl12. 小金做了如下实验,将 4.2 克铁粉和 4.0 克氧化铜粉末均匀混合,然后一次性投入盛有200 克 9.8%稀硫酸的大烧杯中。观察到如下现象,立即出现红色固体,前阶段没有明显的气泡产生,后阶段产生大量无色气泡,充分反应后上层清液呈浅绿色。由此小金做出下列判断,其中不合理的是( )
A、①干燥氢气 B、②验证质量守恒定律 C、③检验 X 溶液中是否含有 SO42- D、④验证 Zn、Fe、Cu 的活动性强弱11. 下列物质的变化中,只有加酸才能一步实现的是( )A、CaCO3→CO2 B、Fe2O3→FeCl3 C、Zn→ZnSO4 D、KOH→KCl12. 小金做了如下实验,将 4.2 克铁粉和 4.0 克氧化铜粉末均匀混合,然后一次性投入盛有200 克 9.8%稀硫酸的大烧杯中。观察到如下现象,立即出现红色固体,前阶段没有明显的气泡产生,后阶段产生大量无色气泡,充分反应后上层清液呈浅绿色。由此小金做出下列判断,其中不合理的是( )
A、“立即出现红色固体”是由于很快发生了如下转化: CuO CuSO4 Cu B、“产生大量无色气泡”是由于发生了如下反应:Fe+H2SO4=FeSO4+H2↑ C、该实验条件下,硫酸铜比稀硫酸更容易跟铁粉发生反应 D、在不同浓度的硫酸铜和稀硫酸的混合溶液中投入铁粉,都是硫酸铜先跟铁粉反应13. 下列选用的除杂试剂和实验操作都正确的是( )选项
物质
杂质
除杂试剂
操作方法
A.
CO2
HCl
氢氧化钠溶液
气体通过盛有足量氢氧化钠溶液的洗气瓶
B.
NaCl
Na2CO3
硫酸
加入少量硫酸、蒸发、结晶
C.
CaCO3
NaCl
水
加入足量水溶解、过滤、洗涤、干燥
D.
Cu
CuO
氧气
通入足量氧气并加热
A、A B、B C、C D、D14. 如图是物质的分类及部分转化关系图,下列有关说法不正确的是( ) A、分离液态空气制取氧气属于转化 a B、转化 c 一定是化学变化 C、转化 c 中一定有元素的化合价发生改变 D、转化 b 一定是化学变化15. 往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为 m 的锌粉,溶液中析出固体的质量与参加反应的锌粉质量关系如图所示,下列说法中正确的是( )
A、分离液态空气制取氧气属于转化 a B、转化 c 一定是化学变化 C、转化 c 中一定有元素的化合价发生改变 D、转化 b 一定是化学变化15. 往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为 m 的锌粉,溶液中析出固体的质量与参加反应的锌粉质量关系如图所示,下列说法中正确的是( ) A、c 点对应溶液中含有的金属离子为 Zn2+和 Cu2+ B、bc 段(不含两端点)析出的金属是 Fe C、ab 段(不含两端点)对应溶液中含有的金属离子为Zn2+、Ag+、Cu2+、Fe2+ D、若 bc 段和 cd 段中析出固体质量相等,参加反应的锌粉质量分别为 m1 和 m2 , m1>m2
A、c 点对应溶液中含有的金属离子为 Zn2+和 Cu2+ B、bc 段(不含两端点)析出的金属是 Fe C、ab 段(不含两端点)对应溶液中含有的金属离子为Zn2+、Ag+、Cu2+、Fe2+ D、若 bc 段和 cd 段中析出固体质量相等,参加反应的锌粉质量分别为 m1 和 m2 , m1>m2二、填空题
-
16. “花的颜色有红的、蓝的、紫的等。这些花里含的色素叫花青素,花青素遇到酸就变红, 遇到碱就变蓝……”据此,小科做了如下家庭实验:将一朵紫色喇叭花泡在肥皂水中, 喇叭花很快变成了蓝色;将另一朵紫色喇叭花泡在厨房的某种调味品中,喇叭花变成了红色。请根据以上实验现象回答:
(1)、小科选用的调味品最有可能是(选填“食醋”、“酱油”或“黄酒”)。(2)、下列各组物质的溶液,仅用喇叭花不能鉴别的一组是 (选填字母)。A、HCl、NaOH B、HCl、NaCl C、NaOH、NaCl D、H2O、NaCl17. 7 月 24 日,一座孔子雕像在江山中学科技楼前安装完毕,这座高达 4.6 米、重约 12 吨的雕像全身用质地细腻、色泽纯白的汉白玉雕琢而成,是由校友捐赠的。汉白玉是洁白纯净的碳酸钙岩石。(1)、汉白玉能被雕琢体现的是汉白玉的(选填“物理”或“化学”)性质。
(2)、小江想验证下汉白玉是否是碳酸钙岩石,他可选用的实验室试剂是。
18. 下图是对生成氯化钠反应关系的归纳与整理。 (1)、物质 A 是常见的碱,写出 A 的化学式:。(2)、反应③、④、⑤、⑥能够发生的原因是 , 反应①属于基本反应类型中的反应。
(1)、物质 A 是常见的碱,写出 A 的化学式:。(2)、反应③、④、⑤、⑥能够发生的原因是 , 反应①属于基本反应类型中的反应。
19. 将一定质量的某液体盛于烧杯中,敞口放置在实验室安全之处。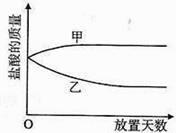 (1)、如果该液体是浓盐酸,则浓盐酸的质量和放置天数的关系的曲线(见上图)正确的是(选填“甲”或“乙”), 它的质量发生变化的原因是。
(1)、如果该液体是浓盐酸,则浓盐酸的质量和放置天数的关系的曲线(见上图)正确的是(选填“甲”或“乙”), 它的质量发生变化的原因是。
(2)、如果该液体是浓硫酸,则浓硫酸的质量和放置天数的关系的曲线(见上图)正确的是(选填“甲”或“乙”)。
20. 我国第一位诺贝尔生理学或医学奖获得者——屠呦呦曾坦言青蒿素提取的成功,灵感来源于葛洪的著作。葛洪是我国古代著名的道教学者、炼丹家、医药学家,他的许多观点对我国后世的科学发展产生了很大的影响。
(1)、葛洪在炼丹时发现“以曾青(硫酸铜)涂铁,铁赤色如铜”,请用化学方程式表示这一变化过程。
(2)、葛洪很早就发现了治疗疟疾的高效药方:“青蒿一握,以水二升渍,绞取汁,尽服之。”屠呦呦据此用低沸点溶剂分离出治疟疾的特效药——青蒿素,从而获得 2015 年诺贝尔奖。青蒿素的分子式为 C15H22O5 , 在分类上属于 (填字母)。
A、盐 B、酸 C、氧化物 D、有机物(3)、葛洪在《肘后方》一书中提到:把生石灰、草木灰加水混合后所得的物质可用于“食肉去痣”,则起到去除黑痣作用的主要物质是(填化学式)。
21. 氨气是一种无色、有刺激性气味的气体,极易溶于水,氨水显碱性。实验室用加热氯化铵和熟石灰两种固体的混合物来制取氨气,同时生成氯化钙和水。 (1)、实验室有上述装置,小明选装置 B 制取氨气,用装置 G 收集氨气,他应选用装置(填序号)干燥氨气。(2)、按图Ⅰ连接,烧杯中是加有紫色石蕊试液的水,挤压胶头滴管使其中少量的水进入烧瓶,打开止水夹,烧瓶中就可以看到蓝色的喷泉。按图Ⅱ连接,引发喷泉现象发生的简易操作是(提示:用物理方法使氨气和烧 杯中水接触可引发喷泉)。
(1)、实验室有上述装置,小明选装置 B 制取氨气,用装置 G 收集氨气,他应选用装置(填序号)干燥氨气。(2)、按图Ⅰ连接,烧杯中是加有紫色石蕊试液的水,挤压胶头滴管使其中少量的水进入烧瓶,打开止水夹,烧瓶中就可以看到蓝色的喷泉。按图Ⅱ连接,引发喷泉现象发生的简易操作是(提示:用物理方法使氨气和烧 杯中水接触可引发喷泉)。 22. 某小组想探究盐酸、氢氧化钙的化学性质,取 8 支试管分别用 A-H 编号后,做了如下实验:
22. 某小组想探究盐酸、氢氧化钙的化学性质,取 8 支试管分别用 A-H 编号后,做了如下实验: (1)、实验中观察到有气泡出现的试管是 , 有沉淀生成的试管是。(2)、实验后某试管的底部有白色固体,过滤后向滤液中滴加盐酸,滴加一会后有气泡冒出, 则该滤液中的溶质是。
(1)、实验中观察到有气泡出现的试管是 , 有沉淀生成的试管是。(2)、实验后某试管的底部有白色固体,过滤后向滤液中滴加盐酸,滴加一会后有气泡冒出, 则该滤液中的溶质是。
23. 现有一包白色固体混合物,可能由 BaCl2、KOH、KNO3、MgCl2、CuSO4 中的一种或几种混合而成,某课外兴趣小组的同学进行如下图所示实验,试回答: (1)、白色固体混合物中一定含有的物质是;
(1)、白色固体混合物中一定含有的物质是;
(2)、步骤②中加 KOH 的目的是。
三、实验探究题
-
24. 全世界每年被腐蚀损耗的钢铁材料约占全年钢铁产量的十分之一。下面是对铁的腐蚀条件的探究。
铁生锈所需要时间较长,某实验小组的同学设计如图所示实验。
 (1)、检查装置的气密性:连接好装置,关闭分液漏斗的活塞,将 C 导管接入到装有水的烧杯中,微热甲装置,说明气密性良好的现象是。
(1)、检查装置的气密性:连接好装置,关闭分液漏斗的活塞,将 C 导管接入到装有水的烧杯中,微热甲装置,说明气密性良好的现象是。
(2)、加入药品开始实验,4 分钟后观察:A 处铁丝依然光亮,B 处铁丝表面灰暗,D 处铁丝依然光亮,该实验说明铁生锈主要与空气(或氧气)和有关。B、D 处实验现象对比说明:决定铁生锈快慢的一个重要因素是。
25. 某混合气体由 CO、CO2、SO2 三种气体组成,某兴趣小组对此进行了相关实验:【查阅资料】①SO2 能使品红溶液褪色;②SO2 易与高锰酸钾溶液反应而被吸收,并能使其褪色;③SO2 能使氢氧化钡溶液和澄清石灰水变浑浊;④CO 和 CO2 均不能使品红溶液褪色,也不与高锰酸钾溶液反应。
【实验研究】为验证这三种气体,同学们设计并进行如下实验:

【事实与结论】通过实验验证了以上三种气体都存在
(1)、装置 A 的作用是;(2)、能证明气体中含有 CO2 的现象是;(3)、【反思与评价】有同学提出上述装置中省略 D 装置也能达到实验目的,你认为该同学的提议有无道理并说明理由。26. 兴趣小组某同学在做铜与硝酸银溶液反应的实验,当观察到铜丝表面有银白色固体出现时,发现试管内溶液未显蓝色,与所学知识不符。组内同学即展开讨论, 认为溶液未显蓝是因为铜离子的浓度太小,于是对铜离子浓度太小的原因进行了如下猜想:(1)、猜想一:硝酸银溶液浓度不够大。猜想二:铜丝中含有比铜活泼的金属。
猜想三:。
(2)、【实验验证】①验证猜想一:你的方案是。②验证猜想二:取上述相同的铜丝,选择一种酸或盐溶液在相同条件下进行实验,观察实验现象,得出结论。请你在矩形框内画出实验装置图,并标出所选物质。

③验证猜想三:进一步实验……
27. 为了证明酸和碱反应有水生成,兴趣小组进行了如下实验:【资料】无水硫酸铜遇到水或水蒸气变蓝色,空气中有水蒸气。

【设计实验】如下图所示,取甲、乙、丙三支洁净的试管,向甲试管中加入无水乙酸和无水硫酸铜,向乙试管中加入氢氧化钠固体和无水硫酸铜,向丙试管中加入无水乙酸、氢氧化钠固体和无水硫酸铜,并将试管内的试剂充分混合。
【实验反思】
(1)、实验前,小科通过仔细观察后认为该实验设计存在不严谨的地方,你认为应当对实验作如何改进?。(2)、经过改进后,通过实验中现象,表明无水乙酸和氢氧化钠固体反应产生了 水。
(3)、整理实验器材时,小科发现丙试管底部有发热现象,猜想无水乙酸和氢氧化钠反应属于放热反应。但小雪对小科的猜想提出了反驳,她反驳的依据是。
28. 初中科学课上,同学们利用下图所示实验探究碱的化学性质。 (1)、实验结束后,同学们将废液倒入同一只废液缸中,最后发现废液浑浊并显红色。
(1)、实验结束后,同学们将废液倒入同一只废液缸中,最后发现废液浑浊并显红色。【提出问题】废液中含有什么物质?
【假设猜想】通过分析上述实验,同学们猜想:废液中除酚酞和水外一定含有。
(2)、老师问:废液中还可能有什么物质?同学们引发了热烈讨论,下面是大家的发言:学生甲
还可能有 Ca(OH)2、NaOH
学生丙
还可能有 Ca(OH)2、CaCl2
学生乙
还可能有 NaOH、Na2CO3
学生丁
还可能有 Na2CO3
…
…
【查阅资料】CaCl2+Na2CO3=CaCO3↓+2NaCl
【实验验证】同学们对可能含有的物质进行确定,取一定量的废液过滤,向滤液中逐滴加入氯化钙溶液,根据反应现象绘制了如图所示的示意图。

①【结论解释】分析图象数据得出可能含有的物质中,一定含有。
②【拓展提高】那么是否含有氢氧化钠呢?请你帮他写出判断的方法:。
四、解答题
-
29. 学校科学兴趣小组的同学,为了探究 CO2 性质,设计了如图所示的实验。江岚同学进行如下操作,关闭Ⅱ阀打开Ⅰ阀,紫色小花(用石蕊溶液染成)变红,根据现象得出结论:
CO2具有酸性;而张林慧同学提出质疑,修改了该实验方案,在甲瓶中添加某种试剂再次试验,能得出正确的结论。你认为张林慧同学如何去做,得出怎样的科学结论,并说明理由。
【查阅资料】蒸馏水不能使紫色石蕊试液变色。
30. “春泛盐,秋泛硝”。有些地区的盐碱地里春天会析出食盐,到了秋天,又会析出芒硝(主要成分是 Na2SO4·10H 2O)。该地区某中学的同学们对“硝”的成分产生了争议,甲小组同学认为“硝”中只含有硫酸钠,乙小组同学认为“硝”中既含有硫酸钠,又含有氯化钠。为了验证猜想,他们采集了样品,加适量水完全溶解后,过滤,滤液备用。⑴甲小组同学的实验如下:取少量滤液放入试管中,滴加过量的氯化钡溶液,再滴加稀硝酸,观察到有白色沉淀产生,反应的化学方程式为。过滤,再向滤液中滴加 , 又有白色沉淀产生,最终认为乙小组观点正确。
⑵乙小组同学认为甲组同学实验方法不合理,将氯化钡溶液改成硝酸钡溶液,其余方法步骤都相同。
⑶你认为甲、乙两小组的实验设计哪个合理?并说明理由。。
31. 根据给出的药品(稀硫酸、浓硫酸)和下图实验装置(包括托盘天平),设计一个实验, 粗略测定由铜和锌两种金属组成的铜锌合金中锌的质量分数(假设合金已加工成粉末)。实验原理:由产生氢气的体积,查密度表知氢气质量,从而求得锌的质量。据实验原理设计的实验方案回答下列问题: (1)、你选用的药品是。
(1)、你选用的药品是。
(2)、你选用的实验装置(填装置编号)。若需组装,则连接的顺序是(用装置 接口编号表示)。
(3)、实验中你必须测定的有效数据是( )A .生成 H2 的体积 a 毫升 B .反应前仪器和药品的质量 b 克
C .反应后剩余固体的质量 c 克 D .反应后仪器和药品的质量 d 克
E .黄铜样品的质量 e 克
32. 某学习小组设计分离 NaCl 和 CaCl2 两种固体混合物方案如下: (1)、操作 A 是。
(1)、操作 A 是。
(2)、蒸发氯化钙溶液过程中需要用到的仪器除蒸发皿、烧杯、铁架台(带铁圈)、酒精灯、火柴外,还必须要有的一种仪器是。
(3)、有同学提出滤液中含有少量的碳酸钠,应加入至过量,再蒸发结晶才能得 到纯净的氯化钠。(4)、如果实验过程中得到白色沉淀 80 克,试计算原混合物中有多少克 CaCl2 固体?(假设实验过程中无损耗)33. 铁常用的是合金生铁和钢,通常通过金属冶炼制的。(1)、赤铁矿的主要成分为氧化铁,可用于炼铁。某地出产一种赤铁矿,其中氧化铁的质量分数为 64%,90 吨该赤铁矿经过充分冶炼,最多可生产含铁 96%的生铁多少吨?(2)、实验室常用还原剂还原氧化铁。某学生小组对过量碳粉与氧化铁反应产物中气体的成分进行研究。①提出假设:该反应的气体产物全部是二氧化碳。
②设计方案:将一定量的氧化铁在隔绝氧气条件下与过量炭粉完全反应(如图),测定参加反应的碳元素与氧元素的质量比。
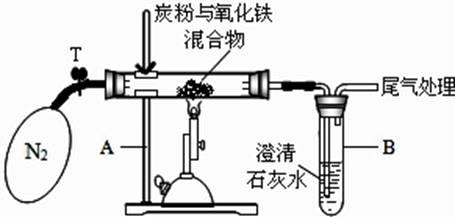
③查阅资料:氮气不与碳、氧化铁发生反应,可用来隔绝氧气。
④实验操作:
Ⅰ称取 3.2g 氧化铁与 2g 碳粉均匀混合,放入 48.48g 的玻璃管中,按如图装置连接;
Ⅱ加热前,先通一段时间纯净、干燥的氮气,其目的是;
Ⅲ夹紧 T 处弹簧夹,加热一段时间,澄清石灰水变浑浊;
Ⅳ完全反应后,冷却至室温,称得玻璃管和固体的总质量为 52.24g。
⑤数据处理:经计算,参加反应的碳元素质量为 0.48g,氧元素质量为 0.96g。
⑥得到结论:根据数据处理结果,得出原假设不成立,理由是。
34. 向含 CuCl2 和 HCl 的 150g 混合溶液中,逐滴加溶质质量分数为 10%的 NaOH 溶液,参加反应的 NaOH 溶液质量与生成沉淀质量关系如图。据图回答: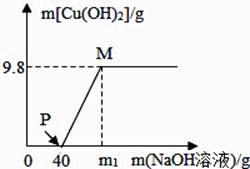 (1)、在滴加NaOH 溶液过程中,原溶液中离子个数不变。(填离子符号)(2)、P 点溶液中的溶质是。
(1)、在滴加NaOH 溶液过程中,原溶液中离子个数不变。(填离子符号)(2)、P 点溶液中的溶质是。
(3)、m1 为多少?(要求写出具体的解题过程)35. 有一种石灰石样品的成分是 CaCO3 和 SiO2。课外小组同学将 100g 盐酸分 5 次加入到 35g石灰石样品中(已知 SiO2 不与盐酸反应),得到如下部分数据:
次数
第一次
第二次
第三次
第四次
第五次
加入稀盐酸的质量/g
20
20
20
20
20
剩余固体的质量/g
30
a
20
15
15
(1)、第 2 次加入盐酸后,a 为g;(2)、石灰石样品中碳酸钙的质量分数?(计算结果精确至 0.1%)(3)、10%的 CaCl2 溶液可做路面保湿剂。欲将第 5 次实验后的溶液配成 10%的 CaCl2 溶液, 可先向此溶液中加入足量的石灰石粉末,完全反应后过滤,这时还需要向滤液中加入水多少克?(假设实验过程中溶液损失忽略不计)(计算结果精确至 0.1g)