2016-2017学年陕西省宝鸡市岐山县高一上学期期末化学试卷
试卷更新日期:2017-03-17 类型:期末考试
一、选择题
-
1. “垃圾是放错了位置的资源”,应该分类回收.生活中废弃的铁锅、铝制的易拉罐、铜导线等可以归为一类加以回收,它们属于( )A、氧化物 B、盐 C、金属或合金 D、碱2. 实验室保存下列物质的方法,不正确的是( )A、少量的金属钠保存在煤油里 B、烧碱溶液盛放在用玻璃塞塞紧的试剂瓶中 C、FeSO4溶液存放在加有少量Fe粉的试剂瓶中 D、氯水应装在棕色瓶中密封避光保存3. 在下列条件的溶液中,各组离子一定能够大量共存的是( )A、使酚酞试液变红的溶液:Na+、Cl﹣、SO42﹣、Fe3+ B、水玻璃溶液中:K+、SO42﹣、Cl﹣、H+ C、可与Al反应放出氢气的溶液中:Na+、Ca2+、Cl﹣、HCO3﹣ D、使石蕊变蓝的溶液中:Ba2+、Na+、AlO2﹣、Cl﹣4. 下列四组反应中既有白色沉淀产生,又有气体放出的是( )A、Na2O2和CuSO4溶液反应 B、金属钠投入到MgSO4溶液中 C、BaCl2和NaHSO4溶液反应 D、纯碱溶液和澄清石灰水反应5. 下列叙述正确的是( )
①氧化铝是一种比较好的耐火材料,可用来制造耐火坩埚
②氧化铁常用作红色油漆和涂料
③碳酸氢钠俗名小苏打,可用于制作发酵粉和治疗胃酸过多的药物
④过氧化钠比氧化钠稳定,但两种氧化物均可作潜艇中的供氧剂
⑤焰色反应体现的是元素的性质.
A、①②③⑤ B、②③④⑤ C、①③④⑤ D、①②③④6. 设NA表示阿伏加德罗常数,下列叙述中正确的是( )A、标准状况下,2.24 L CCl4所含的原子数为0.5 NA B、100 m L 0.1 mol/L的 NaCl 溶液中,所含微粒总数为0.02 NA C、1.7 g 的OH﹣中含有的电子数为NA D、78 g Na2O2 与足量水反应转移电子数为2 NA7. 下列反应的离子方程式书写不正确的是( )A、氯化铝溶液中加入过量氨水:Al3++4NH3•H2O=AlO2﹣+4NH4++2H2O B、氧化亚铁溶于稀盐酸:FeO+2H+=Fe2++H2O C、二氧化硅与烧碱溶液反应:SiO2+2OH﹣=SiO32﹣+H2O D、除去氧化膜的铝片插入硝酸汞溶液中:2Al+3Hg2+=2Al3++3Hg8. 下列实验的操作和结论正确的是( )A、将0.1mol Na和少量Al片放入水溶液中,放出气体刚好是0.05mol B、Na2O2投入到FeCl2溶液中只得到大量白色沉淀 C、镁粉中混有铝粉,可与NaOH溶液反应再过滤,得到镁粉 D、配制一定物质的量浓度溶液,定容时仰视容量瓶刻度线,使所得溶液浓度偏大9. 向含HCl和AlCl3的混合液中不断滴加NaOH溶液,下列图象中能正确表示上述反应的是( )A、 B、
B、 C、
C、 D、
D、 10. 下列化合物不能由单质直接化合生成的是( )A、SO3 B、FeS C、Cu2S D、CuCl211. 下列说法中,不正确的是( )A、光导纤维是以二氧化硅为主要原料制成的 B、二氧化硅溶于水生成硅酸 C、石英、水晶、玛瑙的主要成分都是二氧化硅 D、二氧化硅是一种熔沸点很高、硬度很大的氧化物12. 由 NaHS、MgSO4、NaHSO3 组成的混合物中,已知硫元素的质量分数w(S)=a%,则氧元素的质量分数w(O)为( )A、1.75a% B、1.25a% C、1﹣1.75a% D、1﹣1.25a%13. 关于硅及其化合物的叙述中,不正确的是( )A、硅是良好的半导体材料 B、二氧化硅能与石灰石反应:SiO2+CaCO3 CaSiO3+CO2↑ C、可以用焦炭还原二氧化硅生产硅:SiO2+2C Si+2CO↑ D、水泥的主要成分是 Na2SiO3、CaSiO3 和 SiO214. 从海水中提取镁,可按如下步骤进行:
10. 下列化合物不能由单质直接化合生成的是( )A、SO3 B、FeS C、Cu2S D、CuCl211. 下列说法中,不正确的是( )A、光导纤维是以二氧化硅为主要原料制成的 B、二氧化硅溶于水生成硅酸 C、石英、水晶、玛瑙的主要成分都是二氧化硅 D、二氧化硅是一种熔沸点很高、硬度很大的氧化物12. 由 NaHS、MgSO4、NaHSO3 组成的混合物中,已知硫元素的质量分数w(S)=a%,则氧元素的质量分数w(O)为( )A、1.75a% B、1.25a% C、1﹣1.75a% D、1﹣1.25a%13. 关于硅及其化合物的叙述中,不正确的是( )A、硅是良好的半导体材料 B、二氧化硅能与石灰石反应:SiO2+CaCO3 CaSiO3+CO2↑ C、可以用焦炭还原二氧化硅生产硅:SiO2+2C Si+2CO↑ D、水泥的主要成分是 Na2SiO3、CaSiO3 和 SiO214. 从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;
②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;
③将沉淀物与盐酸反应,结晶,过滤、得到含结晶水的晶体;
④将得到晶体在一定条件下加热得到无水氯化镁;
⑤电解无水氯化镁,得到金属镁.
下列说法中错误的是( )
A、此法的优点之一是原料来源丰富 B、①②③步骤的目的是从海水中提取MgCl2 C、以上提取镁的过程中涉及化合、分解和复分解反应 D、以上提取镁的过程中涉及的反应均不是氧化还原反应15. 下列属于氧化还原反应的是( )A、NaOH+HCl═NaCl+H2O B、Zn+2HCl═ZnCl2+H2↑ C、2NaHCO3 Na2CO3+H2O+CO2↑ D、CuO+2HCl═CuCl2+H2O16. 如果你家里的食用花生油不小心混入了大量的水,利用你所学的知识,最简便的分离方法是( )A、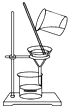 B、
B、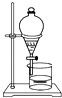 C、
C、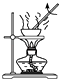 D、
D、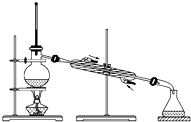
二、非选择题
-
17. 完成下面几个小题:(1)、写出硫酸铁在水溶液中电离的电离方程式(2)、用双线桥法,标出下列氧化还原反应的电子转移方向和电子总数
2FeCl3+Fe=3FeCl2 氧化剂是 (填化学式)
(3)、氨的催化氧化是工业上制硝酸的基础:4NH3+5O2 4NO+6H2O,其中作为还原剂的物质是(填化学式);若反应中生成了0.2mol NO,则转移 mol电子,(4)、在一定条件下,RO3n﹣ 和氯气可发生如下反应:RO3n﹣+Cl2+2OH﹣=RO42﹣+2Cl﹣+H2O由以上反应可知在上过程中RO3n﹣被(填“氧化”或“还原”),RO3n﹣中元素R的化合价是 .18. 某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.(1)、分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊.A受热分解的化学方程式为 .(2)、称取两种固体各2g,分别加入两个小烧杯中,再各加10mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复到室温,向所得溶液中各滴入2滴酚酞溶液.①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论: .
②同学们在两烧杯中还观察到以下现象.其中,盛放Na2CO3的烧杯中出现的现象是(填字母序号).
a.溶液温度下降b.溶液温度升高c.滴入酚酞后呈浅红色d.滴入酚酞后呈红色
(3)、如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中.
①两试管中均产生气体,(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈.
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是(填字母序号).
a.装置Ⅰ的气球体积较大b.装置Ⅱ的气球体积较大
c.生成气体的体积根据盐酸计算d.生成气体的体积根据固体计算
(4)、同学们将两种固体分别配制成0.5mol•L﹣1的溶液,设计如下方案并对反应现象做出预测:实验方案
预测现象
预测依据
操作1:向2mL Na2CO3溶液中滴加1mL 0.5mol•L﹣1 CaCl2溶液
有白色沉淀
Na2CO3溶液中的CO32﹣浓度较大,能与CaCl2发生反应:(写离子方程式)
操作2:向2mL NaHCO3溶液中滴加1mL 0.5mol•L﹣1 CaCl2溶液
无白色沉淀
NaHCO3溶液中的CO32﹣浓度很小,不能与CaCl2反应
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体,则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为 .
19. 某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验.
请回答下列问题:
(1)、装置A中盛放亚硫酸钠的仪器名称是 , 其中发生反应的化学方程式为 .(2)、实验过程中,装置B、C中发生的现象分别是、 , 装置B中发生反应的离子方程式为;(3)、装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 .(4)、尾气可采用溶液吸收.20. 已知A、B、C、D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,它们的水溶液之间的一些反应现象如下:①A+B→白色沉淀,加入稀硝酸,沉淀不溶解.
②B+D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色.
③C+D→白色沉淀,继续加D溶液,白色沉淀逐渐消失.
试推断A、B、C、D各物质的化学式为:A、B、C、D
21. 将6.4g铜与足量的浓硫酸在加热情况下充分反应,铜没有剩余.试计算:提示:(Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O)
(1)、参加反应的硫酸的物质的量.(2)、生成的SO2的体积(标准状况下).(3)、将反应后的溶液用水稀释到100mL,计算硫酸铜溶液的物质的量浓度.