2016年湖南省长沙市高考化学一模试卷
试卷更新日期:2017-03-16 类型:高考模拟
一、选择题
-
1. 2015年12月31日,日本获得第113号元素的正式命名权.这种原子(记作 ),是由30号元素Zn,连续轰击83号元素Bi获得的.下列说法,不正确的是( )A、获得新核素 Ja的过程,是一个化学变化 B、题中涉及的三种元素,都属于金属元素 C、这种超重核素 Ja的中子数与质子数只差为52 D、这种新核素,是同主族元素中原子半径最大的2. 明星药物青蒿素的分子式为C15H22O5 , 键线式为
 .关于它的说法中,正确的是( ) A、青蒿素是一种氧化物 B、青蒿素中氧元素的质量分数为11.9% C、青蒿素中C,H,O三种元素的质量比为90:11:40 D、青蒿素是由15个碳原子、22个氢原子和5个氧原子构成的3. 25℃时,下列各组离子在指定溶液中一定能大量共存的是( )A、滴入石蕊试液显蓝色的溶液中:K+、Na+、HSO3﹣、ClO﹣ B、0.1mol/L的Fe(NO3)3溶液中:Na+、H+、Cl﹣、I﹣ C、0.1mol/L的NaAlO2溶液中:K+、H+、NO3﹣、SO42﹣ D、由水电离产生的c(H+)=1×10﹣13mol/L的溶液中:Na+、Ba2+、NO3﹣、Cl﹣4. 一种光化学的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl﹣(aq),下列关于该电池在工作时的说法中正确的是( )
.关于它的说法中,正确的是( ) A、青蒿素是一种氧化物 B、青蒿素中氧元素的质量分数为11.9% C、青蒿素中C,H,O三种元素的质量比为90:11:40 D、青蒿素是由15个碳原子、22个氢原子和5个氧原子构成的3. 25℃时,下列各组离子在指定溶液中一定能大量共存的是( )A、滴入石蕊试液显蓝色的溶液中:K+、Na+、HSO3﹣、ClO﹣ B、0.1mol/L的Fe(NO3)3溶液中:Na+、H+、Cl﹣、I﹣ C、0.1mol/L的NaAlO2溶液中:K+、H+、NO3﹣、SO42﹣ D、由水电离产生的c(H+)=1×10﹣13mol/L的溶液中:Na+、Ba2+、NO3﹣、Cl﹣4. 一种光化学的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl﹣(aq),下列关于该电池在工作时的说法中正确的是( ) A、生成108g银,转移电子个数为1mol B、Cu+在负极发生氧化反应 C、Ag电极活泼,Ag失电子发生氧化反应 D、Cl﹣由负极迁移到正极5. 利用表中提供的仪器和药品,能达到相应实验目的是( )
A、生成108g银,转移电子个数为1mol B、Cu+在负极发生氧化反应 C、Ag电极活泼,Ag失电子发生氧化反应 D、Cl﹣由负极迁移到正极5. 利用表中提供的仪器和药品,能达到相应实验目的是( )选项
仪器
药品
实验目的
A
烧杯、玻璃棒、胶头滴管
FeCl3溶液、NaOH溶液
制Fe(OH)3胶体
B
圆底烧瓶、导气管、烧杯、铁架台
干燥的二氧化碳、蒸馏水
模拟喷泉实验
C
酸式滴定管、锥形瓶、铁架台(带铁夹)
已知浓度的盐酸,待测NaOH溶液
测定NaOH溶液的物质的量浓度
D
酒精灯、玻璃棒、蒸发皿、三脚架
NaCl溶液
蒸发溶液得到晶体
A、A B、B C、C D、D6. 织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2﹣、Cl﹣等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.25℃时,各组分含量随pH变化情况如图所示(Cl﹣没有画出),下列说法错误的是 ( )( ) A、25℃时,HClO2的电离平衡常数的数值Ka=10﹣6 B、使用该漂白剂的最佳pH为3.0 C、25℃时,等浓度的HClO2溶液和NaClO2溶液等体积混合后,混合溶液中:c(HClO2)+2c(H+)=c(ClO2﹣)+2c(OH﹣) D、该温度下NaClO2溶液中:c(Na+)>c(ClO2﹣)>c(OH﹣)>c(H+)7. 含有4molHNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示.下列有关判断不正确的是( )
A、25℃时,HClO2的电离平衡常数的数值Ka=10﹣6 B、使用该漂白剂的最佳pH为3.0 C、25℃时,等浓度的HClO2溶液和NaClO2溶液等体积混合后,混合溶液中:c(HClO2)+2c(H+)=c(ClO2﹣)+2c(OH﹣) D、该温度下NaClO2溶液中:c(Na+)>c(ClO2﹣)>c(OH﹣)>c(H+)7. 含有4molHNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示.下列有关判断不正确的是( ) A、a是Fe(NO3)3 B、n1=1 C、p=1.2 D、n3=1.5
A、a是Fe(NO3)3 B、n1=1 C、p=1.2 D、n3=1.5二、解答题
-
8. 为有效控制雾霾,各地积极采取措施改善大气质量.研究并有效控制空气中氮氧化物、碳氧化物含量显得尤为重要.
 (1)、氮氧化物研究
(1)、氮氧化物研究(i)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应:2NO(g)+O2(g)⇌2NO2(g),下列各项能说明该反应达到平衡状态的是 .
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗1molO2 , 同时生成2molNO2
(ii)在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图1所示,根据图像判断反应N2(g)+O2(g)⇌2NO(g)的△H0(填“>”或“<”).
(iii)NOx是汽车尾气中的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图2:出该反应的热化学方程式: .
(2)、碳氧化物研究(i)在体积可变(活塞与容器之间的摩擦力忽略不计)的密闭容器如图3所示,现将3molNH3和2molCO2放入容器中,移动活塞至体积V为2L,用铆钉固定在A、B点,发生合成尿素的总反应如下:
CO(g)+2H2(g)⇌CH3OH(g)
测定不同条件、不同时间段内的CO的转化率,得到如下数据:
10min
20min
30min
40min
T1
30%
55%
65%
65%
T2
35%
50%
a1
a2
①根据上表数据,请比较T1T2(选填“>”、“<”或“=”);T2℃下,第30min 时,a1= , 该温度下的化学平衡常数为 .
②T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动,再向容器中通入6molCO,此时v(正) v (逆)(选填“>”、“<”或“=”),判断的理由是 .
(ii)一定条件下可用甲醇与CO反应生成醋酸消除CO污染.常温下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO﹣),则该混合溶液中醋酸的电离常数Ka=(用含a和b的代数式表示)
9. 2015年8月12日,天津滨海新区爆炸事故确认有氰化钠、亚硝酸钠等,氰化钠毒性很强,遇水、酸会产生有毒易燃氰化氢气体.氰化氢的沸点只有26℃,因此相当容易挥发进入空气,这就大大增加了中毒的风险.同时氰化钠遇到亚硝酸钠会发生爆炸.回答下列问题(1)、写出氰化钠遇水产生氰化氢的离子方程式 .(2)、爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理.氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式 .(3)、爆炸残留在废水中的CN﹣可以用Cr2O72﹣处理,拟定下列流程进行废水处理
1)上述处理废水流程中主要使用的方法是;
a.混 凝法 b.中和法 c.沉淀法 d.氧化还原法
2)②中反应后无气体放出,该反应的离子方程式为;
3)步骤③中,每处理0.4 molCr2O72﹣时转移电子2.4 mol,该反应的离子方程式为;
4)处理酸性Cr2O72﹣废水多采用铁氧磁体法.该法是向废水中加入FeSO4 •7H2O将Cr2O72﹣还原成Cr3+ , 调节pH,Fe、Cr转化成相当于FeⅡ[FexⅡCr(2﹣x)Ⅲ]O4 (铁氧磁体,右上角的罗马数字表示该元素的化合价)的沉淀.处理1 mol Cr2O72﹣ , 需加入amol FeSO4 •7H2O,下列结论正确的是 .
A.x=0.5,a=6 B.x=0.5,a=10 C.x=1.5,a=6 D.x=1.5,a=10.
10. 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下:①配制混酸:组装如图反应装置.取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入漏斗中.把18 mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50﹣60℃下发生反应,直至反应结束.
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.已知
(i)
 +HNO3(浓)
+HNO3(浓) 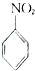 +H2O
+H2O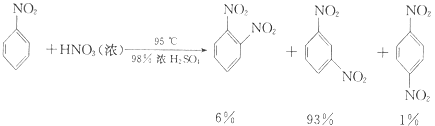
(ii)可能用到的有关数据列表如下
物质
熔点/℃
沸点/℃
密度(20℃)/g•cm﹣3
溶解性
苯
5.5
80
0.88
微溶于水
硝基苯
5.7
210.9
1.205
难溶于水
1,3﹣二硝基苯
89
301
1.57
微溶于水
浓硝酸
83
1.4
易溶于水
浓硫酸
338
1.84
易溶于水
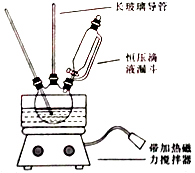
请回答下列问题:
(1)、配置混酸应先在烧杯中先加入 .(2)、恒压滴液漏斗的优点是 .(3)、实验装置中长玻璃管可用代替(填仪器名称).(4)、反应结束后产品在液体的层(填“上”或者“下”),分离混酸和产品的操作方法为(5)、用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? .(6)、为了得到更纯净的硝基苯,还须先向液体中加入除去水,然后蒸馏,最终得到17.5g硝基苯,则硝基苯的产率为(保留两位有效数字).若加热后,发现未加沸石,应采取的操作是 .三、【化学-选修2:化学与技术】
-
11. 甲酸钠广泛用作催化剂和稳定合成剂,印染行业的还原剂,还可用于生产保险粉、草酸和甲酸.用电石炉废气(CO75%~90%,以及少量CO2、H2S、N2、CH4等),其合成部分工艺流程如下:
 (1)、上述工艺用碱液洗涤的目的是 , 可能发生的反应有(列举两利).(2)、上述合成工艺中采用循环喷射吸收合成,其目的是;最后尾气主要成分是 .(3)、合成时,得到的HCOONa溶液溶质质量分数约为5%,合成塔反应液中分离出HCOONa•2H2O 的主要步骤有、、过滤,再经洗涤干燥得到.(4)、甲酸钠高温时分解制取草酸钠的化学方程式为 .(5)、在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要的工业产品保险粉(Na2S2O4),同时产生二氧化碳气体,该反应的离子方程式为 .
(1)、上述工艺用碱液洗涤的目的是 , 可能发生的反应有(列举两利).(2)、上述合成工艺中采用循环喷射吸收合成,其目的是;最后尾气主要成分是 .(3)、合成时,得到的HCOONa溶液溶质质量分数约为5%,合成塔反应液中分离出HCOONa•2H2O 的主要步骤有、、过滤,再经洗涤干燥得到.(4)、甲酸钠高温时分解制取草酸钠的化学方程式为 .(5)、在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要的工业产品保险粉(Na2S2O4),同时产生二氧化碳气体,该反应的离子方程式为 .四、【化学-选修3:物质与结构】
-
12. A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域.请回答下列各题(涉及元素请用相应化学符号表示):(1)、B,C,D中第一电离最大的元素其基态原子有种不同能量的电子.(2)、G分子中D原子的杂化方式为 , F2+的基态价电子排布式为 .(3)、BA3﹣离子的空间构型为 , 与其互为等电子体的一种阳离子的电子式为 .(4)、某化合物晶胞结构如图所示,E2+的配位数是
 (5)、用高能射线照射液态H时,一个H分子能释放出一个电子,同时产生一种阳离子.
(5)、用高能射线照射液态H时,一个H分子能释放出一个电子,同时产生一种阳离子.①释放出来的电子可以被若干H分子形成的“网”捕获,你认为H分子间能形成“网”的原因是
②由H分子释放出电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与SO2水溶液反应的离子方程式;该阳离子还能与H分子作用生成羟基,经测定此时的H具有酸性,写出该过程的离子方程式 .
五、【化学-选修5:有机化学基础】
-
13. 芳香酯I的合成路线如图:

已知以下信息:
①A﹣I均为芳香族化合物,B能发生银镜反应,D的相对分子质量比C大4,E的苯环上的一溴代物有两种.
②

③

请回答下列问题:
(1)、A的结构简式 , C→D的反应类型为 , F中不含氧的官能团的名称为 , I的结构简式为 .(2)、E→F与F→G的顺序不能颠倒,理由(3)、B与银氨溶液反应的化学方程式为 , F→G①的化学方程式为 .(4)、G还可以通过缩聚反应制得高分子材料,试写出其结构简式 .(5)、A的同分异构体很多,其中能使FeCl3溶液显紫色有种,写出一种核磁共振氢谱有4组峰的分子的结构简式 .
-
-